羊肉产品中的布鲁氏菌污染及其风险传递调查
2017-05-12
(重庆市动物疫病预防控制中心,重庆 401120)
羊肉产品中的布鲁氏菌污染及其风险传递调查
谢建华,周 莉,汪子淳,叶洁莹,梁望旺,杨泽林,熊仲良
(重庆市动物疫病预防控制中心,重庆 401120)
[目的]了解羊肉产品的布鲁氏菌污染情况和风险传递过程。[方法]对养殖和屠宰环节的羊及羊肉产品进行取样调查。[结果]屠宰环节布鲁氏菌检出率从高到低依次为羊内脏(3.14%)、羊肉(2.96%)和环境(1.11%);大中型屠宰场布鲁氏菌检出率(6.23%)高于小型屠宰场(0.48%);控制性结果表明在不发生二次污染的情况下,仅可从内脏中检出布鲁氏菌;子宫(77.78%)和脾脏(46.67%)存在布鲁氏菌的风险较大,不表现临床症状的羊子宫也有带菌风险;屠宰环节布鲁氏菌感染抗体阳性率为1.13%,羊肉产品和环境中均存在布鲁氏菌污染;屠宰环节工作人员对布鲁氏菌病防控的认识不到位,本次调查发现2名从业人员被感染。[结论]存在养殖环节的布鲁氏菌病感染羊进入屠宰生产链的风险。
布鲁氏菌病;羊肉产品;污染;风险传递
布鲁氏菌病(Brucellosis),以下简称布病,又称地中海弛张热、马耳他热或波状热,是由布鲁氏菌(Brucel la)引起的变态反应性人兽共患传染病[1]。根据生物学特性和主要宿 主,将传统的布鲁氏菌为括6个种19个型,即羊种(B. melitensis,3个型)、牛种(B. abortus,8个型)、猪种(B.Suis,5个型)、犬种(B.canis)、绵羊附睾种(B.ovis)和沙林鼠种(B. neotormae)。近年来又相继分离出鲸种(B.ceti)、鳍种(B.pinnipedialis)、田鼠种(B.microti)和未知宿主的B.inopinata[2]。牛种、羊种和猪种布鲁氏菌对人均有很强的致病性,其中尤以羊种的致病力最强,且约80%的感染是由羊型布鲁菌引起的[3]。人感染后表现为长期发热、多汗、生殖系统疾病、关节痛、肝脾肿大,以及肌肉-骨骼系统和中枢神经系统的严重并发症等,病情严重者丧失劳动力[3]。世界动物卫生组织(OIE)将该病列为须通报的动物疫病,我国将其列为二类动物疫病。据统计,布鲁氏菌病每年造成全球经济损失近30亿美元,对人类健康和畜牧业发展构成重大威胁[2,4]。
近年来,由于市场一体化等原因,我国活羊及其产品的大范围流动极其频繁,疫情极易跨区域传播,布病疫情形势依然严峻。由于羊布鲁氏菌病临床上常为隐性感染,除了怀孕母畜出现流产外,其他羊群并无临床特征,很难从外观上鉴别。鉴于现行宰前检疫办法和实验室抽检制度,很难阻止部分带菌羊进入屠宰环节,为验证羊产品中布鲁氏菌污染风险,了解生产链条中的布鲁氏菌污染风险关键点、风险来源以及风险传递过程,本研究对羊养殖和屠宰环节进行了取样调查,以期找到羊肉产品病原带毒及生产环节污染的证据,从而获得控制风险关键点,保障羊产品质量安全,促进公共卫生安全。
1 材料和方法
1.1 材料
1.1.1 取样品种及数量。屠宰环节:分别在大中型和小型屠宰场取样,全年共取羊肉405份、羊内脏446份、环境样品180份和血清353份。控制性实验:发病期(有临床症状)和隐性感染期(无临床症状)各15只羊,分别取肌肉、血、肝、脾、肾、心、肺、淋巴结、胃、肠和子宫等部位进行带菌风险验证。
1.1.2 主要试剂。布氏肉汤,购自BD公司;天隆科技核酸提取试剂盒(磁珠法),购自天隆科技有限公司;布鲁氏菌PCR检测试剂盒,购自北京世纪元亨有限公司;布鲁氏菌抗体RID检测试剂盒,购自INGEZIM IDR;布鲁氏菌病虎红平板凝集试验阳性血清、布鲁氏菌病虎红平板凝集试验阴性血清和布鲁氏菌病虎红平板凝集试验抗原,均购自青岛易邦生物工程有限公司;布鲁氏菌病抗体竞争ELISA检测试剂盒,购自SVANOVIR。
1.2 方法
1.2.1 病原学检测。对羊肉、羊内脏和环境拭子,先经布氏肉汤37 ℃增菌培养72 h,按照细菌基因组DNA提取试剂盒说明提取核酸,用于布鲁氏菌病原学PCR检测。
1.2.2 血清抗体检测。采用虎红平板凝集试验(RBT)(GB/T 18646)初筛,竞争酶联免疫吸附试验(cELISA)确诊,对以上任何一种方法检测呈阳性的样品,用布病放射免疫扩散试验(RID)方法进一步检测,区分是否为野毒感染。
1.2.3 检测数据分析。采用t检验方法,对样品检测数据进行生物学统计分析。
2 结果
2.1 羊产品布鲁氏菌污染调查结果
2.1.1 布病血清抗体检测结果。从不同地区来看,西北地区布病免疫抗体(RBT和cELISA)阳性率最高,与其他地区相比差异显著,同时还存在布鲁氏菌感染抗体(表1)。
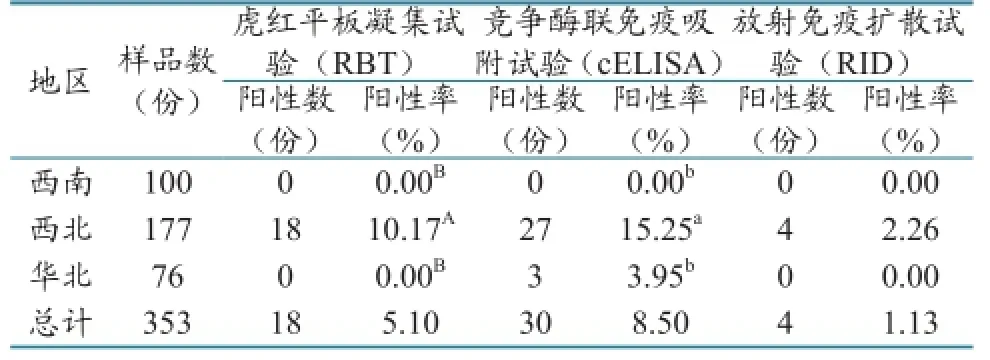
表1 屠宰环节羊布病血清抗体检测结果
2.1.2 不同屠宰规模和样品类型布鲁氏菌检测结果。从屠宰规模来看,大中型屠宰场存在布鲁氏菌的风险较高(6.23%),与小型屠宰场相比差异显著;从样品类型来看,羊内脏、羊肉和环境中都有存在布鲁氏菌的风险(表2)。
2.1.3 不同地区羊产品中布鲁氏菌检测结果。从不同地区来看,来自一类地区(西北和华北)的动物存在布鲁氏菌的风险较高(表3)。
2.2 布鲁氏菌病控制性试验检测结果
2.2.1 急性发病期与隐性感染期间布鲁氏菌检测结果。急性发病期(其中母羊9只)布鲁氏菌检测结果显示:子宫(77.78%)和脾脏(46.67%)存在布鲁氏菌的风险较大,与其他脏器相比差异显著,其次是肾脏和抗凝血,其他部位均未检测到布鲁氏菌。确诊已感染,但近期无临床症状 的15只隐性 感染期间的羊(其中母羊8只)中,在4只母羊的子宫内检测到布鲁氏菌核酸,其他羊均未检出,说明这些羊表面无临床症状,但其子宫仍存在带菌风险(表4)。
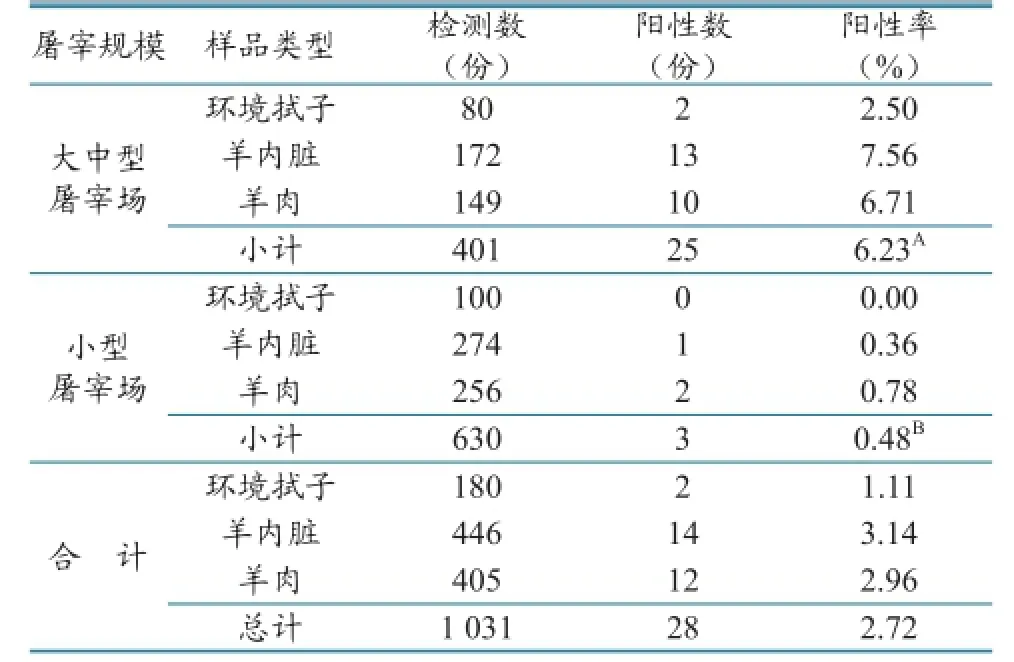
表2 不同屠宰规模和样品类型布鲁氏菌检测结果

表3 不同地区羊产品中布鲁氏菌检测结果
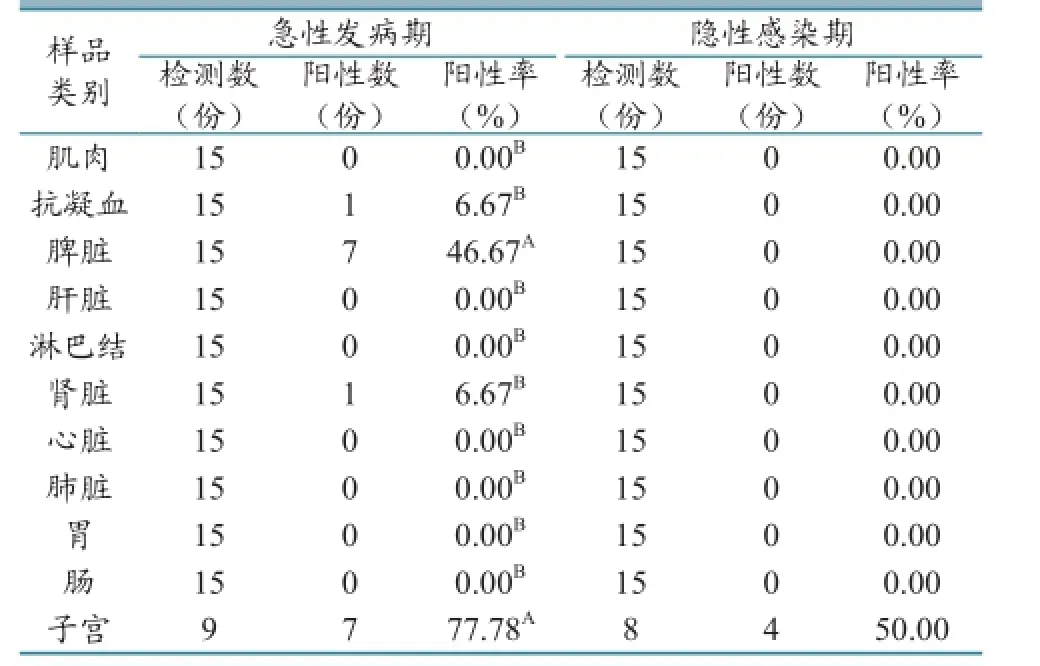
表4 急性发病期和隐性感染期布鲁氏菌检测结果
2.2.2 从业人员的风险调查结果。屠宰环节从业人员问卷调查显示,屠宰企业部分相关人员,尤其是少数民族地区的人员,对布鲁氏菌病不知晓且无个人防护意识;存在屠宰人员私自携带未经处理的羊产品(如羊胎盘)回家食用的现象。通过问卷调查发现,在取样的屠宰和养殖环节中,各有1名从业人员感染布病。
3 风险分析
3.1 屠宰环节羊产品布鲁氏菌风险分析
不同地区来源的羊产品取样调查结果表明,来自西北地区的产品带菌率为4.94%,而来自西南地区的未检出,说明西北地区作为我国布病防控一类地区,羊产品带菌风险相对较高。通过取样调查发现,屠宰环节的羊产品和环境均存在布鲁氏菌污染风险;从不同规模来看,大中型屠宰场的污染风险(6.23%)高于小型屠宰场(0.48%),原因主要是小型屠宰场清洗消毒彻底,羊的来源主要局限于当地,而大中型屠宰场待宰羊多、工作量较大,可能存在清洗不彻底、消毒不到位的问题;另一方面,羊需求量大、来源广,尤其是从一类地区来源的羊较多,从而加大了污染的概率。
3.2 风险传递过程分析
控制性试验结果表明:发病期子宫、脾脏、肾脏和血液中均有布鲁氏菌被检出,与2012年赵兵等[5]的报道相似,说明发病期内脏和血液带菌风险较大,这可能与布鲁氏菌多寄生于网状内皮系统有关[1];对于隐性感染期的羊,仅在其子宫中检出布鲁氏菌,其他部位未检出,说明对于无临床症状的感染羊,其子宫是带菌的最大风险源。
从控制性试验结果可见,无论是急性发病期,还是隐性感染期的羊,在不发生二次污染的情况下,仅可从内脏中检出布鲁氏菌;但屠宰环节布病感染抗体阳性率为1.13%,且羊产品和屠宰环境中均存在布鲁氏菌污染,可见存在布病感染羊只因宰前检疫漏检而进入屠宰生产链的风险。
3.3 从业人员的风险分析
结合问卷调查发现,养殖和屠宰环节的从业人员大多不了解布病,也没有个人防护意识,更没有采取个人防护措施,且养殖和屠宰环节均出现人感染布病病例,说明养殖和屠宰环节的从业人员是高风险人群,若防护措施不当极易导致布病感染[6-8]。
4 建议
近几年,布病疫情有上升趋势,动物发病数逐年增多,人间发病数也随之增高。人间布病与动物布病密切相关,呈一定的线性关系[3]。因此,畜牧兽医部门除了要加强与卫生计生、工商等部门的协作,强化信息沟通和联防联控外,还应做好宰前检疫,防止布鲁氏菌从养殖环节进入屠宰环节。然而传统意义上的宰前检疫无法检出隐性感染期的带菌羊只,因此应该考虑引入敏感性较高的检测方法,尽可能检出带菌羊只。在养殖环节应继续强化布病的监测净化工作,尤其是加强对羊的监测净化,优先从种羊开始,争取减少源头上的布病传播风险。同时还应加强对从业人员的职业培训,尤其是布病认知和防护知识培训,提升个人防护意识和水平,使其保持健康正确的工作和生活习惯,并定期体检,一旦发现感染布病,应紧急就医,以获得良好治疗预期。
[1] 李长友,李明. 动物布鲁氏菌病防治指导手册[M]. 北京:中国农业出版社,2012:134-137.
[2] 邱宇鹤,王锦何,淑云. 人布鲁氏菌病的流行、检测与防治研究进展[J]. 实用检验医师杂志,2015,7(3):187-188.
[3] 田克恭,李明. 动物疫病诊断技术理论与应用[M]. 北京:中国农业出版社,2014:209-218.
[4] 吐尔洪·努尔,谷文喜. 布鲁菌病研究进展[J]. 动物医学进展,2007,28(7):82-87.
[5] 赵兵,彭传真,张志新,等. 布鲁氏菌弱毒疫苗粘膜免疫及检测方法的研究[J]. 中国预防兽医学报,2012,34(8):658-661.
[6] 周莉,侯权书,黄诚,等. 布鲁氏菌病的危害与个人防护[J]. 中国动物检疫,2016,33(6):52-54.
[7] 张卫源,陈俊生,董军青,等. 鹤壁市人间布鲁氏菌病疫情分析及控制策略探讨[J]. 河南预防医学杂志,2014,25(5):404-405.
[8] 陈虎英,葛兴农. 延安市畜间布鲁氏菌病流行概况、防治现状与对策[J]. 畜牧兽医杂志,2014,5(33):93-94.
(责任编辑:杜宪)
Investigation on Brucella Contamination in Mutton Products and Its Risk Transmission
Xie Jianhua,Zhou Li,Wang Zichun,Ye Jieying,Liang Wangwang,Yang Zelin,Xiong Zhongliang
(Chongqing Animal Disease Prevention and Control Center,Chongqing 401120)
[Objective]In order to recognizeBrucellacontamination in mutton and fi nd out its risk transmission process.[Methods]An investigation was carried out towards sheep and mutton products in the links of sheep breeding and slaughtering.[Results]From high to low,the detection rates ofBrucellawere 3.14%(samples were from viscera),2.96%(mutton),and 1.11%(environment). Otherwise,the detection rates in large and medium slaughterhouses(6.23%)were higher than that in small slaughterhouses(0.48%). The control test results showedBrucellacould only be detected in viscera in the absence of secondary contamination. Probability of detectingBrucellafrom uteri and spleens was high,the ratios of which were 77.78% and 46.67%,respectively. It was worth noting that,sheep uteri without clinic symptoms also had infection risk. The antibody positive rate ofBrucellain the slaughtering link was 1.13%,andBrucellawas found in mutton products and the environment. Besides,the staffs in slaughtering link lacked enough awareness in protecting themselves to avoidBrucellainfection,and 2 practitioners were confi rmed to be infected byBrucellain this investigation.[Conclusion]The risk ofBrucellaspreading in the whole chain from sheep breeding to slaughtering existed actually.
Brucellosis;mutton products;contamination;risk transmission
S855.1
:B
:1005-944X(2017)05-0031-04
10.3969/j.issn.1005-944X.2017.05.009
农业部畜禽产品质量安全风险评估项目(GJFP2017007);农业部援疆项目“动物产品中七种主要人兽共患致病菌风险评估技术研究”(cstc2016shmszx80121)
熊仲良
