凝胶过滤/离子交换全二维液相色谱系统的构建与评价
2017-05-11杨三东孙元社张维冰
张 政, 唐 涛, 杨三东, 孙元社, 李 彤, 张维冰
(1. 齐齐哈尔大学化学与化学工程学院, 黑龙江 齐齐哈尔 161006; 2. 大连依利特分析仪器有限公司,辽宁 大连 116023; 3. 华东理工大学 上海市功能性材料化学重点实验室, 上海 200237)
研究论文
凝胶过滤/离子交换全二维液相色谱系统的构建与评价
张 政1,2, 唐 涛2, 杨三东2, 孙元社2, 李 彤2, 张维冰1,3*
(1. 齐齐哈尔大学化学与化学工程学院, 黑龙江 齐齐哈尔 161006; 2. 大连依利特分析仪器有限公司,辽宁 大连 116023; 3. 华东理工大学 上海市功能性材料化学重点实验室, 上海 200237)
基于蛋白质的尺寸及带电性质,将凝胶过滤色谱(GFC)与离子交换色谱(IEC)两种分离模式结合,采用双捕集柱接口构建了GFC/2×IEC二维液相色谱(2-D LC)分离系统,同时考虑离子交换色谱分离蛋白质对等电点范围的限制,进一步结合中心切割平行柱的方法实现对蛋白质的全二维分离。为与后续蛋白质在线酶解、多肽分离及质谱鉴定匹配,系统中采用常规柱以保证蛋白质质谱鉴定对样品量的要求,3种常规分离柱分别选用凝胶过滤色谱柱TSK-GEL G3000SWXL(300 mm×7.8 mm, 5 μm)、强阴离子交换色谱柱Hypersil SAX(100 mm×4.6 mm, 10 μm)和强阳离子交换色谱柱Hypersil SCX(100 mm×4.6 mm, 10 μm)。最终以酵母细胞蛋白质提取液为样品,对构建的二维系统加以评价,在总蛋白质浓度13.5 mg/mL、上样体积100 μL的条件下,将第一维分离等时间切割17次,并将切割馏分全部导入第二维继续分离,二维系统在148 min内获得的总峰容量达到884。说明所构建的系统可以用于蛋白质的在线全二维分离。
全二维液相色谱;凝胶过滤色谱;离子交换色谱;强阴离子交换;强阳离子交换;蛋白质;酵母
蛋白质组学研究目前已成为生命科学乃至自然科学领域的重大科学命题,与人体代谢及疾病的预测、诊断、治疗等密切相关。蛋白质和多肽等生物样品的高效分离分析是蛋白质组学研究的关键与难点。高效液相色谱是常用的生物样品分离手段,但随着研究的深入,为获得更大的峰容量和更高的分辨率,二维液相色谱(two-dimensional LC, 2-D LC)获得了广泛的关注,并在复杂生物样品的分离分析中取得了令人瞩目的成果。
前期工作中,我们已完成了离子交换色谱/反相色谱(IEC/RPC)[1,2]、强阴离子交换-五氟苯酚/反相色谱(SAX-PFP/RPC)[3]等2-D LC系统的构建,并在蛋白质、白酒和中药等复杂样品的应用中取得了良好的分离效果。此外,其他学者建立的RPC/RPC[4,5]、亲水作用色谱/反相色谱(HILIC/RPC)[6]、柱切换循环体积排阻色谱/反相色谱(csrSEC/RPC)[7]、阵列式(array-based)2-D LC[8]等二维分离系统已成功用于复杂生物样品的研究中。SEC和IEC因具有良好的生物兼容性,已被广泛应用于蛋白质组学的研究中[9,10]。SEC和IEC分别与RPC结合所构建的二维液相色谱系统也常被应用于复杂样品的分离分析[11,12],但将SEC和IEC这两种分离模式彼此结合的研究仍较少。Bushey等[13]构建了IEC/SEC全二维液相色谱系统,通过对分离系统的自动化控制和方法优化,在分离9种标准蛋白质的过程中获得了126的峰容量;Elkin等[14]构建了SEC/IEC二维系统,采用中心切割法对复杂基质中的肌醇六磷酸进行二维分离,灵敏度和重复性均能满足分析需求。与IEC/RPC或SEC/RPC二维液相色谱系统相比,SEC/IEC二维分离系统的分辨率略显不足,但二者的结合除了具有良好的生物兼容性外,还具有良好的正交性,可以提供互补的样品信息,其流动相的兼容性也可使样品直接从一维转移到另一维,无需特殊处理。
本文基于分子尺寸及带电性质的差异,将凝胶过滤色谱(GFC)与IEC两种分离模式结合,同时考虑到蛋白质等电点(pI)范围对离子交换色谱分离的限制,进一步在第二维并联强阴离子交换和强阳离子交换(SCX)常规分析柱,以实现全等电点范围蛋白质的分离,最终将构建的GFC/2×IEC全二维液相色谱分离系统应用于酵母细胞蛋白质提取液的分离分析,在总分离时间148 min内,二维系统共获得了884的峰容量。该系统可用于蛋白质组学研究中蛋白质在线分离、在线酶解、肽段在线分离及质谱鉴定分析平台的蛋白质初分离。
1 实验部分
1.1 仪器与试剂
全二维液相色谱分离系统(包括ichrom P5102高压恒流泵、ichrom M5102组织器、ichrom D5101紫外-可见检测器、P1201高压恒流泵各两台)、Hypersil SAX色谱柱(100 mm×4.6 mm, 10 μm)、Hypersil SCX色谱柱(100 mm×4.6 mm, 10 μm)、Hypersil SAX捕集柱(10 mm×4.6 mm, 10 μm)、Hypersil SCX捕集柱(10 mm×4.6 mm, 10 μm)均由大连依利特分析仪器有限公司提供;TSK-GEL G3000SWXL凝胶过滤色谱柱(300 mm×7.8 mm, 5 μm,日本TOSOH公司);两位十通阀(美国Valco Instruments公司);Rheodyne 7725i型进样阀(美国IDEX公司); CPX 130 SERIAL超声波破碎仪(美国Cole-Parmer公司); MK3酶标仪(美国Thermo公司); Allegra 64R离心机(美国Beckman Coulter公司)。
盐酸胍(美国Sigma公司);磷酸二氢钠(NaH2PO4)、磷酸氢二钠(Na2HPO4)、氯化钠(NaCl)和磷酸(H3PO4)(分析纯,天津科密欧化学试剂有限公司); 0.45 μm水系微孔滤膜(上海迪清过滤技术有限公司)。实验用酵母细胞由中国科学院大连化学物理研究所提供;实验室用纯水为超纯水机(德国Merck公司)制备。
1.2 酵母细胞中蛋白质的提取
酵母细胞用6 mol/L盐酸胍溶解,超声破碎6 min,于4 ℃以20 000 g离心30 min,移取上清液,于-80 ℃保存待用。
1.3 流动相的配制
SAX的流动相A:准确量取190 mL 10 mmol/L NaH2PO4溶液和810 mL 10 mmol/L Na2HPO4溶液,混匀,配制10 mmol/L磷酸盐缓冲液(pH 7.5); SCX的流动相A:准确量取948 mL 10 mmol/L NaH2PO4溶液和52 mL 10 mmol/L Na2HPO4溶液,混匀,配制10 mmol/L磷酸盐缓冲液(pH 5.6); SAX和SCX的流动相B:分别向1 L 10 mmol/L磷酸盐缓冲液(pH 7.5)和1 L 10 mmol/L磷酸盐缓冲液(pH 5.6)中加入58.44 g NaCl,配制SAX和SCX的流动相B。所有流动相经0.45 μm滤膜过滤后使用。
2.6 香菇普通粉、超微粉持水性比较 由图6可见,香菇普通粉和超微粉的持水性指数存在显著性差异(P<0.05)。这是因为随着粉体粒径的减小,粉体分子变小,其对水分子的束缚力也变小,因而持水能力下降。此外,超微粉碎后粉末,由于破壁效应,水溶性分子变多,也会使持水能力下降。
1.4 色谱条件
1.4.1 GFC分离体系
色谱柱:TSK-GEL G3000SWXL(300 mm×7.8 mm, 5 μm);流动相:10 mmol/L磷酸盐缓冲液(pH 7.5);等度洗脱;总分析时间:142 min;流速:0.1 mL/min;进样量:5 μL;检测波长:280 nm;馏分切割次数:17次。
1.4.2 SAX分离体系
色谱柱:Hypersil SAX(100 mm×4.6 mm, 10 μm);流动相A: 10 mmol/L磷酸盐缓冲液(pH 7.5);流动相B: 10 mmol/L磷酸盐缓冲液(pH 7.5)-1 mol/L NaCl。梯度洗脱程序:0~4.50 min, 0%B~100%B; 4.50~4.51 min, 100%B~0%B; 4.51~6.00 min, 0%B。流速:2.0 mL/min;进样量:5 μL;检测波长:280 nm。
1.4.3 SCX分离体系
色谱柱:Hypersil SCX(100 mm×4.6 mm, 10 μm);流动相A: 10 mmol/L磷酸盐缓冲液(pH 5.6);流动相B: 10 mmol/L磷酸盐缓冲液(pH 5.6)-1 mol/L NaCl。其他色谱条件同1.4.2节。

图 1 全二维液相色谱系统及阀切换的示意图Fig. 1 Schematic diagrams of comprehensive 2-D LC system and valves switcha. 1-10 positions; b. 1-2 positions; P1: HPLC constant flow pump; C1: gel filtration chromatography (GFC) analytical column; P2 and : HPLC gradient pump; T1 and : strong anion exchange (SAX) trap column; C2: SAX analytical column; UV and UV′: UV detector; P3: dilution pump; T2 and : strong cation exchange (SCX) trap column; : SCX analytical column; W: waste fluid.
1.5 GFC/2×IEC全二维液相色谱分离系统的构建
2 结果与讨论
2.1 GFC/2×IEC全二维液相色谱的分离原理


表 1 两个十通阀的状态及流动相在3种分离模式中的流路

本实验中,针对蛋白质组成复杂、相对丰度差异大的特点,第一维采用GFC常规分析柱,将蛋白质按尺寸不同进行分离;第二维采用IEC常规分析柱,将第一维洗脱馏分根据离子交换能力的不同进一步分离。常规柱的柱容量较大,相比小柱容量的色谱柱,能够提高进样量,从而提高检测灵敏度。同时常规色谱柱的使用还可获得更好的重复性和稳定性,为后续实验中蛋白质在线酶解、肽段在线分离及质谱鉴定做好铺垫。在全二维液相色谱中,第一维的流出组分需被第二维分离3次以上才能保证第一维的分辨率基本不变[15],因此第一维采用低流速(0.1 mL/min, 142 min)等度洗脱,第二维采用高流速(2.0 mL/min, 6 min)梯度洗脱。基于对蛋白质等电点范围的考虑,进一步结合中心切割平行柱的方法,在第二维并联SAX和SCX分析柱,实现对蛋白质全等电点范围的全二维分离。

2.2 色谱条件的优化及性能评价
在凝胶过滤色谱分离中,当流动相一定时,流速对生物大分子的分辨率影响较小[16]。实验考察了不同流速下,酵母细胞蛋白质提取液在GFC中的分离情况。结果表明,酵母细胞蛋白质在低流速和高流速下的色谱峰形基本一致,考虑到两维之间分析时间和分离速度的匹配性,最终选择0.1 mL/min的洗脱流速进行等度洗脱。同时考虑到两维之间流动相的匹配性,GFC分离体系选择与SAX分离体系中初始条件相同的流动相作为洗脱溶剂,排除流动相的不兼容问题。酵母细胞蛋白质的色谱图见图2。

图 2 采用GFC时酵母蛋白质的色谱图Fig. 2 Chromatogram of the yeast protein by using GFC1-17: cutting times; column: TSK-GEL G3000SWXL (300 mm×7.8 mm, 5 μm); mobile phase: 10 mmol/L phosphate buffer (pH 7.5); isocratic elution; flow rate: 0.1 mL/min; injection volume: 5 μL; UV detection wavelength: 280 nm.
第二维IEC的分离情况受流动相的pH、盐浓度和流速等因素的影响较大。为调节流动相的pH,缓冲液选择缓冲范围较宽的NaH2PO4和Na2HPO4缓冲体系。第二维IEC使用硅胶基质型色谱柱,pH适用范围为2.0~8.0,因此将第二维SAX分离体系流动相的pH设为7.5,对pI值小于7.5的蛋白质进行分离;第二维SCX作为并联色谱柱与SAX色谱柱同时使用,用来分离pI值大于或等于7.5的蛋白质,所以流动相的pH设为5.6。分别将流动相的pH设为5.6和7.5,不但可以实现全等电点范围的蛋白质的分离需求,还可满足生物样品对生存环境的要求,具有良好的生物兼容性。为使第二维能够快速完成分离,选择在流动相中加入1 mol/L的NaCl,并以2 mL/min的流速进行梯度洗脱,由于捕集柱与分析柱填料相同,而且是柱长分别为10 mm和100 mm的常规色谱柱,所以在高流速的分离过程中压力相对较低,系统适用性良好。为使第二维的SAX和SCX分离同步,选择相同的洗脱程序,优化后的洗脱程序见1.4.2和1.4.3节。采用SAX和SCX色谱柱时,酵母蛋白质的色谱图分别见图3a和图3b,可以看出,酵母细胞蛋白质在SAX色谱柱中保留较强,因此在第二维分离中将SAX色谱柱置于SCX色谱柱前,构成两根分析柱并联的结构。
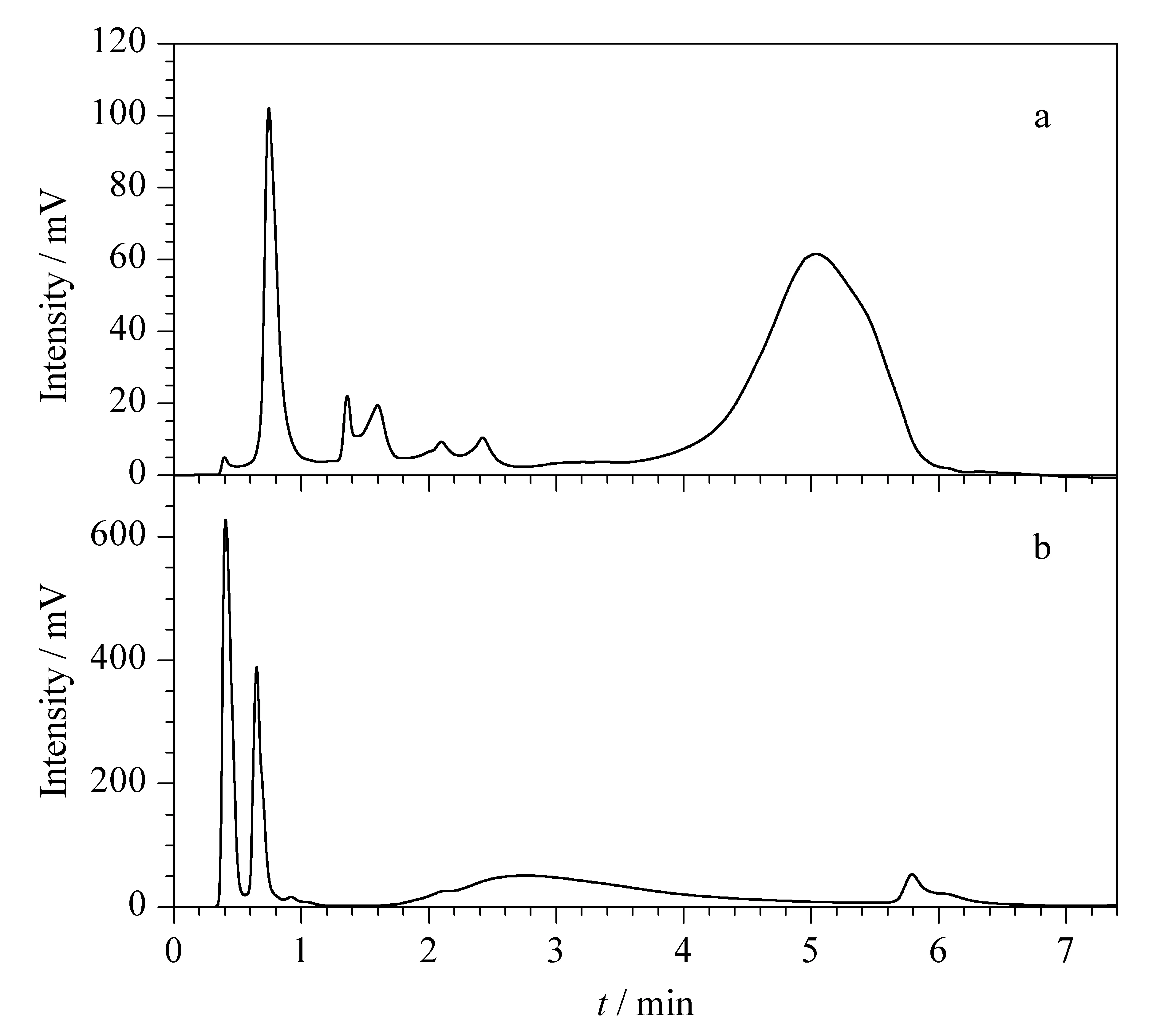
图 3 酵母蛋白质在(a)SAX和(b)SCX色谱柱中的色谱图Fig. 3 Chromatograms of the yeast protein by (a) the SAX and (b) SCX columnsa. column: Hypersil SAX (100 mm×4.6 mm, 10 μm); mobile phase A: 10 mmol/L phosphate buffer (pH 7.5); mobile phase B: 1 mol/L NaCl in 10 mmol/L phosphate buffer (pH 7.5); gradient elution: 0-4.50 min, 0%B-100%B, 4.50-4.51 min, 100%B-0%B, 4.51-6.00 min, 0%B; flow rate: 2.0 mL/min; injection volume: 5 μL; UV detection wavelength: 280 nm. b. column: Hypersil SCX (100 mm×4.6 mm, 10 μm); mobile phase A: 10 mmol/L phosphate buffer (pH 5.6); mobile phase B: 1 mol/L NaCl in 10 mmol/L phosphate buffer (pH 5.6); other conditions are the same as SAX separation.
二维在线分离系统良好的重复性是进行分离分析的首要基础,根据文献[7]对二维分离系统重复性的评价方法,选择酵母细胞蛋白质提取液作为样品,对全二维液相系统的重复性进行评价。分别对第一维GFC分离体系和第二维SAX和SCX分离体系进行重复实验,并对酵母细胞蛋白质的保留时间和峰面积进行分析。结果表明,在GFC分离体系中选取4个色谱峰进行评价(见图4),其保留时间和峰面积的相对标准偏差(RSD)分别为0.03%~0.34%和2.57%~7.62%(n=3);在SAX分离体系中选取5个色谱峰进行评价(见图5a),其保留时间和峰面积的RSD分别为0.24%~1.25%和1.26%~4.81%(n=5);在SCX分离体系中选取5个色谱峰进行评价(见图5b),其保留时间和峰面积的RSD分别为0.03%~0.59%和1.27%~7.51%(n=5)。结果表明,第一维和第二维色谱分离均具有良好的重复性,为酵母细胞蛋白质提取液的二维分离分析奠定了良好基础。

图 4 采用GFC时酵母蛋白质的色谱图(n=3)Fig. 4 Chromatograms of the yeast protein by using GFC (n=3)Analytical conditions were the same as in Fig. 2.Peaks 1-4 represent four levels of the yeast protein from large to small according to the molecular weight.

图 5 酵母蛋白质采用(a)SAX和(b)SCX色谱柱时的色谱图(n=5)Fig. 5 Chromatograms of the yeast protein by using (a) SAX and (b) SCX columns (n=5)Analytical conditions were the same as in Fig. 3.Peaks 1-5 represent five levels of the yeast protein from positive charge to negative charge and less to more (in Fig. 5a), or negative charge to positive charge and less to more (in Fig. 5b) according to the electric properties, respectively.
2.3 酵母细胞蛋白质的全二维分离
本文将GFC和IEC两种分离模式结合,构建的在线二维分离系统在第二维并联两根保留机理不同的离子交换柱实现了全二维分离,大大提高了峰容量和分离能力。此外,在线的分离模式[17]相比于离线分离模式[18],可减少样品损失、节省分析时间并实现分离系统的自动化运行。实验所用的酵母蛋白质通过BCA(bicinchonininc acid)浓度测定法测得其浓度为13.5 mg/mL。实验所用酵母提取液中存在1 484种蛋白质[19],其种类繁多,分子尺寸和等电点分布广泛[20],适合用来评价二维分离系统的分离能力。
在二维分离过程中,样品先通过进样阀进入第一维GFC分析柱中,将蛋白质按相对分子质量大小进行初筛,当第一维分析的死时间结束时,带有不同带电性质的蛋白质依次被SAX和SCX捕集柱捕集,进而被两个十通阀切换到第二维SAX和SCX分析柱中进一步分离。本实验在第一维GFC分离体系中分别尝试了12 min和6 min的捕集时间,第二维SAX和SCX分离体系的分析时间对其应。当第一维GFC分离体系的捕集时间为12 min时,第一维馏分切割了8次,切割的馏分全部导入第二维SAX和SCX分离体系继续分离,对应的酵母蛋白质的色谱图见图6;当第一维GFC分离体系的捕集时间为6 min时,第一维馏分切割了17次,对应色谱图见图7。可以看出,酵母蛋白质经过17次切割后,获得了更多的色谱峰,体现出二维分离体系在分离复杂样品时具有较强的分离能力。

图 7 第一维馏分切割17次时酵母蛋白质的色谱图Fig. 7 Chromatograms of the yeast protein of the first dimensional fractions by cutting 17 timesFirst dimensional GFC separation (injection volume 100 μL) was cut for 17 times, and the other analytical conditions were the same as in Fig. 3.
峰容量可以更加直观地体现二维系统的分离能力,同时也是描述二维系统分离能力的指标[21,22]。一维峰容量的计算方法[2]为nc=L/(4σ),式中nc、L(min)及4σ(min)分别表示一维峰容量、有效洗脱时间及平均峰宽;二维系统总峰容量计算方法[2]为nc′=nc×ct,式中nc′及ct分别表示二维峰容量和一维切割次数。本实验考察了第一维分别进行8次和17次切割时,第二维IEC对应的总峰容量(根据二维系统峰容量公式计算),结果见表2。可以看出,第一维经过17次切割后,无论是一维峰容量还是二维系统的总峰容量均高于切割8次后的峰容量。在总分离时间148 min内,第一维GFC分离体系馏分经过17次切割,二维系统获得的峰容量总和达到了884,与参考文献[2]中的峰容量890相差无几,且单位时间内同样获得了可观的峰容量,体现出该系统在蛋白质分离分析中具有一定的应用前景。
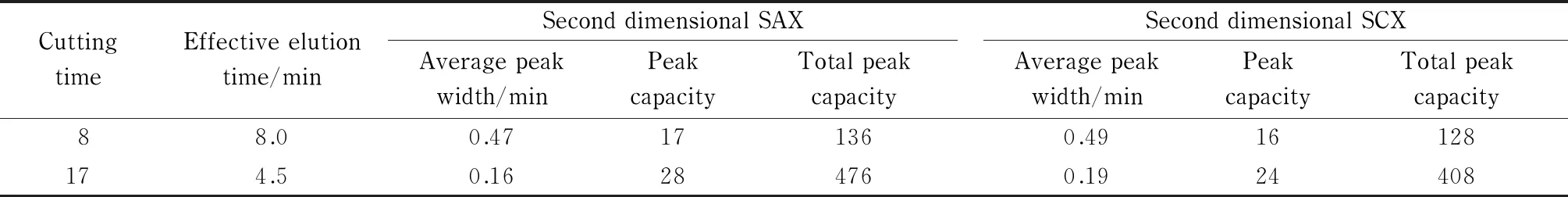
表 2 第二维SAX和SCX分离的总峰容量及相关参数
3 结论
本文基于酵母蛋白质的尺寸及带电性质,构建了GFC/2×IEC全二维液相色谱分离系统,实现了全等电点范围酵母蛋白质的分离。同时考虑到蛋白质在后续酶解、分离、质谱鉴定等一系列实验中对样品量的要求,在二维系统的构建中选择了常规尺寸的分析柱,保证了后续实验的样品量。因此构建的全二维分离系统可用于蛋白质组学研究平台中蛋白质的初分离。
[1] Wang Z C, Zhang Q H, Zhang W B, et al. Chemical Journal of Chinese Universities, 2005, 26(3): 426
王智聪, 张庆合, 张维冰, 等. 高等学校化学学报, 2005, 26(3): 426
[2] Li D X, Zhang L Y, Wang Z C, et al. Chromatographia, 2011, 73(9/10): 871
[3] Li D X, Dück R, Schmitz O J. J Chromatogr A, 2014, 1358: 128
[4] Sommella E, Pepe G, Ventre G, et al. J Chromatogr A, 2015, 1375: 54
[5] Mondello L, Donato P, Cacciola F, et al. J Sep Sci, 2010, 33(10): 1454
[6] Mihailova A, Malerod H, Wilson S R, et al. J Sep Sci, 2008, 31(3): 459
[7] Yuan H M, Zhang L H, Zhang W B, et al. J Chromatogr A, 2009, 1216: 7024
[8] Huang Z, Yan G Q, Gao M X, et al. Anal Chem, 2016, 88(4): 2440
[9] Yang R, Tang Y, Zhang B, et al. J Pharm Biomed Anal, 2015, 109: 52
[10] Fekete S, Beck A, Veuthey J L, et al. J Pharm Biomed Anal, 2015, 113: 43
[11] Li Y, Gu C, Gruenhagen J, et al. J Chromatogr A, 2015, 1393: 81
[12] Stoll D R, Talus E S, Harmes D C, et al. Anal Bioanal Chem, 2015, 407(1): 265[13] Bushey M M, Jorgenson J W. Anal Chem, 1990, 62(2): 161[14] Elkin K R, Slingsby R, Bryant R B. Talanta, 2016, 156: 6
[15] Murphy R E, Schure M R, Foley J P. Anal Chem, 1998, 70(20): 4353
[16] Wang Z C, Zhang Q H, Zhang W B, et al. Chinese Journal of Analytical Chemistry, 2005, 33(4): 437
王智聪, 张庆合, 张维冰, 等. 分析化学, 2005, 33(4): 437
[17] Yuan H M, Zhou Y, Xia S M, et al. Anal Chem, 2012, 84(11): 5124
[18] Tao D Y, Sun L L, Zhu G J, et al. J Sep Sci, 2011, 34(1): 83
[19] Washburn M P, Wolters D, Yates J R. Nat Biotechnol, 2001, 19(3): 242
[20] Ma Y, Zhang W J, Wei J Y, et al. Chinese Journal of Chromatography, 2011, 29(3): 205
马岩, 张万军, 卫军营, 等. 色谱, 2011, 29(3): 205
[21] Qiao X, Song W, Ji S, et al. J Chromatogr A, 2014, 1362: 157
[22] Sun W Y, Tong L, Miao J Z, et al. J Chromatogr A, 2016, 1431: 79
Construction and evaluation of gel filtration/ion exchange comprehensive two-dimensional liquid chromatography system
ZHANG Zheng1,2, TANG Tao2, YANG Sandong2, SUN Yuanshe2,LI Tong2, ZHANG Weibing1,3*
(1.CollegeofChemistryandChemicalEngineering,QiqiharUniversity,Qiqihar161006,China;2.DalianEliteAnalyticalInstrumentsCo.,Ltd.,Dalian116023,China; 3.ShanghaiKeyLaboratoryofFunctionalMaterialsChemistry,EastChinaUniversityofScienceandTechnology,Shanghai200237,China)
A two-dimensional liquid chromatography (2-D LC) system was developed with gel filtration chromatography (GFC) and ion exchange chromatography (IEC) based on the sizes and electric properties of proteins. A double-trap-column interface was used in the GFC/2×IEC 2-D LC system. To achieve the comprehensive 2-D separation, heart-cutting parallel columns were used in the second dimension considering the isoelectric point range of proteins. A general proteomic platform was established with protein separation, online digestion, peptide separation and mass identification. A TSK-GEL G3000SWXLcolumn (300 mm×7.8 mm, 5 μm), a Hypersil SAX column (100 mm×4.6 mm, 10 μm) and a Hypersil SCX column (100 mm×4.6 mm, 10 μm) were used to separate the yeast protein samples. The GFC/2×IEC 2-D LC system was evaluated with the yeast protein samples (100 μL) of concentration of 13.5 mg/mL. First dimensional GFC fractions were cut for 17 times within 148 min and transferred continuously to the second dimension to continue the separation. Under the optimized conditions, the total peak capacity of 2-D LC system reached 884. The results demonstrated that the 2-D LC system can be used for on-line protein separation. The protein separation module has a great prospect in the field of proteomic research.
comprehensive two-dimensional liquid chromatography (2-D LC); gel filtration chromatography (GFC); ion exchange chromatography (IEC); strong anion exchange (SAX); strong cation exchange (SCX); protein; yeast
10.3724/SP.J.1123.2016.12006
2016-12-04
国家重大科学仪器设备开发专项(2012YQ12004406).
Foundation item: National Major Instrument and Equipment Special Project (No. 2012YQ12004406).
O658
A
1000-8713(2017)05-0526-07
* 通讯联系人.Tel:(021)64252145,E-mail:weibingzhang@ecust.edu.cn.
