超高效液相色谱-四极杆-飞行时间质谱定性研究茶叶籽中的酚类化合物
2017-05-11赖国银王俐娟曾秋梅徐敦明王晓琴林立毅张志刚吕美玲
赖国银, 王俐娟, 卢 鹤, 曾秋梅, 徐敦明*,王晓琴, 林立毅, 张志刚, 吕美玲
(1. 厦门出入境检验检疫局, 福建 厦门 361026; 2. 华侨大学化工学院华侨大学油脂及天然产物研究所,福建 厦门 361021; 3. 安捷伦科技(中国)有限公司, 北京 100102)
研究论文
超高效液相色谱-四极杆-飞行时间质谱定性研究茶叶籽中的酚类化合物
赖国银1, 王俐娟2, 卢 鹤2, 曾秋梅2, 徐敦明1*,王晓琴2, 林立毅1, 张志刚1, 吕美玲3
(1. 厦门出入境检验检疫局, 福建 厦门 361026; 2. 华侨大学化工学院华侨大学油脂及天然产物研究所,福建 厦门 361021; 3. 安捷伦科技(中国)有限公司, 北京 100102)
采用超高效液相色谱(UHPLC)-四极杆-飞行时间质谱(Q-TOF/MS)技术定性分析茶叶籽中的酚类化合物。茶叶籽样品经乙醇水溶液提取后经反相色谱分离,通过Q-TOF/MS进行化合物的鉴定。基于山茶属及相关植物化学组成的文献,建立了一个含有106种酚类化合物的数据库。对UHPLC-Q-TOF/MS采集得到的一级质谱数据进行数据库检索,然后对检索到的化合物色谱峰进行二级质谱扫描,根据得到的碎片离子推断化合物的结构。初步推断出茶叶籽提取物中的24种酚类化合物,包括13种酚酸类、4种儿茶素类和7种黄酮类化合物,并通过与标准品比对,进一步确证了这些化合物。结果表明UHPLC-Q-TOF/MS技术可以用于对茶叶籽中酚类化合物进行快速、准确、可靠的定性分析,促进新化合物的发现与鉴别。
超高效液相色谱;四极杆-飞行时间质谱;酚类化合物;茶叶籽
茶树(CamelliaSinensisO.Ktze)为山茶科山茶属植物,起源于我国云贵高原[1]。茶树叶子、果实等植物材料富含茶多酚[2]。酚类化合物是植物中一种重要的次生代谢产物,其分子结构中含有若干个酚性羟基基团,一般分为酚酸类、黄酮类、单宁类、黄烷醇类和苷类等[3]。儿茶素类是山茶属植物的特征酚物质,属于黄烷醇类化合物,一般存在于该属植物的花、茎、叶和果实中[4,5]。研究表明,植物酚类化合物是一种天然抗氧化剂,能清除人体内的一氧化氮(NO)和活性氧(ROS)自由基[6],抑制氧化酶活性和激活抗氧化酶体系[7]。另有报道表明,酚类化合物能有效抑制细菌和真菌的生长[8,9],同时可以抑制癌细胞增殖,降低致癌诱变剂的活性[10]。
目前,国内外对茶叶籽酚类化合物组成的研究报道不多,主要集中于对酚类物质提取工艺的优化和总酚含量的测定[11,12],其中应用最为广泛的分析技术为紫外分光光度法[13],而对酚类化合物组成的定性则采用超高效液相色谱(UHPLC)技术[14]。显然,目前的分析方法依赖已知的标准品,具有一定的局限性;同时,液相色谱技术灵敏度不高,难以用于微量物质的鉴定。超高效液相色谱-四极杆-飞行时间质谱(UHPLC-Q-TOF/MS)是目前酚类化合物研究中应用较好的定性技术,可以提高分析的特异性和准确度。该技术能够在无标准品的情况下对粗提液中微量物质进行初步组成和结构分析,灵敏度和选择性高,已广泛应用于橄榄油中多酚物质的测定,大大推动了橄榄油中微量活性物质分析的进展[15-17]。
为了能够深入了解茶叶籽中酚类化合物的组成,本实验采用UHPLC-Q-TOF/MS技术,对茶叶籽乙醇提取物进行研究分析。通过自建酚类化合物数据库结合Mass Hunter Q-TOF/MS数据采集与定性软件对茶叶籽提取物中的酚类物质进行初步检索。检索到的化合物进一步进行二级质谱分析,根据碎片离子信息判断化合物的可能结构,并利用标准品比对的方式确证化合物,为全面快速分析茶叶籽成分及其深度研发应用提供参考。
1 实验部分
1.1 材料与试剂
茶叶籽采自福建省泉州市安溪茶园。
乙腈、甲醇、甲酸(均为色谱纯,美国Sigma-Aldrich公司);正己烷(色谱纯,西陇化工股份有限公司);实验用水为自制超纯水;苯甲酸、4-羟基苯甲酸、原儿茶酸、一水合没食子酸、邻苯二甲酸、4-羟基苯乙酸、香草酸、肉桂酸、对香豆酸、咖啡酸、阿魏酸、芥子酸、绿原酸、表儿茶素、芹菜素、山柰酚、木犀草素、槲皮素、杨梅素、柚皮素、二氢槲皮素(均为分析级标准品,阿拉丁试剂公司);儿茶素、表没食子儿茶素、表没食子儿茶素没食子酸酯(均为分析级标准品,美国Sigma公司); 0.2 μm有机滤膜(英国Whatman公司)。
1.2 仪器与设备
Agilent 1290系列超高效液相色谱仪(美国Agilent公司),配备在线脱气系统、四元泵、自动进样装置、柱温箱;Agilent 6540UHD高分辨飞行时间质谱仪(美国Agilent公司),配备鞘流双电喷雾离子源(dual Jet Stream ESI), Mass Hunter Data Acquisition实时采集工作站,Qualitative Analysis离线分析软件和Mass Hunter PCDL Manager个人化合物数据库与谱图库创建软件;BS2202S分析天平(德国Sartorious公司); QL-861漩涡混合器(海门其林贝尔仪器制造公司);离心机(湖南湘仪实验室仪器开发有限公司); R215旋转蒸发仪(瑞士BUCHI公司),配备B491水浴锅、V700真空泵;DLSB-10/20低温冷却液循环泵(郑州长城科工贸公司)。
1.3 实验条件
1.3.1 色谱条件
色谱柱:Agilent Eclipse Plus-C18(100 mm×2.1 mm, 1.8 μm);流动相:A为0.1%(v/v)甲酸水溶液,B为0.1%(v/v)甲酸乙腈溶液。梯度洗脱:0~5 min, 5%B~10%B; 5~7 min, 10%B~20%B; 7~9 min, 20%B; 9~10 min, 20%B~50%B; 10~12 min: 50%B; 12~13 min, 50%B~5%B; 13~15 min, 5%B。流速0.4 mL/min;柱温30 ℃;进样量2.0 μL;平衡时间3 min。
1.3.2 质谱条件
采用鞘流双电喷雾离子源在负离子扫描方式下进行数据采集,参比离子m/z为112.985 5和980.016 3。干燥气为高纯N2,毛细管电压4 000 V,雾化气压力207 kPa,碎裂电压140 V,干燥气温度190 ℃,干燥气流速9 L/min,鞘气温度350 ℃,鞘气流速10 L/min,离子扫描范围m/z100~1 100。二级质谱参数中碰撞能量设定为10~40 eV。每天采集运行前,使用调谐液(含125 μmol/L三氟乙酸铵、5 μmol/L嘌呤和1.25 μmol/L六-(1-氢,2-氢,3-氢-全氟丙氧基)磷氮混合溶液(溶剂为乙腈-水,95∶5, v/v)进行质量轴校准。
1.4 样品前处理
准确称取茶叶籽粉1.00 g于100 mL锥形瓶中,加入25 mL提取液(体积分数为50%的乙醇水溶液)摇匀,于60 ℃下振荡提取1 h后在4 000 r/min转速下离心10 min,收集上层澄清液。继续向剩余沉淀物中加入10 mL提取液清洗,离心收集上清液。重复提取3次,合并上清液,于35 ℃下旋蒸浓缩至干后用50%(v/v)甲醇水溶液定容至250 μL,溶解液经0.2 μm有机滤膜过滤,密封冷藏待分析。
2 结果与讨论
2.1 条件优化
2.1.1 色谱条件的优化
由于茶叶籽提取物化学成分复杂,因此本实验对色谱柱和流动相体系及洗脱程序进行了详细的考察。分别考察了色谱柱Zorbax-RRHD-C18(100 mm×3.0 mm, 5 μm)、Zorbax-SB-C18(150 mm×4.6 mm, 5 μm)、Zorbax-SB-C18(100 mm×2.1 mm, 3.5 μm)、Extend-C18(250 mm×4.6 mm, 5 μm)、Zorbax Eclipse Plus-C18(100 mm×2.1 mm, 1.8 μm)(美国Agilent公司)和Spursil-C18(150 mm×2.1 mm, 2.1 μm,迪马科技有限公司)。结果表明色谱柱Zorbax Eclipse Plus-C18(100 mm×2.1 mm, 1.8 μm)的分离效果最佳,能较全面地反映茶叶籽提取物的化学成分,因此采用此色谱柱进行之后的分析。
流动相体系的选择直接影响各组分分离效果。首先考察了甲醇-水和乙腈-水流动相体系,结果表明采用乙腈-水体系为流动相时峰形更佳,响应值更高。同时考察了流动相中添加剂组成的影响,包括不使用添加剂、加入5 mmol/L醋酸铵和0.1%(v/v)甲酸。结果显示流动相中加入醋酸铵和不使用添加剂时,峰形易产生拖尾现象,物质间分离度较低;而流动相中加入0.1%(v/v)甲酸时,能有效抑制拖尾,改善峰形,和文献[16]中使用酸性流动相时一致。因此,最终选择乙腈-0.1%(v/v)甲酸水溶液作为流动相。此外,分别考察了柱温、流速和梯度洗脱程序对组分分离的影响。最终,在1.3.1节所述条件下,所有组分得到较好的分离,总离子流图见图1。
2.1.2 质谱条件的优化
分别考察了正、负离子模式下的质谱全扫描检测,结果显示大多酚类化合物在负离子模式下响应较好,峰容量更大,而在正离子模式下响应较弱。因此本实验最终采用负离子模式进行检测。此外,对质谱参数中的毛细管电压、干燥气温度和流速、雾化气压力、鞘气温度和流速、碎裂电压等进行优化,最终确定1.3.2节的检测条件。
2.2 茶叶籽提取物化学成分的鉴别分析
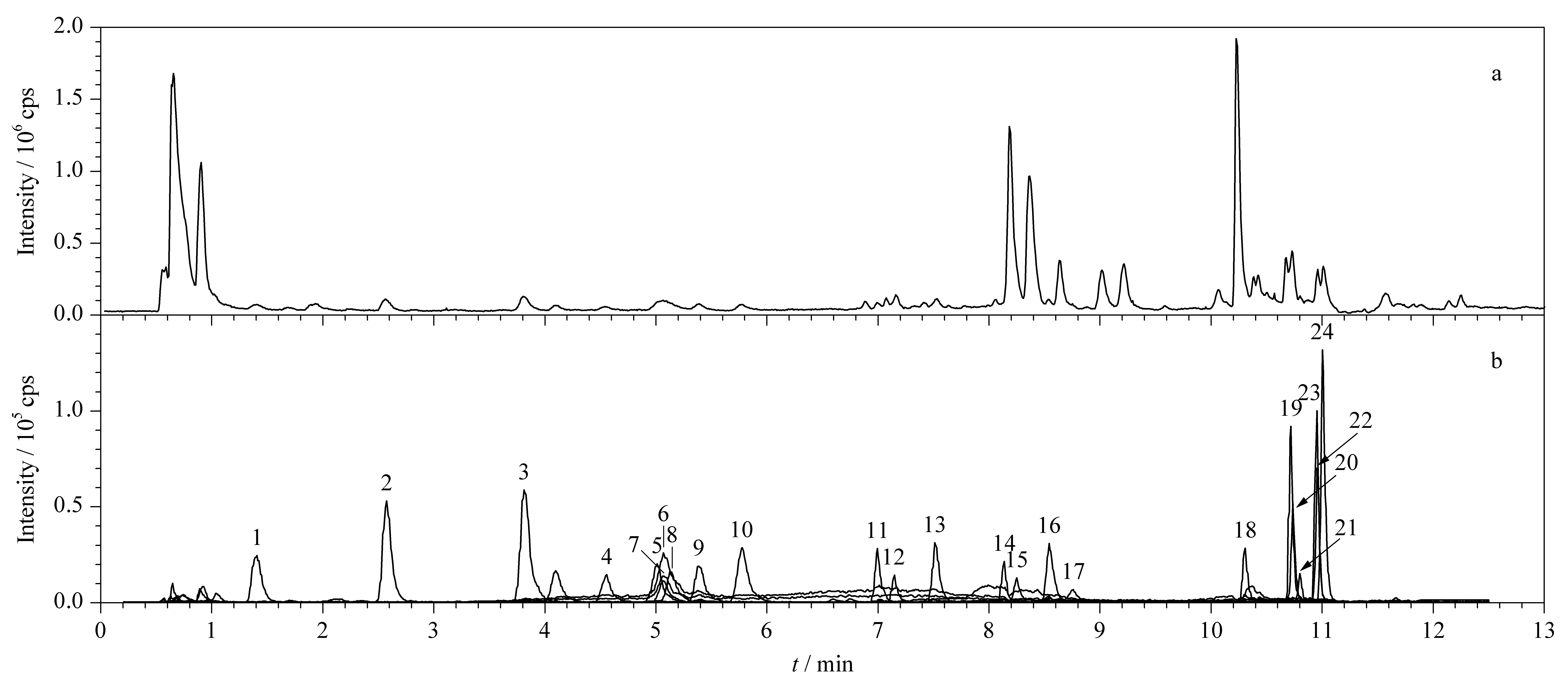
图 1 通过UHPLC-Q-TOF/MS得到的茶叶籽提取液的(a)总离子流色谱图及(b)可能的酚类化合物的重叠提取离子色谱图Fig. 1 (a) Total ion chromatogram (TIC) and (b) overlaid extracted ion chromatograms (EIC) of the tentatively identified phenolic compounds from the tea seed extract using ultra-high performance liquid chromatography combined with quadrupole time-of-flight mass spectrometry (UHPLC-Q-TOF/MS) Peak Nos. see Table 1.
应用UHPLC-Q-TOF/MS在上述优化的色谱和质谱条件下对茶叶籽提取物进行分析,得到负离子模式下测定该提取物的总离子流色谱图(见图1a)。为了从中提取有效的、与酚类相关的化合物信息,首先通过查阅专业数据库(ChemSpider、Pubmed、Scifinder、中科院化学专业数据库)和参考文献[18-28]收集了106种山茶属及相关植物中酚类化合物的名称及分子式,并计算其精确相对分子质量,利用MassHunter PCDL (Personal Compound Database and Library) Manager软件建立含有这些酚类化合物的数据库。通过MassHunter定性软件结合自建的酚类化合物数据库检索UHPLC-Q-TOF/MS采集到的原始数据,得到提取液中含有的与酚类化合物库中精确相对分子质量一致的色谱峰。这些色谱峰的提取离子色谱图如图1b所示。然后,利用Q-TOF/MS质谱分析器的四极杆选择这些色谱峰对应的分子离子,在碰撞池中对其进行碰撞诱导解离,裂解所得的碎片离子通过TOF扫描得到二级质谱图。然后根据离子的裂解情况并结合文献进一步比对,初步推断出茶叶籽乙醇提取物中的24种酚类化合物,其中包括13种酚酸化合物、4种儿茶素类化合物和7种黄酮类化合物(见表1),其结构式见图2。

表 1 茶叶籽酚类化合物的UHPLC-Q-TOF/MS鉴定结果
2.2.1 酚酸类化合物
酚酸类化合物极性强,保留时间较短。结合文献[19]及专业数据库,在茶叶籽乙醇提取物中共鉴定出13种酚酸类物质。以化合物2为例,其精确质量提取离子色谱图见图3a,对应的二级质谱图见图3b。母离子[M-H]-的m/z为153.019 7,对应的最佳分子式为C7H6O4,经参考文献[19]及数据库比对,发现其与原儿茶酸分子离子峰一致,故初步推测其为原儿茶酸。可能的裂解方式如图3c所示,母离子[M-H]-丢失羧基上的一个-CO2基团,产生m/z109.029 5的碎片离子,进一步脱水得到m/z91.018 9的碎片离子。该特征离子与实际采集到的二级碎片离子图一致,结合文献[19]报道,推断该化合物为原儿茶酸。
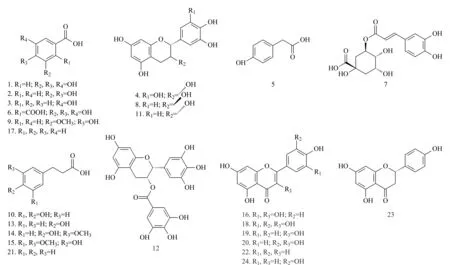
图 2 UHPLC-Q-TOF/MS鉴定到茶叶籽乙醇提取物中的24种化合物的结构Fig. 2 Structures of the 24 compounds in tea seed extract identified by UHPLC-Q-TOF/MS Compound Nos. see Table 1.

图 3 化合物2的(a)提取离子色谱图、(b)二级质谱图及(c)推断的裂解方式Fig. 3 (a) EIC, (b) MS/MS spectrum and (c) the deducted fragmentation pathways of compound 2
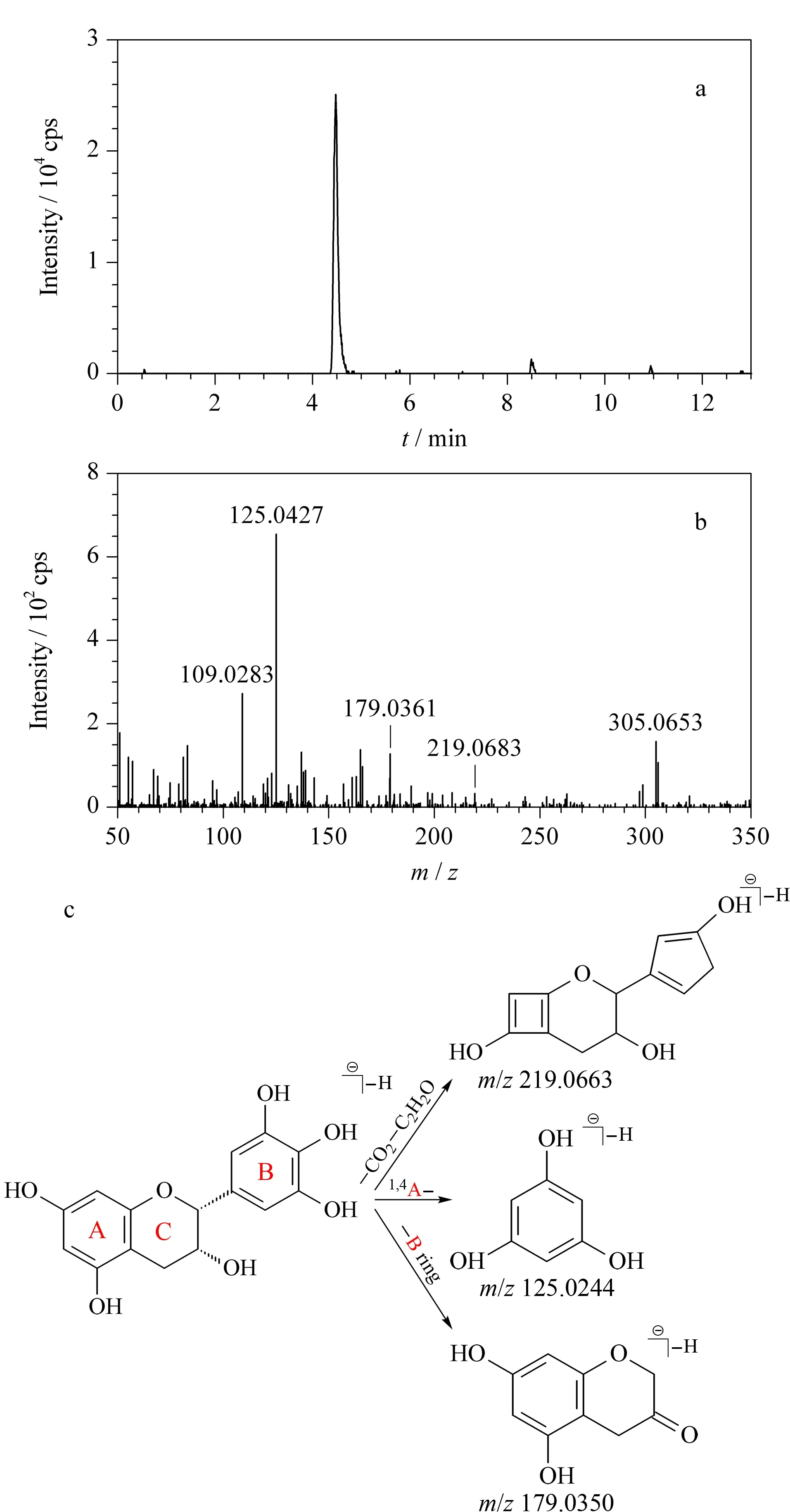
图 4 化合物4的(a)提取离子色谱图、(b)二级质谱图及(c)推断的裂解方式Fig. 4 (a) EIC, (b) MS/MS spectrum and (c) the deducted fragmentation pathways of compound 4
2.2.2 儿茶素类化合物
儿茶素类化合物容易发生丢失C2H2O碎片、C环的1,4键断裂和丢失B环的裂解方式[20,29,30]。化合物4的精确相对分子质量提取离子色谱图及二级质谱图如图4所示,其[M-H]-离子峰m/z为305.065 3,对应的最佳分子式为C15H14O7。经与参考文献[20]比对,发现其与表没食子儿茶素一致,故初步推测其为表没食子儿茶素。C环的1,4键断裂,可产生m/z125.024 4的碎片离子;而丢掉B环和部分A环,可分别生成m/z为179.035 0和219.066 3的碎片离子;可能的碎裂方式如图4c所示。除了碎片离子m/z219.066 3由于丰度偏低而实测值偏大,相对偏差为9.13×10-6(9.13 ppm)之外,母离子和其他两个主要碎片离子的实测m/z值与理论值的相对偏差均在3 ppm以内,而且子离子碎片信息与文献[20]报道一致。据此推断,该化合物应该为表没食子儿茶素。
2.2.3 黄酮类化合物
黄酮类化合物的母体骨架特殊;在负离子模式下,不同的黄酮类化合物均有典型的裂解规律[26,31],如C环易发生逆Diels-Alder (RDA)裂解。依据其典型裂解方式,共初步鉴定出7种黄酮类成分:柚皮素、杨梅素、槲皮素、山柰酚、木犀草素、二氢槲皮素、芹菜素。如化合物18碎片离子峰的m/z为317.029 9,经与参考文献[21]及数据库比对发现与杨梅素分子离子峰一致,初步推测其为杨梅素。杨梅素C环RDA裂解产生m/z151.003 7的碎片离子,丢失B环产生m/z178.999 1的碎片离子。在化合物18的碎片离子中发现m/z151.003 0和178.997 8的碎片离子,因此鉴定该化合物为杨梅素。
2.3 标准品确证
为进一步确证,将已初步鉴定出的化合物与标准品进行保留时间和二级质谱图比对。在相同的色谱、质谱条件下,得到混合标准品的总离子流色谱图,经精确质量数提取,得到各标准化合物的保留时间和精确质量,并采集各标准化合物的二级质谱图。将初步鉴定的茶叶籽酚类化合物与标准品的保留时间进行比较(见表1),所有24个化合物与对应标准品的保留时间差异均在±0.1 min以内。同时,样品中实际采集到的主要二级碎片离子与标准品中分子离子峰裂解的碎片离子偏差均在5 ppm以下。以原儿茶素(见图5a)和表没食子儿茶素(见图5b)为例,茶叶籽实际样品二级质谱图中主要特征离子的m/z与标准品的主要特征离子吻合得很好。
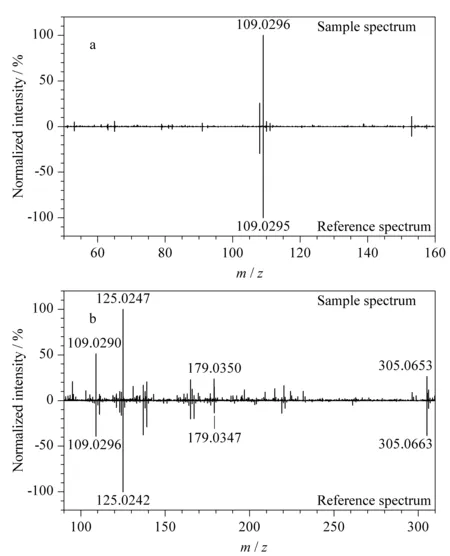
图 5 (a)表没食子儿茶素和(b)原儿茶酸在茶叶籽提取物及标准品中的质谱图比对Fig. 5 Comparison of the MS/MS spectra between the tea seed extract and the standard compounds for (a) (-)-epigallocatechin and (b) protocatechuate
3 结论
采用超高效液相色谱-四极杆-飞行时间质谱技术在负离子模式下对茶叶籽中的酚类化合物进行分析,根据各个色谱峰的精确相对分子质量、二级碎片离子信息,同时参考相关文献并结合自建的酚类化合物数据库,共初步鉴定出24种主要酚类化合物,其中包括13种酚酸类、4种儿茶素类和7种黄酮类化合物。经确证,这些化合物与相应标准品的保留时间及二级质谱信息匹配良好。该方法快速、准确,是一种相对较好的定性测定方法,可作为茶叶籽中酚类化合物的分析方法,为茶叶籽的进一步深入分析和开发提供了参考。
[1] Cao G F, Wu B, Zhong S X. Chinese Oils and Fats, 2008, 33(8): 17
曹国锋, 邬冰, 钟守贤. 中国油脂, 2008, 33(8): 17
[2] Wang X Q, Liang X Q, Zhao J, et al. J Am Oil Chem Soc, 2014, 91: 629
[3] Song L J, Di Y. Progress in Chemistry, 2000, 12(2): 161
宋立江, 狄莹. 化学进展, 2000, 12(2): 161
[4] Kang H N, Chen B, Han C, et al. Journal of Instrumental Analysis, 2007, 26(2): 211
康海宁, 陈波, 韩超, 等. 分析测试学报, 2007, 26(2): 211
[5] Wei K, Wang L Y, Zhou J, et al. Food Chem, 2012, 130(3): 720
[6] Guo S, Bezard E, Zhao B. Free Radic Biol Med, 2006, 39(10): 24
[7] Wang J Z, Wang G, Xu G F, et al. Food and Drug, 2006, 8(3A): 23
王景梓, 王岗, 徐贵发, 等. 食品与药品, 2006, 8(3A): 23
[8] Tapiero H, Tew K D, Ba G N, et al. Biomed Pharmacother, 2002, 56(4): 200
[9] Tang Y F, Zhang M L, Feng B, et al. Journal of Zhejiang A & F University, 2005, 22(5): 553
唐裕芳, 张妙玲, 冯波, 等. 浙江农林大学学报, 2005, 22(5): 553
[10] Jacob J K, Hakimuddin F, Paliyath G, et al. Food Res Int, 2008, 41(4): 419
[11] Wang X Q, Shen J F, Wang M, et al. Food Science and Technology, 2007, 32(9): 238
王徐卿, 沈建福, 王敏, 等. 食品科技, 2007, 32(9): 238
[12] Zhu X Y, Zhong H Y, Zhou B, et al. Food and Machinery, 2012, 28(1): 166
朱晓阳, 钟海雁, 周波, 等. 食品与机械, 2012, 28(1): 166
[13] Zhu J X, Zhu Y J, Zhang S K, et al. China Tea Processing, 2011(4): 47
朱晋萱, 朱跃进, 张士康, 等. 中国茶叶加工, 2011(4): 47
[14] Fazel M, Sahari M, Barzegar M. Int Food Res J, 2008, 15(1): 209
[15] Ouni Y, Taamalli A, Gómez-Caravaca A M, et al. Food Chem, 2011, 127: 1263
[16] Bajoub A, Hurtado-Fernández E, Ajal E A, et al. J Agric Food Chem, 2015, 63(17): 4376
[17] Bajoub A, Carrasco-Pancorbo A, Ajal E A, et al. Food Chem, 2015, 166: 292
[18] Niu Y, Wang S F. Chinese Traditional and Herbal Drugs, 2014, 45(8): 1056
牛研, 王书芳. 中草药, 2014, 45(8): 1056
[19] Vallverdú-Queralt A, Estruch R, Lamuela-Raventos R M. Food Chem, 2013, 141(4): 3365
[20] Liu G Q, Dong J, Wang H, et al. Journal of Chinese Mass Spectrometry Society, 2009, 30(5): 287
刘国强, 董静, 王弘, 等. 质谱学报, 2009, 30(5): 287
[21] Gómez-Romero M, Zurek G, Schneider B, et al. Food Chem, 2011, 124: 379
[22] Zou L L, Li X X, Shi Q S, et al. Anal Methods, 2014, 6(12): 4312
[23] Xu W, Fu Z Q, Lin J, et al. China Journal of Chinese Materia Medica, 2014, 39(22): 4365
许文, 傅志勤, 林婧, 等. 中国中药杂志, 2014, 39(22): 4365
[24] Zhang X P, Jiang K Z, Lv H Q, et al. Journal of Chinese Mass Spectrometry Society, 2015, 36(4): 310
张小平, 蒋可志, 吕惠卿, 等. 质谱学报, 2015, 36(4): 310
[25] Shen D H, Lu X, Chang Y W, et al. Chinese Journal of Chromatography, 2014, 32(1): 40
沈丹红, 路鑫, 常玉玮, 等. 色谱, 2014, 32(1): 40
[26] Jiang Y L, Huang F, Wu F H, et al. Chinese Journal of Chromatography, 2015, 33(10): 1032
蒋娅兰, 黄芳, 毋福海, 等. 色谱, 2015, 33(10): 1032
[27] Zhang X G, Zheng Y J, Zeng Y T, et al. Chinese Journal of Chromatography, 2015, 33(6): 583
张协光, 郑彦婕, 曾泳艇, 等. 色谱, 2015, 33(6): 583
[28] Zhang M Y, Xu Y, Song G S, et al. Chinese Journal of Chromatography, 2015, 33(8): 773
张梦雨, 徐洋, 宋冠杉, 等. 色谱, 2015, 33(8): 773
[29] Wang X Q, Yu H J, Zhao Y Q. Chinese Traditional and Herbal Drugs, 2009, 40(5): 745
王夏青, 於洪建, 赵余庆. 中草药, 2009, 40(5): 745
[30] Guo L B, Li Y H, Zhou J, et al. Journal of Chinese Institute of Food Science and Technology, 2012, 12(8): 47
郭琳博, 李宇华, 周婧, 等. 中国食品学报, 2012, 12(8): 47
[31] Xu Y, Dong J, Wang H, et al. Chemical Journal of Chinese Universities, 2009, 30(1): 46
徐英, 董静, 王弘, 等. 高等学校化学学报, 2009, 30(1): 46
Qualitative analysis of phenolic compounds inCamelliaSinensisseeds by ultra-high performance liquid chromatography combined with quadrupole time-of-flight mass spectrometry
LAI Guoyin1, WANG Lijuan2, LU He2, ZENG Qiumei2, XU Dunming1*,WANG Xiaoqin2, LIN Liyi1, ZHANG Zhigang1, LÜ Meiling3
(1.XiamenEntry-ExitInspectionandQuarantineBureau,Xiamen361026,China; 2.CollegeofChemicalEngineering,InstituteofOilandNaturalProduct,HuaqiaoUniversity,Xiamen361021,China;3.AgilentTechnologies(China)Co.Ltd,Beijing100102,China)
Phenol compounds from some plants are considered as the natural anti-oxidants and have been demonstrated with the beneficial biological activities. In this work, the ultra-high performance liquid chromatography (UHPLC) combined with quadrupole time-of-flight mass spectrometry (Q-TOF/MS) was applied to qualitatively determine the phenolic compounds inCamelliaSinensisseeds. The seed sample was extracted using ethanol aqueous solution and further subjected to the UHPLC separation with the reversed phase C18 column as the stationary phase and the acidified acetonitrile/water as the binary mobile phases. The eluent from the column was directed to Q-TOF/MS for compound identification. Based on a number of reports on the chemical components inCamelliaSinensisand the related plants, a customized compound database was initially created including the name and formula of the previously reported 106 phenol compounds. The acquired MS scan data were searched against the customized phenol compound database. The retrieved compounds were then subjected to MS/MS scan, and the obtained fragment ions were applied to further determine the possible structures. A total of 24 phenolic compounds were tentatively identified, including 13 phenolic acids, 4 catechins, and 7 flavonoids, which were characteristic in the ethanol extract according to the available references and the relevant structural information of the molecular and fragment ions. These compounds were further confirmed by matching against the standard compounds in retention times and fragment ions. The results demonstrated that the UHPLC-Q-TOF/MS with the high mass accuracy and the high resolution is a reliable technology for rapid qualitative identification of the phenolic compounds inCamelliaSinensisseeds, promoting the discovery and identification of the new compounds.
ultra-high performance liquid chromatography (UHPLC); quadrupole time-of-flight mass spectrometry (Q-TOF-MS); phenolic compounds;CamelliaSinensisseed
10.3724/SP.J.1123.2016.11010
2016-11-12
福建省自然科学基金项目(2016J05045);国家质检总局科技计划项目(2016IK186).
Foundation item: Natural Science Foundation of Fujian Province (No. 2016J05045); Administration of Quality Supervision, Inspection and Quarantine (AQSIQ) Project (No. 2016IK186).
O658
A
1000-8713(2017)05-0502-07
* 通讯联系人.Tel:(0592)3269937,E-mail:xudm@xmciq.gov.cn.
