大脑皮层及皮层下胶质母细胞瘤MRI分析
2017-05-11王朝晖韩雪高培毅
王朝晖, 韩雪, 高培毅
·中枢神经影像学·
大脑皮层及皮层下胶质母细胞瘤MRI分析
王朝晖, 韩雪, 高培毅
目的:分析大脑皮层及皮层下NOS型胶质母细胞瘤的MRI表现及其临床意义。方法:搜集15例主体位于大脑皮层并经手术病理证实的NOS型胶质母细胞瘤患者的术前常规MR图像,结合文献进行回顾性分析。结果:15例均表现为团块样病灶,位于额叶最多见,瘤体主要呈长T1、长T2信号,信号不均匀,8例在平扫T1WI上病灶内可见高信号区。增强后13例表现为显著不均匀环形或蜂房样强化,其中6例可见脑膜受侵、强化,瘤体内轻度坏死4例(27%),轻度瘤周水肿7例(47%);轻度强化2 例(13%)。结论:大脑皮层及皮层下NOS型胶质母细胞瘤具有一些较典型的MRI特征。
胶质母细胞瘤; 脑肿瘤; 磁共振成像; 坏死; 脑水肿
胶质母细胞瘤(glioblastoma,GB)常位于大脑深部白质[1],可累及大脑皮层。关于GB的MRI表现,国内外已经有大量文献报道[2]。但主体位于皮层的GB相对少见,与其相关的影像学研究较少。对GB预后相关因素的研究近年来有了显著的进展,已知除分子特征外,大脑GB的多项MRI特征与预后相关。有文献报道[3],长生存期胶质母细胞瘤患者的瘤体均位于大脑皮层及皮层下,故大脑皮层及皮层下GB可能具有较多的提示预后较好的MRI特征。本研究将按照2016年WHO中枢神经系统肿瘤分类法[4],回顾性分析15例主体位于大脑皮层的NOS型胶质母细胞瘤患者的术前常规MRI表现,并结合文献探讨GB的MRI征象与其分子特征及预后的相关性。
材料与方法
1.一般资料
搜集2014年1月-2015年6月本院经手术病理证实为脑内胶质母细胞瘤的15例患者的术前MR图像。其中男8例,女7例,年龄37~71岁,平均55岁。主要症状为神经功能障碍、头痛和头晕。所有患者行常规MRI平扫和增强检查。观察每例患者的冠状面、矢状面和横轴面图像,对肿瘤进行精准定位,确定本研究中脑肿瘤主体位于大脑皮层。
2.检查方法
使用GE Signa 1.5T和Siemens Trio 3.0T MR扫描仪和8通道头线圈,常规行T1WI和T2WI横轴面平扫及横轴面、矢状面和冠状面T1WI增强扫描。扫描序列及参数:T1WI(TR 450 ms、TE 16 ms)和T2WI(TR 4000 ms、TE 120 ms),层厚5 mm,矩阵256×256。对比剂使用钆喷酸葡胺注射液,剂量0.1 mmol/kg,注射流率2.0 mL/s。
3.图像分析
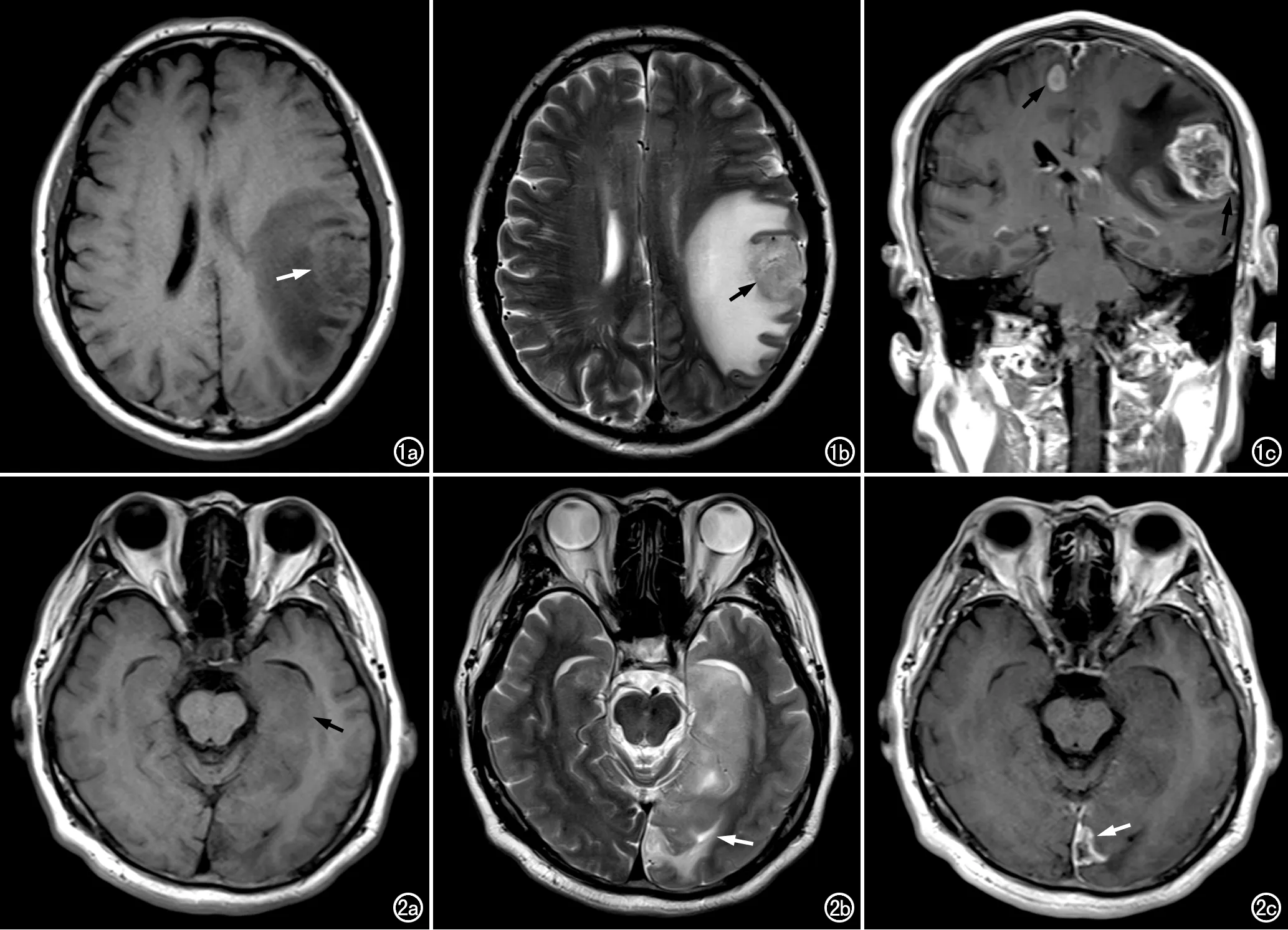
图1 左颞顶叶GB(NOS型)。a) T1WI示肿瘤呈类圆形稍低信号灶(箭); b) T2WI示肿瘤呈稍高信号(箭),重度瘤周水肿; c) 冠状面T1WI增强扫描,示瘤体显著强化,瘤内坏死的范围较大,邻近脑膜受侵犯、有轻度强化(长箭),另见右额叶皮层下有一小圆形病灶(短箭)。 图2 左颞枕叶GB。a) T1WI示肿瘤呈不规则形稍低信号灶(箭); b) T2WI示肿瘤呈稍高信号,瘤周水肿轻(箭); c) T1WI增强扫描示肿瘤无明显强化,邻近脑膜受侵强化(箭)。
观察肿瘤内不强化区的情况、坏死范围、瘤周水肿程度及其它MRI特征,包括肿瘤的脑叶分布、形状、边缘、信号强度及均匀度、扩散方式、出血、囊变、强化形态及程度。肿瘤内是否存在不强化区、卫星灶、多发灶情况及瘤周水肿分级等按Carrillo等[5]提出的方法进行。增强后若瘤体实性区内可见部分或全部区域不强化,则定义为肿瘤不强化区阳性。在平扫T2WI上,若小瘤灶与肿瘤主体间有异常信号相连,则将此小瘤灶定义为卫星灶;若瘤灶与肿瘤主体间有正常脑组织,则定义该瘤灶为多发灶。将瘤周水肿程度分为3 级:在T2WI上,0级为没有瘤周水肿,瘤周水肿外缘距肿瘤边缘小于1 cm为1级水肿(轻度),超过1 cm为2级水肿(重度)。将病灶内坏死范围分为4级[6]:瘤体内若没有坏死则为0级,在横轴面增强图像上测量坏死灶面积和瘤体面积,计算两者的比值,比值<0.25为1级坏死(坏死范围小),比值在0.25和0.50之间为2级坏死,比值>0.5为3级坏死。将病灶的强化程度分为3级[7]:0级(无强化)、1级(轻度强化,明显低于脂肪信号)和2级(显著强化,近似脂肪信号)。
结 果
15例中病灶位于额叶最多见(7例),其次为颞叶(6例);呈类圆形(13例)或不规则形(2例)实性肿块(图1~3),长径约3~8 cm,边界清楚(11例)或不清楚(5例)。病灶主体在T1WI上呈低信号,T2WI上呈高信号,信号不均匀,T1WI上病灶内可见不同程度高信号8例。强化形态:呈不均匀环形强化8例,蜂房样强化5例,环形强化和条片状强化各1例;强化程度:轻度强化2例,重度强化13例。可见脑回肿胀6例。所有瘤体内均可见坏死区,1级坏死(坏死范围小)4例(27%),2级和3级坏死分别为6例和5例。有轻度瘤周水肿者7例(47%),重度瘤周水肿者8例。其它征象:侵及局部脑膜6例,可见卫星灶1例,浸润大脑镰并跨跃中线1例,1例GB为双侧半球各一个病灶。
讨 论
胶质母细胞瘤(WHO Ⅳ级)是恶性程度最高的一类星形细胞瘤,根据发病情况可分为原发GB和继发GB,前者指在发生时即为GB,后者由低级别星形细胞瘤、少突胶质细胞瘤和室管膜瘤转变而来。原发GB较为常见,多发生于老年人,平均年龄55岁,临床病史短,常少于3个月;继发性GB常发生于小于45岁的年轻人,病史较长,平均4~5年,且发病年龄有滞后的趋势。本研究中14例原发GB患者的病史均少于4个月;仅1例继发性GB,临床病史近1年,临床表现符合相关文献报道[8]。巨细胞胶质母细胞瘤和胶质肉瘤是胶质母细胞瘤的亚型,2016年WHO中枢神经神经系统肿瘤分类中引入了分子特征,将肿瘤组织学表型和基因特征进行整合,使诊断的客观性得到提高。新的分类方法中胶质母细胞瘤主要分成3大类[4]:①IDH 野生型,基本相当于临床原发GB,约90%的患者属于此型;②异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变型,基本相当于临床继发GB,约占10%;③IDH基因未定型(not otherwise specified,NOS),未进行全面IDH评估时用此诊断。根据新的分类方法,本组病例属于NOS型胶质母细胞瘤。
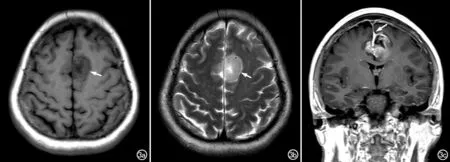
图3 双侧额叶镰旁GB。a) T1WI示额叶镰旁有一类圆形低信号肿块,其内可见点片状高信号区(箭); b) T2WI示肿瘤呈稍高信号(箭),瘤周水肿轻; c) 冠状面T1WI增强扫描,示病灶有显著强化,瘤内有中度坏死,大脑镰受侵增厚、强化(箭)。
GB好发于幕上大脑半球,常位于深部脑白质,额叶为最常见的部位,其次是颞叶;由于病理上GB常伴有坏死,因此在T1WI上通常呈不均匀低信号,T2WI上呈不均匀高信号,并且由于肿瘤血管生成和血脑屏障破坏,增强扫描可见GB常呈显著不规则厚壁花环样强化或蜂房样强化[8]。GB合并有出血时,T1WI上可见肿瘤内有高信号区。由于肿瘤常呈浸润性生长,破坏血脑屏障,瘤周水肿常较明显。但由于血供丰富、生长较快,通常表现为膨胀性生长,呈团块样改变[9]。本组大部分大脑皮层及皮层下GB表现出典型的恶性脑肿瘤的特征:瘤体信号不均,平扫T1WI上病灶内可见高信号出血灶(66%);瘤周水肿明显(8例),增强后呈明显不均匀环形或蜂房样强化(13例);可侵及邻近脑膜(6例),表现为脑膜增厚,呈明显条形强化;可见卫星灶(1例),可浸润大脑镰并跨跃中线生长(1例),可见大脑镰增厚并条形强化;1例GB为双侧半球多发病灶,对侧子灶表现为小环形强化。但也有少部分GB的表现不典型,与低级别胶质瘤的特征相似:4例(26%)增强后病灶无明显强化,2例呈轻度强化,7例(47%)瘤周水肿程度轻,4例(26%)坏死范围小。
GB的常规MRI特征与患者的生存期具有一定相关性。已经有多项研究表明,瘤周水肿程度轻、坏死范围小的GB患者预后相对良好[10-11]。本组大脑皮层及皮层下GB患者中轻度瘤周水肿出现率较高(47%),与文献报道一致[6],可能与GB的生物学行为及发病部位有关;已知IDH突变型胶质母细胞瘤和伴有MGMT启动子甲基化的胶质母细胞瘤预后相对良好。研究表明IDH突变型胶质母细胞瘤的瘤体多可见不强化区[4],大部分位于额叶。本组中4例患者表现为增强后无明显强化,其中2例位于额叶,具有IDH突变型GB的MRI表现。通过常规MRI表现评估GB患者的预后,可指导临床制订治疗方案。如可根据其MRI表现,对预后不良的患者进行更积极的、试验性治疗[12]。
大脑皮层GB通常需要与以下疾病鉴别。①脑膜瘤:典型脑膜瘤具有脑外定位征(宽基底位于硬膜,内缘光滑,局部珠网膜下腔增宽,脑回受压移位),MRI平扫表现为稍长T1稍长T2信号,增强扫描瘤体通常呈明显均匀强化,可见脑膜尾征。间变及非典型脑膜瘤的MRI平扫信号不均,边缘欠光滑,与脑实质界限不清,增强后多呈不均匀强化;此时MRS可提供帮助,无NAA峰可作为脑外肿瘤的依据,Ala峰为脑膜瘤的典型特征。②低级别胶质瘤:增强后瘤体内通常无明显坏死,瘤周水肿轻微或无,瘤体实性部分信号较均匀,出血少见;增强后弥漫性星形细胞瘤和少突胶质细胞瘤一般无明显强化,少数有轻度强化,而多形性黄色星形细胞瘤和室管膜瘤常表现为结节样均匀强化。鉴别困难时可应用MRI新技术:磁敏感加权成像(SWI)上少数间变型星形细胞瘤及所有胶质母细胞瘤内可见瘤内磁敏感信号(intratumoral susceptibility signals,ITSS)存在,而低级别星形细胞瘤中一般无此表现。MR灌注加权成像(PWI)有助于胶质瘤的分级。高级别胶质瘤的瘤体部分的相对CBV明显高于低级别胶质瘤[13]。③单发脑转移瘤:瘤周水肿多较重,瘤内囊变、坏死范围小。FLAIR图像上如果发现病灶邻近皮层呈异常稍高信号改变,多考虑胶质母细胞瘤浸润所致;反之,则考虑转移瘤。④恶性淋巴瘤:可表现为靠近脑表面或靠近中线的实性肿块,免疫功能正常患者的淋巴瘤多均匀强化,可见缺口征;偶见肿块内囊变坏死改变,与胶质母细胞瘤的表现相似,若MRS表现为明显的Lip峰,则考虑淋巴瘤[14]。
总之,大脑皮层及皮层下NOS型胶质母细胞瘤具有多项典型的MRI特征,但也可见无明显强化、瘤周水肿轻、坏死程度轻等不典型特征,认识这些特征不仅有助于本病的诊断和鉴别诊断,而且有助于预后的判断和治疗方案的选择。
[1] 鱼博浪.中枢神经系统CT和MR鉴别诊断(第3版)[M].西安:陕西科学技术出版社,2014:139.
[2] 孙梦恬,程敬亮,张勇,等.胶质母细胞瘤的磁共振动态增强诊断[J].放射学实践,2011,(9):949-952.
[3] 王翔,刘艳辉,谢飞,等.长生存期胶质母细胞瘤患者的临床特点及分子表达分析[J].中华外科杂志,2013,51(2):166-170.
[4] 苏昌亮,李丽,陈小伟,等.2016年WHO中枢神经系统肿瘤分类总结[J].放射学实践,2016,31(7):570-579.
[5] Carrillo JA,Lai A,Nghiemphu PL,et al.Relationship between tumor enhancement,edema,IDH1 mutational status,MGMT promoter methylation,and survival in glioblastoma[J].AJNR,2012,33(7):1349-1355.
[6] Seidel C,Dorner N,Osswald M,et al.Does age matter A MRI study on peritumoral edema in newly diagnosed primary glioblastoma[J/OL].BMC Cancer,2011,11(1):127.
[7] Hammoud MA,Sawaya R,Shi W,et al.Prognostic significance of preoperative MRI scans in glioblastoma multiforme[J].J Neurooncol,1996,27(1):65-73.
[8] 高培毅.脑肿瘤MRI诊断进阶[M].北京:人民军医出版社,2014:20-21.
[9] 任建政,陈毓秀,徐杰,等.脑胶质母细胞瘤的MRI表现[J].实用放射学杂志,2012,28(6):843-845.
[10] 刘水源,郑宗清,林志雄,等.大脑半球高级别胶质瘤全切术后无进展生存期的相关因素分析[J].中国神经精神疾病杂志,2014,(6):325-330.
[11] Wu C,Lin G,Lin Z,et al.Peritumoral edema shown by MRI predicts poor clinical outcome in glioblastoma[J/OL].World J Surg Oncol,2015,13(1):97.
[12] Pope WB,Sayre J,Perlina A,et al.MR imaging correlates of survival in patients with high-grade gliomas[J].AJNR,2005,26(10):2466-2474.
[13] 余日胜,陈璐.脑肿瘤影像诊断技术新进展[J].现代实用医学,2015,27(5):557-559.
[14] 路莉,荣玉涛,徐凯.原发性中枢神经系统淋巴瘤的影像诊断方法[J].放射学实践,2015,30(6):691-693.
MRI analysis of cerebral cortical and subcortical glioblastoma
WANG Zhao-hui,HAN Xue,GAO Pei-yi.
Department of Neuroimaging,Beijing Tiantan Hospital,Capital Medical University,Beijing 100050,China
Objective:To study the MRI features of cerebral cortical and subcortical glioblastoma (GB) and theirs clinical significance.Methods:The preoperative routine MR images of 15 patients with pathologically confirmed not-otherwise-specified (NOS) type glioblastoma with the main body located at cerebral cortex were analyzed retrospectively,and literatures review was performed.Results:Mass-like lesions were showed in all patients,the most commonly found location was in the frontal lobe.Most of the tumors presented as heterogeneous hypointensity on T1WI and hyperintensity on T2WI,high signal intensity in the tumors on T1WI was showed in 8 cases.After contrast administration,13 cases showed markedly rosette-like or honey comb-like enhancement,of which,meningeal involvement and enhancement were showed in 6 cases,mild intra-tumoral necrosis was showed in 4 cases (27%),mild peri-tumoral edema in 7 cases (47%);and 2 cases (13%) showed mild enhancement.Conclusion:Certain characteristic MRI features could be revealed in cerebral cortical and subcortical glioblastoma.
Glioblastoma; Brain neoplasm; Magnetic resonance imaging; Necrosis; Brain edema
100050 北京,首都医科大学附属北京天坛医院神经影像中心(王朝晖); 100010 北京 首都医科大学附属北京中医医院放射科(王朝晖、韩雪);100050 北京,北京市神经外科研究所(高培毅)
王朝晖(1967-),男,北京人,硕士,主治医师, 主要从事影像诊断工作。
高培毅,E-mail:cjr.gaopeiyi@vip.163.com
R739.41; R445.2
A
1000-0313(2017)04-0365-04
10.13609/j.cnki.1000-0313.2017.04.015
2016-09-01
2017-01-12)
