盐胁迫对海岛棉幼苗生长的影响
2017-05-11阿曼古丽买买提阿力王立红张巨松田立文
阿曼古丽·买买提阿力,王立红,郑 慧,张巨松,田立文
(1.新疆农业大学农学院/教育部棉花工程研究中心, 新疆 乌鲁木齐 830052; 2.新疆农业科学院经济作物研究所, 新疆 乌鲁木齐 830091)
盐胁迫对海岛棉幼苗生长的影响
阿曼古丽·买买提阿力1,王立红1,郑 慧1,张巨松1,田立文2
(1.新疆农业大学农学院/教育部棉花工程研究中心, 新疆 乌鲁木齐 830052; 2.新疆农业科学院经济作物研究所, 新疆 乌鲁木齐 830091)
采用盆栽试验方法,研究了新海16号、新海20号、新海24号、新海25号、新海28号、新海34号和新海35号等7个海岛棉品种在盐胁迫(0.6% NaCl)下幼苗生长情况、光合特性等,为海岛棉栽培管理及耐盐品种的选育提供一定的理论依据。结果表明,0.6%NaCl盐胁迫下,种子出苗率、株高、鲜重、干重、第一片真叶叶绿素含量(Chl)、净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)和蒸腾速率(Tr)均有所下降;而植株含水量、可溶性糖含量(SS)、可溶性蛋白质(SP)和丙二醛含量(MDA)均增加。同等盐胁迫条件下,新海24号、新海34号、28新海号、新海35号与其余3个品种相比,具有较低的植株含水量和丙二醛含量,均保持较高的可溶性糖含量和可溶性蛋白质含量,表现出较好的耐盐性。本研究发现,0.6%NaCl盐胁迫对海岛棉种子出苗影响较小,对幼苗株高、鲜重、干重和植株含水量影响较大。海岛棉幼苗叶片净光合速率降低可能是气孔限制因素所引起的。海岛棉品种在0.6%NaCl盐胁迫下基本上都表现出较好的耐盐性,但对新海20号的影响较大。
盐胁迫;海岛棉;幼苗生长;影响
现代农业发展面临的主要环境问题是土壤盐渍化。盐渍土是盐土、碱土和各种盐化、碱化土壤的总称[1]。根据资料统计,我国盐渍化土壤面积约为3.69×107hm2,占现有耕地的25%,主要分布于土壤蒸发量大,降水量稀少的干旱、半干旱地区和滨海地区[2],新疆地处亚欧大陆腹地,远离海洋,属于典型的干旱半干旱地区,年平均降水量约为150 mm左右,现有耕地中已有31.1%的面积受到盐渍危害[3]。棉花是(Gossypiumhisutum)世界和我国主要的经济作物,属于短热照双子叶植物,是盐碱地的主要作物。海岛棉(G.BarbadenseL.)又称长绒棉,虽产量比陆地棉较低,但棉纤维品质较好,是纺制高档和特种棉纺织品的主要原料。新疆是我国唯一的海岛棉种植区。新疆干热气候及土壤盐渍化等环境不利于农作物生长,因此,棉花(海岛棉)研究工作主要致力于提高品种的抗逆性尤其是耐旱耐盐性。研究盐胁迫下不同基因型海岛棉幼苗生长及生理响应,对于海岛棉抗盐、促进盐渍土地的有效利用,实现海岛棉高产稳产具有重要的理论意义和实践价值。棉花在不同生育阶段耐盐能力不同,对盐胁迫最敏感时期是萌发出苗期,也是进行耐盐性鉴定的最佳时期,随着生育期的延长,棉花耐盐性逐步提高[4]。有研究表明,不同基因型海岛棉品种在萌发期种子吸水量随盐浓度的增加明显降低,且发芽时间推迟,发芽率、发芽指数和活力指数等均降低;而适宜的盐浓度对海岛棉品种表现出增效效应[5]。无论盐浓度高低,都对棉花幼苗生长产生抑制作用,且胁迫浓度越高,时间越长,其影响越明显[6-8]。本研究选用有代表性的海岛棉品种进行盐胁迫处理,探讨盐胁迫下海岛棉品种幼苗生长发育特性、光合气体交换参数以及渗透调节物质的影响。研究盐胁迫对海岛棉幼苗生长的影响,探明海岛棉幼苗的耐盐机制,揭示幼苗生长发育、光合作用及相关生理指标与盐胁迫之间的关系,为耐盐品种的选育和盐碱地的有效开发利用提供理论依据。
1 材料与方法
1.1 试验材料
试验于2014年8—11月在新疆农业大学教育部棉花工程研究中心棉花生理实验室内进行。选取新疆代表性7个海岛棉品种新海16号(XH16)、新海20号(XH20)、新海24号(XH24)、新海25号(XH25)、新海28号(XH28)、新海34号(XH34)和新海35号(XH35)为试验材料,从播种期开始进行NaCl盐胁迫试验。供试用盐:分析纯NaCl。
1.2 试验设计
采用盆栽法培育海岛棉植株。种子经过0.1% HgCl2溶液消毒15 min后,置于25℃智能光照培养箱(GTOP-380B2,浙江托普)中催芽至露白。将1∶1(V/V)草炭、蛭石复合基质于120℃高温灭菌24 h。
土壤盐含量(%)设置2个水平:CK(0)和0.6%。将一定量的NaCl(分析纯)溶解后均匀灌入草炭、蛭石复合基质内,选择发芽整齐一致的种子播入塑料营养钵(12 cm×11 cm)中,每盆装土310 g,每盆播种6粒种子,保持每粒种子的播种深度2.3 cm,每品种每处理种植18盆。每天观察幼苗生长状况,并重量法控制补水量以确保土壤含水量一致。培养条件为30℃/22℃(昼/夜),相对湿度RH50%,光强400~600 μmol·m-2·s-1,光周期12 h/12 h(昼/夜)。棉花出苗后24 d,开始取样进行测定。
1.3 测定项目与方法
1.3.1 农艺性状的测定 播种后第10天,计数各品种各处理出苗数,计算其出苗率(ER)=出苗数/播种总数×100%。幼苗长至25 d,用直尺测定每株棉花幼苗子叶节到顶端的垂直高度(cm),重复10次。取5株进行生物量的测定,先测定鲜重,之后将鲜样在105℃的烘箱中杀青30 min,于80℃下烘干至恒重并称其干重(g),并计算植株含水量(PWC)=(鲜重-干重)/鲜重×100%。
1.3.2 生理特性 叶绿素含量:参照刘萍等的方法略有改进[9]。幼苗长至25 d,选取整齐一致植株的第一片真叶,去掉叶脉后剪碎混匀,称取0.1 g,用1∶1(V∶V)的乙醇、丙酮混合液10 ml,暗室浸泡至组织变白(48 h),(空白加1∶1(V∶V)的乙醇、丙酮混合液10 ml)橡皮塞封口防止提取液挥发,用UV-1800紫外/可见分光光度计测定OD663 nm、OD645 nm处的吸光度值。
播种后第25天,使用CARIS-2型便携式光合仪(英国PP Systems USA公司)测定植株第一片真叶净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)等指标,测定过程中光强设置400 μmol·m-2·s-1,周围环境温度(25±1)℃,大气CO2浓度(Ci)变化范围为(410±10) μmol·L-1(使用开放式气路,CO2浓度为385 μmol·mol-1左右)。选取长势均匀的植株,5次重复。可溶性糖(SS)含量测定:采用蒽酮乙酸乙酯法[10]。可溶性蛋白质(SP)含量的测定:采用考马斯亮蓝法[11]。丙二醛(MDA)含量测定:采用硫代巴比妥酸比色法测定[12]。
1.4 数据分析
采用SPSS 17.0、Excel 2010进行分析,方差分析均为0.05水平,采用LSD法。
2 结果与分析
2.1 盐胁迫对海岛棉种子出苗的影响
由图1可知,盐胁迫影响海岛棉种子出苗率,但不同基因型海岛棉种子出苗对盐胁迫的反应不同。所有种子出苗率均呈现降低趋势。0.6%NaCl盐胁迫没有显著降低XH24号的出苗率,其余品种种子出苗率降低幅度都与CK达到了显著水平;同等盐胁迫强度下,XH24号、XH34号、XH28号和XH35号出苗率比对照分别仅降低了1.39%、3.68%、4.98%和7.34%,而XH25号、XH16号和XH20号降低了7.80%、8.51%和9.19%。从各供试品种出苗率降低程度看,0.6%盐胁迫对海岛棉种子出苗没有太大的影响。
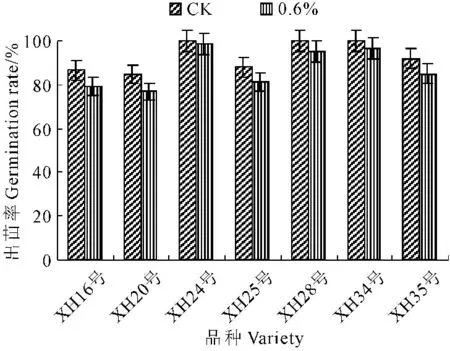
图1 盐胁迫对海岛棉种子出苗率的影响
Fig.1 Effect of salt stress on seed germination of island cotton
2.2 盐胁迫对海岛棉幼苗生长的影响
从表1可知,盐胁迫对7个海岛棉幼苗株高、鲜重、干重和植株含水量都有抑制作用。盐胁迫下,株高、鲜重和干重均表现降低趋势,而植株含水量呈现增加,各供试品种均表现相同趋势。在盐胁迫下,XH20号、XH16号、XH25号、XH35号、XH28号、XH34号和XH24号株高与对照相比分别下降了36.86%、31.52%、28.21%、25.79%、20.09%、17.44%和15.10%。方差分析表明,盐处理下各形态指标降低程度与对照相比达到了显著水平(P<0.05)。同等盐胁迫下,XH20号各形态指标降低幅度明显高于其它品种(见图2)。

图2 盐胁迫下海岛棉幼苗长势。
Fig.2 The growing situation of island cotton under salt stress
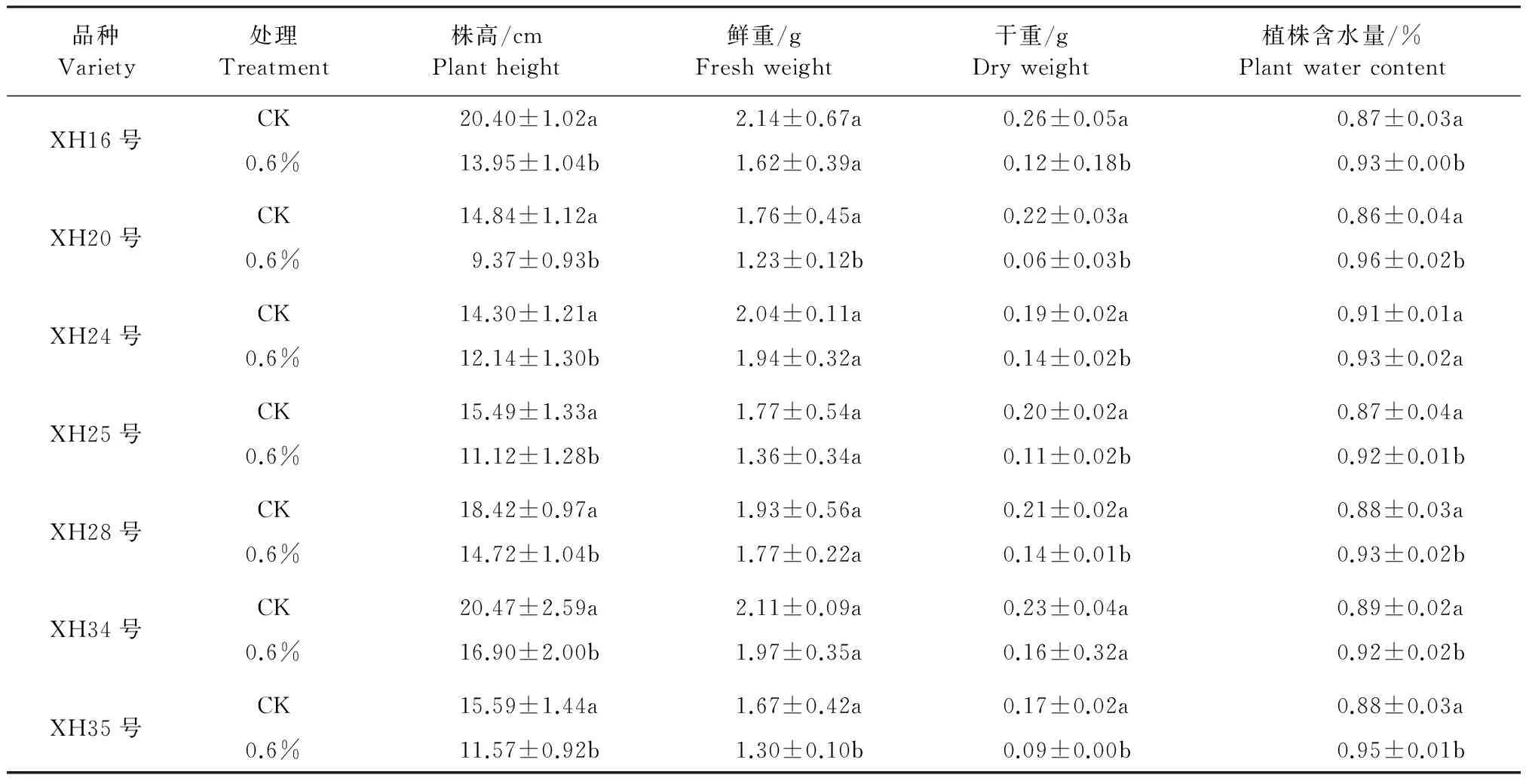
表1 盐胁迫对海岛棉幼苗生长的影响
注:同列不同小写字母a、b、c表示不同处理差异显著(P<0.05),下同。
Note: The different small letters indicate significance difference (P<0.05). The same below.
2.3 盐胁迫对海岛棉幼苗叶片叶绿素(Chl)含量的影响
叶绿素是与光合作用有关的重要色素,其光合作用吸收光能中起核心作用。
盐胁迫对不同海岛棉品种幼苗第一片真叶叶绿素含量影响见表2。从表2中可见,6个海岛棉品种对盐胁迫的反应基本上一致,经过0.6%盐胁迫后叶片中叶绿素a含量(Chla)、叶绿素b含量(Chlb)和总叶绿素含量Chl(a+b)均呈现降低趋势;而XH24号幼苗叶片Chla、Chlb和Chl(a+b)含量较CK有增加,与对照相比分别增加了4.55%、4.05%和4.41%,Chla增加幅度与CK相比没有达到显著水平(P>0.05)。同等盐胁迫下,XH34号、XH28号、XH35号幼苗叶片叶绿素含量较高,而XH20号叶绿素含量降低幅度较大。这表明盐胁迫条件下XH20号表现出较弱的叶绿素合成能力。
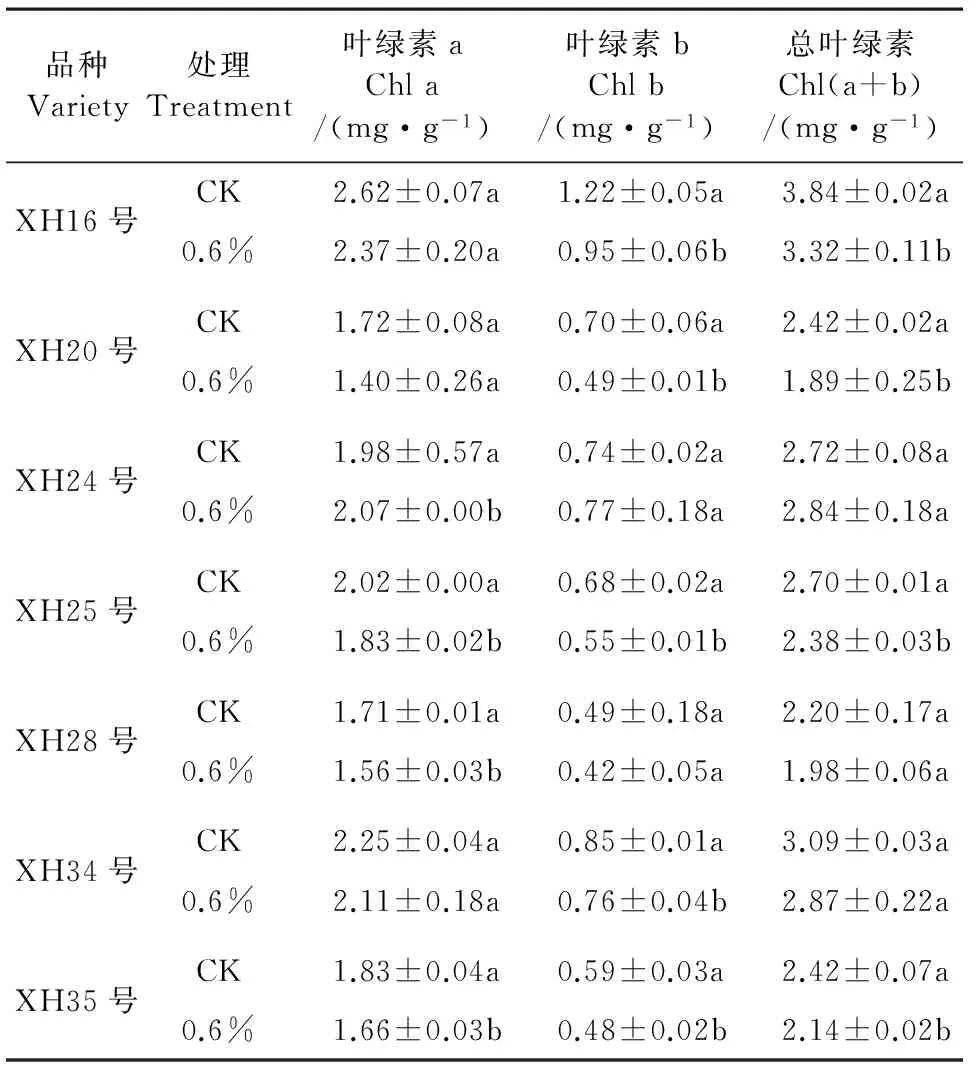
表2 盐胁迫对海岛棉幼苗叶片叶绿素含量的影响
2.4 盐胁迫对海岛棉幼苗叶片光合气体交换参数的影响
如表3所示,XH28号、XH16号和XH34号幼苗叶片CK净光合速率(Pn)略高于其它供试品种。盐胁迫条件下,5个海岛棉幼苗叶片净光合速率都表现出比CK下降的趋势,且与对照相比差异都达到显著水平(P<0.05)。0.6%NaCl盐胁迫下,XH24号的净光合速率较对照有小幅增加,差异没有达到显著水平;而XH34号的净光合速率较CK有下降,但差异未达到显著水平。各供试品种之间比较,在盐胁迫下,下降低幅度最大是XH20号,与CK相比下降41.28%;XH16号次之,下降为33.42%;XH25号、XH35号、XH28号和XH34号分别下降31.08%、30.13%、24.93%和18.43%。
NaCl盐胁迫影响海岛棉品种胞间CO2浓度(Ci)(表3)。试验结果表明,盐胁迫条件下,7个海岛棉品种Ci总体呈现下降趋势,且各供试品种Ci下降幅度与对照相比达到了显著水平。0.6%盐胁迫下,XH20号、XH16号、XH25号、XH35号、XH28号、XH34号和XH24号分别下降了16.82%、15.40%、14.47%、11.87%、11.60%、9.46%和9.13%。
叶片气孔导度是叶片与外界环境进行气体交换(CO2、O2和水蒸气等)的主要通道。盐胁迫下各海岛棉品种气孔导度均有所下降,这说明盐胁迫环境下叶片气孔导度受阻。0.6%盐胁迫之后,XH24号的气孔导度下降幅度未达到显著水平,其余品种的下降幅度都达到了显著水平。同等盐胁迫条件下,XH20号Ci下降幅度较大。
盐胁迫下6个海岛棉幼苗叶片蒸腾速率(Tr)总体呈现下降趋势,各供试品种Tr下降幅度均与CK相比达到显著水平(P<0.05)。盐胁迫下,XH20号、XH16号、XH25号、XH35号、XH28号和XH34号分别下降了64.62%、49.32%、45.53%、39.47%、27.82%和16.98%;而XH24号Tr较对照有小幅增加,增加了12.93%。品种之间比较,XH34号、XH28号和XH35号相对其它品种降低幅度较小,XH20号Tr较大。
2.5 盐胁迫对海岛棉幼苗叶片可溶性糖(SS)含量的影响
在盐渍条件下,植物细胞可以通过积累在渗透上有活性而对细胞无毒,对代谢无抑制作用的可溶性溶质来进行渗透调节,降低渗透势。这些溶质主要有脯氨酸、甜菜碱和可溶性糖等[13]。由图3可知,盐胁迫使海岛棉幼苗叶片可溶性糖含量增加,但不同海岛棉幼苗叶片SS含量增加程度不一样,XH25号、XH16号和XH20号增加幅度相对其余4个品种较低。
2.6 盐胁迫对海岛棉幼苗叶片可溶性蛋白质(SP)含量的影响
NaCl胁迫对海岛棉幼苗叶片中可溶性蛋白含量的影响见图4。0.6%NaCl盐胁迫使幼苗叶片可溶性蛋白质含量均增加。品种之间比较,XH24号、XH34号、XH28号和XH35号的增加幅度大于其余3个品种,增加幅度与CK相比达到了显著水平。
2.7 盐胁迫对海岛棉幼苗叶片丙二醛(MDA)含量的影响
植物在逆境下常常发生膜脂过氧化作用,机体内积累许多有害的过氧化产物,丙二醛是(MDA)是膜脂过氧化的主要产物之一,其含量的多少可代表膜损伤的严重程度[14]。
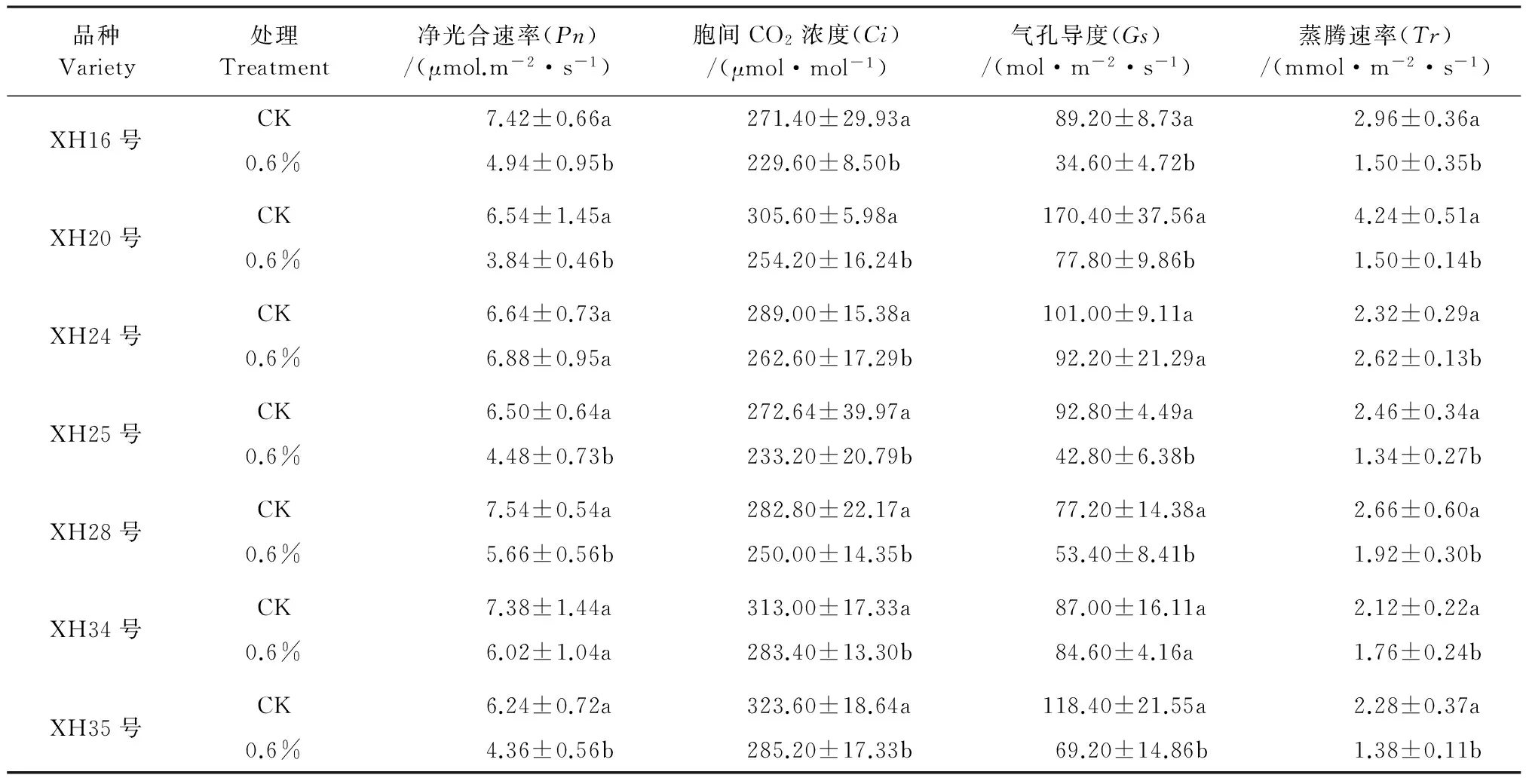
表3 盐胁迫对海岛棉幼苗叶片光合气体交换参数的影响
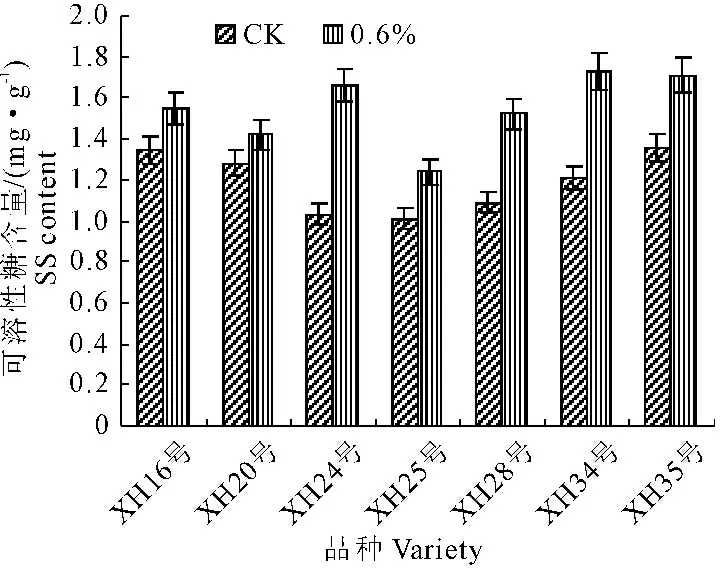
图3 盐胁迫对海岛棉幼苗叶片SS含量的影响
Fig.3 Effects of salt stress on SS content in leaves of island cotton seedlings
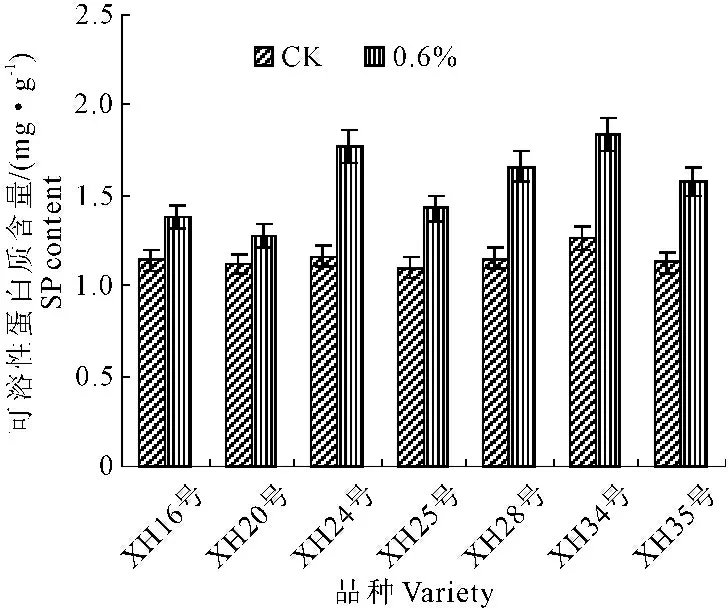
图4 盐胁迫对海岛棉幼苗叶片SP含量的影响
Fig.4 Effects of salt stress on SP content in leaves of island cotton seedlings
由图5可知,在0.6%盐胁迫下,海岛棉幼苗叶片中的MDA含量均有不同程度增加。在同样盐胁迫条件下,品种之间比较可见,XH35号、XH25号、XH16号和XH20叶片MDA含量增加较显著,与对照相比分别增加了18.64%、29.38%、52.69%和63.63%;而XH28号、XH34号和XH24号仅增加了17.71%、9.86%和4.68%。
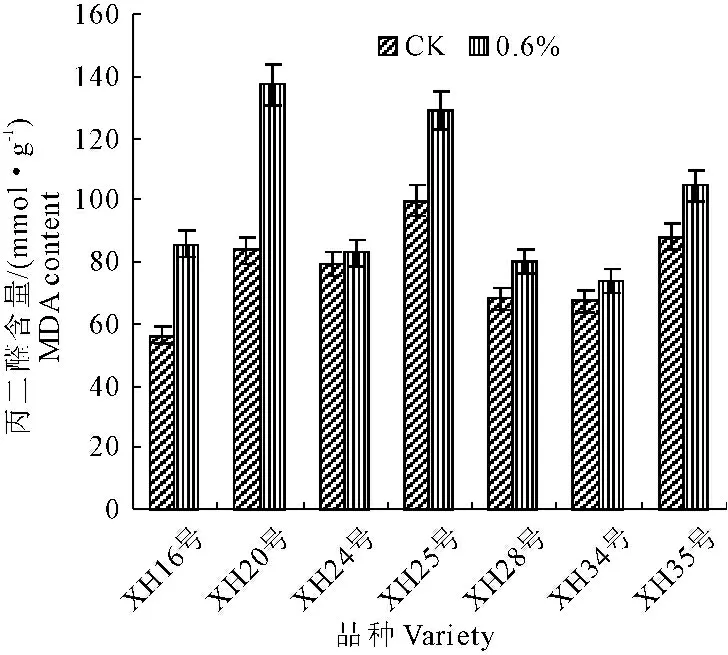
图5 盐胁迫对海岛棉幼苗叶片MDA含量的影响
Fig.5 Effects of salt stress on MDA content in leaves of island cotton seedlings
3 讨 论
3.1 盐胁迫对海岛棉幼苗生长发育的影响
在自然条件下,植物的生长发育经常会遭受各种逆境因素(干旱、盐碱和低温等)的影响,使其生长发育受到抑制,甚至导致植株死亡。盐害是土壤中可溶性盐类过多对植物的不利影响[15]。盐胁迫会造成植物发育迟缓,抑制植物组织和器官的生长和分化,使植物的发育进程提前[16]。本试验中0.6%盐胁迫对海岛棉种子出苗的影响较小,但幼苗株高、物质的积累受影响较显著,这与文卿琳等[17]、杨小环[18]等研究一致,无论盐浓度的高低都对幼苗产生抑制作用。
3.2 盐胁迫对海岛棉幼苗叶片光合参数的影响
盐胁迫可能通过渗透胁迫、离子毒害和糖分积累等因素对光合作用造成抑制作用[19]。盐胁迫下,引起植物叶片光合效率降低的植物自身因素主要有气孔的部分关闭导致的气孔限制和叶肉细胞光合活性的下降导致的非气孔限制[20]。王美娥等[21]、孙璐等[2]等研究中报道,低盐浓度下气孔因素是引起光合速率下降的主要原因,而高盐浓度下非气孔因素是主要限制因素。杨淑萍等(2010)海岛棉盐胁迫研究中表明,海岛棉光合作用的下降是初期低盐胁迫下以气孔限制为主导因子而逐渐转变为以非气孔限制为主导因子[22]。本试验结果表明,0.6%盐胁迫下海岛棉幼苗叶片气孔导度(Gs)、胞间CO2浓度(Ci)均比对照有所下降,因此导致净光合速率(Pn)下降的因素是气孔限制。
3.3 盐胁迫对海岛棉幼苗叶片渗透调节物质含量的影响
可溶性糖是一种渗透调节物质,也是合成有机溶质的碳架和能量来源,还可在细胞内无机离子浓度高时保护酶类[23-24]。植物在盐胁迫初期叶片中可溶性糖含量增加,但随着时间和盐浓度的增加其含量却降低,这可能是呼吸作用的增强和光合作用的衰竭所致[24]。杨帆等[25]的研究发现,构树幼苗可溶性糖含量盐胁迫之前高,盐胁迫之后变化不明显,但张子学等[26]研究中发现,在适宜的NaCl条件下,叶片可溶性糖含量增加,而在高盐浓度下叶片可溶性糖含量下降,这与本试验结果盐胁迫下海岛棉幼苗叶片可溶性糖含量增加的结论一致。马洪波等[27]研究表明,盐胁迫提高了小麦叶片可溶性蛋白质含量,这也与本试验研究结果一致。
3.4 盐胁迫对海岛棉幼苗叶片丙二醛(MDA)含量的影响
本试验结果表明,在0.6%盐胁迫下,不同基因型海岛棉叶中的MDA含量均升高,但不同耐盐性海岛棉基因型在NaCl胁迫下MDA含量变化不一致,相同NaCl浓度处理下耐盐性较好的品种叶内的MDA含量均低于盐敏感品种,这与马丽等[28]、王秀玲等[29]和韩冰[30]等研究结果一致。
4 结 论
0.6%NaCl盐胁迫对海岛棉种子出苗率影响较小,但对幼苗株高、鲜重、干重和植株含水量影响较大。盐胁迫下海岛棉幼苗叶片叶绿素含量均下降,说明盐胁迫影响了叶绿素正常合成,光合作用响应受到了影响。盐胁迫降低了不同基因型海岛棉幼苗叶片净光合速率,耐盐性较好品种下降幅度低于盐敏感品种。海岛棉幼苗叶片净光合速率降低可能是气孔限制因素所引起的。从形态指标与生理特性等方面综合分析,同等盐胁迫条件下,供试品种在0.6%NaCl盐胁迫下基本上都表现出较好的耐盐性,XH24号、XH34号、XH28号XH35号、XH25号和XH16号等品种之间耐盐性差异不大,而XH20号幼苗长势相对不良。
[1] 马翠兰,刘星辉,陈中海.果树对盐胁迫的反应及耐盐性鉴定的研究进展[J].福建农业大学学报,2000,(2):161-166.
[2] 孙 璐,周宇飞,李丰先,等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J].中国农业科学,2012,(16):3265-3272.
[3] 杨淑萍,危常州,梁永超.盐胁迫对海岛棉不同基因型幼苗生长及生理生态特征的影响[J].生态学报,2010,(9):2322-2331.
[4] 王俊娟,王德龙,樊伟莉,等.陆地棉萌发至三叶期不同生育阶段耐盐特性[J].生态学报,2011,(13):3720-3727.
[5] 杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉种子萌发特性的影响[J].中国棉花,2012,(12):6-10.
[6] 谢德意,王惠萍,王付欣,等.盐胁迫对棉花种子萌发及幼苗生长的影响[J].种子,2000,(3):10-12.
[7] 王俊娟,叶武威,周大云,等. 盐胁迫下不同耐盐类型棉花的萌发特性[J].棉花学报,2007,(4):315-317.
[8] 孙小芳,郑青松,刘友良.NaCl胁迫对棉花种子萌发和幼苗生长的伤害[J].植物资源与环境学报,2000,(3):22-25.
[9] 刘 萍,等.植物生理学实验技术[M].北京:科学出版社,2007:39-41.
[10] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2007:111-112.
[11] 蔡庆生.植物生理学实验[M].北京:中国农业出版社,2013,(2):175-177.
[12] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2007:173-174.
[13] 刘 巍,于志水,纪纯阳,等.植物盐胁迫研究进展[J].防护林科技,2008,(1):57-61.
[14] 张亚冰,刘崇怀,潘 兴,等.盐胁迫下不同耐盐性葡萄砧木丙二醛和脯氨酸含量的变化[J].河南农业科学,2006,(4):84-86.
[15] 杨月红,孙庆艳,沈 浩.植物的盐害和抗盐性[J].生物学教学,2002,(11):1-2.
[16] 刘 巍,于志水,纪纯阳,等.植物盐胁迫研究进展[J].防护林科技,2008,(1):57-61.
[17] 文卿琳,阿曼古丽·肉孜.盐胁迫对海岛棉种子萌发的影响[J].中国种业,2008,(1):39-41.
[18] 赵 旭,王林权,周春菊,等.盐胁迫对不同基因型冬小麦发芽和出苗的影响[J].干旱地区农业研究,2005,23(4):108-112.
[19] 张 娟,姜闯道,平吉成.盐胁迫对植物光合作用影响的研究进展[J].农业科学研究,2008,(3):74-80.
[20] 王东明,贾 媛,崔继哲.盐胁迫对植物的影响及植物盐适应性研究进展[J].中国农学通报,2009,25(4):124-128.
[21] 王美娥,陈 明,郎有忠,等.盐分胁迫对小麦光合生产及产量的影响[J].江苏农业学报,2013,(4):727-733.
[22] 杨淑萍,危常州,梁永超.盐胁迫对不同基因型海岛棉光合作用及荧光特性的影响[J].中国农业科学,2010,(8):1585-1593.
[23] 赵玉蓉,王维中.植物在盐害下的渗透调节[J].徐州师范学院学报(自然科学版), 1995,13(4):59-62.
[24] 张海燕,赵可夫.盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究[J].植物学报,1998,40(1):56-61.
[25] 杨 帆,丁 菲,杜天真.土壤盐胁迫对构树幼苗生理特性的影响[J].江西农业大学学报,2008,(4):684-688.
[26] 张子学,王正鹏,凌中鑫,等.不同棉花品种NaCl胁迫的生理表现及其耐盐性筛选指标分析[J].中国棉花,2004,(8):8-10.
[27] 马洪波,曹月阳,陈 杰,等.土壤盐胁迫对小麦养分和渗透调节物质的影响[J].江苏农业学报,2012,(6):1300-1305.
[28] 马 丽,侯振安,梁永超,等.NaCl胁迫对棉花幼苗生理特性的影响[J].石河子大学学报(自然科学版),2008,(2):180-184.
[29] 王秀玲,程 序,谢光辉,等.NaCl胁迫对甜高粱发芽期生理生化特性的影响[J].生态环境学报,2010,(10):2285-2290.
[30] 韩 冰,徐 刚,郭世荣,等.不同浓度盐胁迫对黄瓜幼苗生长和生理代谢的影响[J].江苏农业学报,2014,(1):172-177.
Effects of salt stress on growth of island cotton seedlings
Amangul·Mambetale1, WANG Li-hong1, ZHENG Hui1, ZHANG Ju-song1, TIAN Li-wen2)
(1.XinjiangAgriculturalUniversity/ResearchCenterofCottonEngineering,Urumqi,Xinjiang830052,China;2.InstituteofEconomicCrops,XinjiangAcademyofAgriculturalSciences,Urumqi,Xinjiang830091,China)
A pot experiment was carried out to explore the growth and photosynthetic characteristics of 7 island cotton varieties (including XH16, XH20, XH24, XH25, XH28, XH34 and XH35) under salt stress (0.6% NaCl), so as to provide a theoretical basis for the cultivation of island cotton and breeding of salt-tolerant varieties. The results showed that, under 0.6% NaCl salt stress, the germination rate, plant height, fresh weight per plant, dry weight per plant, chlorophyll content (Chl), net photosynthetic rate (Pn), intercellular CO2concentration (Ci), stomatal conductance (Gs) and transpiration rate (Tr) were decreased, while the plant water content, soluble sugar (SS) content, soluble protein (SP) content and malondialdehyde (MDA) content were increased. Under the same condition of salt stress, the plant water content and MDA content were lower while the content of SS and SP were higher in XH24, XH34, XH28 and XH35 than those in the other 3 varieties, showing a good tolerance to salt stress. It was also found that 0.6% NaCl salt stress affected the height, fresh weight, dry weight and water content of seedlings more than the seed germination rate of island cotton. The decrease of net photosynthetic rate in leaves of island cotton seedlings might be caused by stomatal limitation factors. All the tested island cotton varieties showed a rather good tolerance to salt stress, except for XH20.
salt stress; island cotton; seedling growth; effect
1000-7601(2017)02-0121-06
10.7606/j.issn.1000-7601.2017.02.19
2015-11-19基金项目:国家“十二五”科技支撑计划项目“棉花高产高效关键技术研究与示范”课题(2014BAD11B02);新疆自治区成果转化项目“优良棉花品种及配套技术集成示范”(201354103);科技部富民强县项目“优质棉花高效生产技术集成示范及产业化开发”;国家棉花产业技术体系长绒棉育种科学家岗位(CARS-18-07)
阿曼古丽·买买提阿力(1990—),女,新疆克州人,硕士研究生,主要从事棉花逆境生理研究。E-mail: 1164658443@qq.com。
张巨松(1963—),男,江苏江都人,教授,主要从事作物高产栽培生理生态研究。E-mail:xjndzjs@163.com。
S562
A
