肝移植术后急性肝动脉血栓形成的介入治疗
2017-05-10王建华颜志平程洁敏
张 华 王建华△ 颜志平 程洁敏 刘 嵘 钱 晟 周 俭
(1复旦大学附属中山医院介入放射科, 2肝外科 上海 200032;3上海市影像医学研究所 上海 200032)
肝移植术后急性肝动脉血栓形成的介入治疗
张 华1,3王建华1,3△颜志平1程洁敏1刘 嵘1钱 晟1周 俭2
(1复旦大学附属中山医院介入放射科,2肝外科 上海 200032;3上海市影像医学研究所 上海 200032)
目的 评估介入治疗急性肝动脉血栓形成的近期与远期疗效。方法 对复旦大学附属中山医院2003年3月至2015年10月出现的34例急性肝动脉血栓形成患者的介入处理方式和长期随访资料进行回顾性分析。结果 34例急性肝动脉血栓形成患者均行经肝动脉置管尿激酶溶栓治疗。其中21例溶栓过程中联合支架植入,3例合并脾动脉盗血行脾动脉栓塞。技术和临床成功率均为91% (31/34)。2例出现与介入操作相关的并发症。肝动脉1年、2年、3年及5年通畅率分别为82%、73%、57%和57%。患者的无阻塞中位生存期达94个月。结论 介入治疗急性肝动脉血栓形成获得了良好的近期与远期疗效,可作为肝移植术后急性肝动脉血栓形成的首选治疗方式。
肝移植; 急性肝动脉血栓形成; 介入治疗
肝动脉血栓形成(hepatic artery thrombosis,HAT)是肝移植术(liver transplantation,LT)后最常见也最严重的血管并发症,占所有动脉并发症的50%以上[1]。成人发病率为4%~11%[2],儿童发病率为11%~26%[3],如不及时治疗其病死率可高达50%~70%[2]。截至到目前为止,关于介入成功治疗HAT的案例相继被报道[4-5],但因其存在致死性腹腔内出血风险且缺乏长期随访结果[6],所以临床上对于HAT能否采用介入处理尚存在争议。本文回顾性分析复旦大学附属中山医院2003年3月至2015年10月出现的34例肝动脉血栓形成患者的介入处理方式及长期随访资料,评估介入治疗HAT的近期与远期疗效。
资 料 和 方 法
临床资料 2003年3月至2015年10月经肝动脉造影证实并接受介入治疗的34例肝移植术后HAT的患者。其中男32例,女2例。年龄7~64岁,平均年龄(45.3±11.5)岁。28例行同种异体原位肝移植,5例行亲体活体肝移植,1例行劈裂式肝移植。原发疾病中肝恶性肿瘤21例,乙型肝炎肝硬化肝功能失代偿6例,肝豆状核变性4例,布加氏综合征1例。先天性胆道闭锁2例。34例HAT发生于肝移植术后0~21天,平均(6.4±5.9)天。介入术前患者活化部分凝血活酶时间25.5~38.2 s,平均(32.3±7.4) s。凝血酶原时间9.6~19.2 s,平均(15.1±6.5) s。
经肝动脉局部置管溶栓 经右侧股动脉入路,5FRH导管插管至腹腔动脉、肠系膜上动脉、肝总动脉造影了解肝动脉闭塞部位。溶栓微导管小心通过肝动脉狭窄闭塞段造影了解闭塞段及肝内分支显影情况。4 000单位肝素静脉推注或经溶栓微导管灌注行全身肝素化。溶栓微导管超选择至血栓内部,尿激酶10万~25万单位 15 min内团注完毕。重复肝动脉造影了解溶栓情况及肝内分支血流灌注情况。若溶栓效果不佳,尿激酶25万~75万单位 30 min内再次团注。重复肝动脉造影。根据术中溶栓后肝动脉造影情况可酌情追加5万~10万单位尿激酶。待较大血栓溶解,肝动脉主干及分支血流增加,保留溶栓导管尿激酶3万~5万单位/h持续溶栓12~24 h。溶栓过程中每5 h急查肝、肾、凝血功能,密切监测患者生命体征并腹腔引流管及皮肤穿刺部位有无出血、渗血。12 h重复肝动脉造影1次了解溶栓效果,待血栓完全溶解,肝内动脉分支显影清晰,撤回溶栓导管,保留导管鞘管2~3天,每天行肝动脉造影1次(图1A-C)。
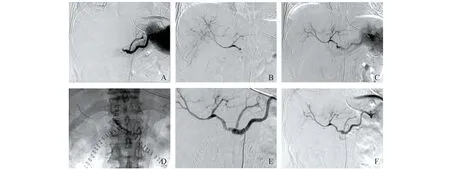
A:A patient had hepatic artery thrombosis and anastomotic stenosis.Initial segment of hepatic artery was kinked.Intrahepatic artery branches were not showed.B:A filling defect was seen in hepatic artery anastomosis.Intrahepatic artery branches were displayed.C:Thrombus was dissolved basically except thrombus of anastomosis after 24 hours thrombolytic therapy.D:Stent with diameter of 4 mm and length of 38 mm were placed.E:Hepatic artery kinks and stenosis disappeared.The blood flow in the hepatic artery was unobstructed.F:Hepatic artery angiography showed that blood flow in stent was unobstructed and blood flow of hepatic arterial recovered systematically.
支架植入 溶栓后肝动脉伴有狭窄、扭曲则行球囊扩张式支架植入。6F导引导管置于腹腔动脉,微导管引入0.014英寸导丝通过狭窄血栓段,引入支架跨过狭窄或血栓段,扩张球囊释放支架(图1D~F)。
脾动脉栓塞 溶栓过程中如合并脾动脉明显增粗分流肝动脉血流较大的情况下行弹簧圈,减少脾动脉分流,增加肝动脉血供(图2)。
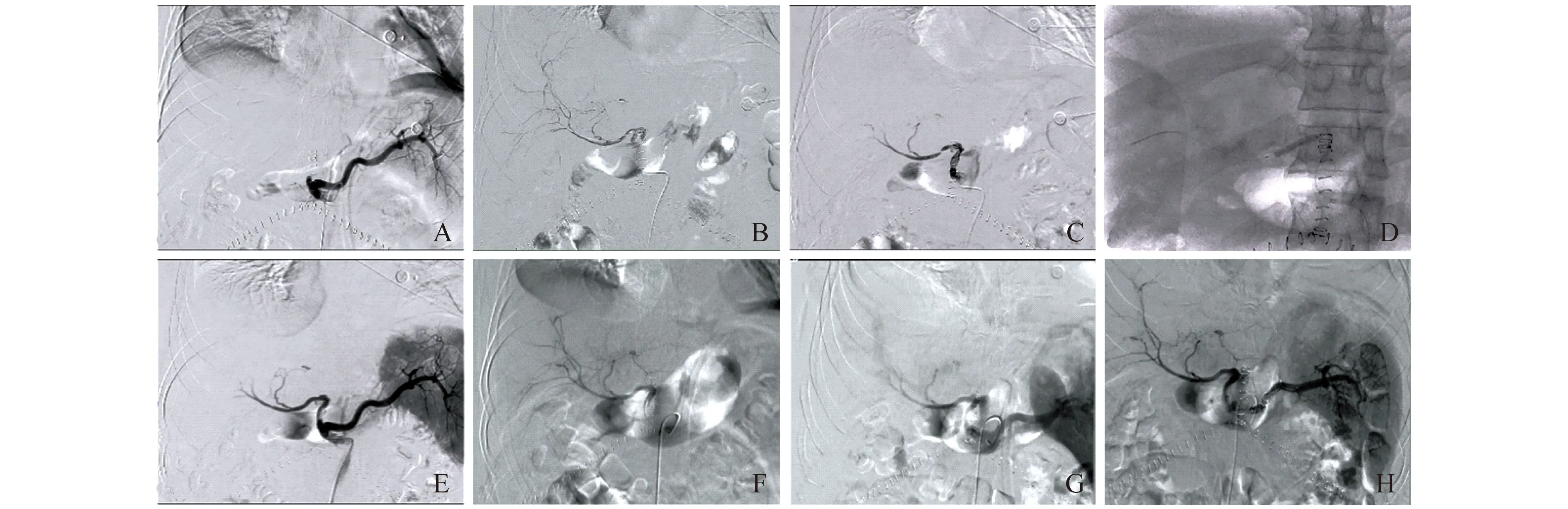
A:Hepatic artery angiography showed that hepatic artery were not displayed.B:A filling defect and stenosis were seen in initial segment of hepatic artery and distal segment of hepatic artery anastomosis.C:Thrombus was dissolved partially after thrombolytic therapy and hepatic artery stenosis was displaied clearly.D:Drug eluting stent with diameter of 4 mm and length of 23 mm were placed.E:The blood flow in stent was unobstructed.A filling defect was seen in initial segment of hepatic artery still.F:Thrombus was dissolved basically and the blood flow of intrahepatic artery branches was increased obviously.G:Blood flow of hepatic artery was shunted by blood flow of splenic artery.H:The proximal blood flow of splenic artery was embolization by 6 coil .Blood flow of hepatic arterial and liver tissue perfusion were improved significantly.
结 果
本组34例HAT发生于肝移植术后0~21天,平均(6.4±5.9)天。34例HAT患者均行尿激酶溶栓治疗,尿激酶用量35万~900万单位,平均(125±130)万单位。溶栓时间5~120 h。 其中21例联合支架植入,共植入支架24枚、直经2.5~5.0 mm,长度10~38 mm。3例合并脾动脉盗血行脾动脉栓塞。 技术和临床成功率均为91%(31/34,3例失败均为儿童HAT患者,3例均为支架内血栓形成再次溶栓失败,1例行二次肝移植,2例死亡)。15例患者在溶栓过程中发生腹腔血性引流液增多现象,在调整抗凝方案,减少或停止尿激酶治疗、腹部加压包扎适当输入少浆血、血浆、人凝血酶原复合物后好转,2例合并肝动脉分支出血行弹簧圈栓塞出血停止。2例出现与介入操作相关并发症,1例股动脉穿刺部位假性动脉瘤形成经局部加压包扎后好转、1例肝固有动脉小夹层形成,后植入支架,夹层消失。肝动脉1年、2年、3年及5年通畅率分别为83%、73%、57%和57%。患者的无阻塞中位生存期达94个月(图3)。
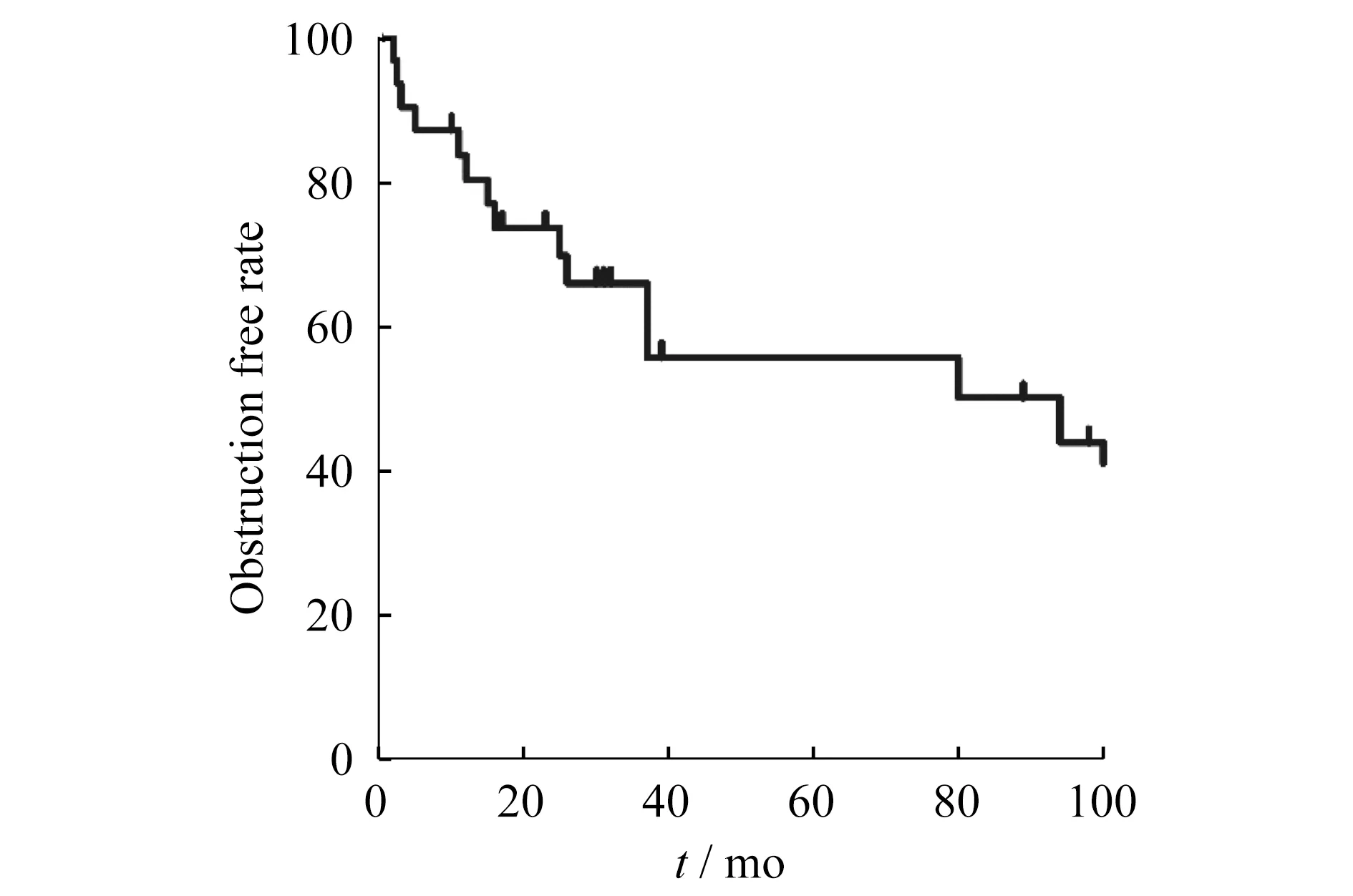
图3 Kaplane-Meier描述肝动脉通畅率及患者无阻塞中位生存时间Fig 3 Kaplane-Meierestimate the rate of hepatic artery patency and obstruction-free median survival time
讨 论
根据发病时间,通常将肝移植术后30天之内HAT称为早期HAT,超过30天的称为晚期HAT[4]。目前,国内外尚无公认的急性肝动脉血栓形成溶栓治疗指征。但是公认的是对于HAT早期诊断和治疗是关键。一方面由于新鲜血栓含水量更高、纤维蛋白矩阵结合较为松散使其对于溶栓物质更为敏感。另一方面,早期诊断治疗可减少因移植肝缺血、缺氧而引起的一系列并发症[7],对于保存移植物功能具有重要意义。基于以上观点,我们认为对于无治疗禁忌症的、发生于肝移植术后0~30天内的HAT患者,均应积极、迅速给予溶栓治疗。本组34例HAT发生于肝移植术后的0~21天,均为早期HAT,且均在肝移植术后彩色多普勒超声提示肝动脉异常后第一时间行肝动脉血管造影明确诊断并行溶栓治疗。
相较于传统的经静脉滴注进行全身性溶栓的方式,我们采用将溶栓导管超选入血栓内部,使得血栓与溶栓物质接触面积更大,局部溶栓药物浓度更高,从而减少尿激酶用量、缩短溶栓时间,提高溶栓的安全性。术前要求患者活化部分凝血活酶时间即APTT小于正常值的3倍,PT小于正常值的2.5倍。术中我们采用短时间、高剂量、团注尿激酶的方式,有利于较大血栓的快速溶解,恢复部分肝脏血流,缓解肝脏缺血症状。Kim等[8]也采用同样的方式成功开通了闭塞肝动脉,治疗了2例急性HAT患者。然而大部分肝动脉血栓单凭上述术中溶栓的方式并不能得到完全的开通,因此针对后续剩余血栓采用小剂量尿激酶持续加压灌注的方式彻底恢复肝动脉血流,术后每12 h重复肝动脉造影1次,了解溶栓情况及时调整尿激酶剂量,并对溶栓过程中出现的并发症行相应的介入处理。待血栓完全溶解,肝内动脉分支显影清晰,撤回溶栓导管,保留导管鞘管2~3天,每天行肝动脉造影1次,防止HAT再次形成,以确保疗效。这是我们与其他文献报道肝动脉尿激酶溶栓的主要区别点。
溶栓安全、有效的临床使用剂量,相关文献报道不一。Boyvat等[5]推荐相对安全、有效的尿激酶剂量为5万~25万。本组尿激酶用量为35万~900万单位,平均(125±130)万单位。本组尿激酶个体化差异较大原因主要有两点:(1)文献提供的溶栓计量只采用术中短时间、相对高剂量、团注尿激酶的方式,而并未使用后续的小剂量、持续加压滴注的溶栓方式,增加溶栓风险的同时使得尿激酶安全计量相对偏低,且相关文献的急性HAT患者人数少(仅有4例),对于尿激酶的安全使用剂量的统计存在偏倚,而本组急性HAT患者高达34例,对于尿激酶安全使用量的统计更具代表性。(2)本组2例急性HAT患者分别在初次溶栓成功后的12 h及72 h后肝动脉再次栓塞,立即术中给予再次尿激酶溶栓,且将患者后续尿激酶用量提高至8万单位/h,2例患者分别于溶栓后的24 h、72 h后再开通,二次溶栓尿激酶累计使用量为325万及900万,大大超出本组尿激酶用量的平均值。本组溶栓时限为5~120 h,溶栓术后与肝动脉栓塞所致的肝功能恢复至正常时间为9~21天。Pearson估计二者之间的相关性得出P<0.05,相关系数r=0.696 4,即溶栓时间越短患者溶栓后肝功能恢复至正常(短期疗效指标之一)所需时间越快。本组肝动脉通畅时间为6~100个月,相同统计学方法评估溶栓时间与肝动脉长期通畅时间(长期疗效)二者之间的相关性P>0.05,即溶栓时间的长短与肝动脉长期通畅时间不存在相关性。
溶栓过程中抗凝是十分必要的,文献推荐将PT延长至正常值的2~2.5倍,有利于提高溶栓疗效。溶栓过程中我们密切关注患者凝血功能及一般状况,本组34例溶栓患者,介入术前患者活化部分凝血活酶时间25.5~38.2 s,平均(32.3±7.4) s。凝血酶原时间9.6~19.2 s,平均(15.1±6.5) s。溶栓过程中在确保患者无出血倾向的前提下,我们将患者的凝血酶原时间控制在25 s (正常值10~13 s)。相关文献报道将α2-抗纤维蛋白溶酶作为溶栓过程中的监测指标更为安全有效,但仍需临床试验进一步验证[9]。溶栓最常见的并发症是出血,本组15例患者在溶栓过程中发生腹腔血性引流液增多现象,在调整抗凝方案,减少或停止尿激酶治疗、腹部加压包扎适当输入少浆血、血浆、人凝血酶原复合物后好转,其中2例合并肝动脉分支出血行弹簧圈栓塞后出血停止。
未经治疗的肝动脉狭窄(hepatic artery stenosis,HAS)在6个月后发展为HAT的可能性高达65%[10]。溶栓虽开通了肝动脉血流,但并未解决吻合口缺陷(例如肝动脉狭窄、扭曲等)而引起的再狭窄问题。Yamakado等[11]认为早期狭窄的吻合口多伴有反应性的水肿,PTA效果有限且增加肝动脉破裂的风险。加之PTA再狭窄率高达60%需再次PTA或联合支架植入[12]。基于以上观点,对于溶栓术后合并肝动脉狭窄首选支架治疗,但现在临床上尚无专门的肝动脉支架。尽管Cotroneo等[13]报告了成功使用自扩式支架治疗HAS和HAT的案例。但是多数文献推荐使用冠状动脉支架系统治疗HAT和HAS[14]。因冠状动脉支架相较于其他的外周血管支架具有更好的顺应性和灵活性,在跨过迂曲、成交的肝动脉狭窄段不易引起肝动脉损伤。但是冠状动脉支架并不适用于所有的肝动脉,特别在儿童肝移植中,过细、扭曲的肝动脉使得置放支架的技术难度加大,易引起血栓再形成[11]。值得一提的是,本组经介入处理失败的3例HAT患者均为儿童,失败原因均为支架内血栓形成再次溶栓失败,所以对于儿童HAT患者的支架治疗尚有待商榷。对于药物洗脱式支架能否提高肝动脉的长期通畅率尚无最后定论。Singhal等[15]报道了植入药物洗脱式支架治疗HAT和HAS的3例患者,在随访的4~26个月均发生闭塞。
肝移植术后脾动脉窃血综合征(splenic artery steal syndrome,SASS)最先由德国Langer等于1990年提出[16],发病率约为5.9%[17]。粗大的脾动脉和肝动脉“争夺”腹主动脉血流,使得肝动脉供血不足,经脾动脉分流后的肝动脉血流变缓,当合并其他因素如排异反应、缺血损伤时,肝内阻力增加,极易引起肝动脉血栓形成[18]。尽早解决脾动脉分流问题,维持肝动脉血供可提高溶栓效率。传统的外科脾切除可较好地解决SASS问题,但术后出现门静脉血栓形成及脾切除后相关感染的风险较高[17]。脾动脉缩细术相关并发症少,也可较好地解决SASS问题,但其属于开放性手术,创伤较大,对于肝移植术前若合并SASS时作为首选[17]。Nussler等[17]对14例肝移植术后合并SASS行脾动脉主干弹簧圈栓塞,效果良好且无一例出现并发症。Vogl等[19]的研究也得到了相同的结果。本组3例急性HAT患者术中造影发现SASS均行脾动脉主干弹簧圈栓塞。1例因合并肾功能衰竭后治疗无效,于术后1月死亡。余2例在随访期间患者一般状况良好,存活至今。
综上所述,介入治疗急性肝动脉血栓形成的近期与远期疗效良好,可作为肝移植术后急性肝动脉血栓形成的首选治疗方式。
[1] DUFFY JP,HONG JC,FARMER DG,etal.Vascular complications of orthotopic liver transplantation:experience in more than 4,200 patients[J].JAmCollSurg,2009,208(5):896-903,discussion 903-905.
[2] LOPEZ-BENITEZ R,BARRAGAN-CAMPOS HM,RICHTER GM,etal.Interventional radiologic procedures in the treatment of complications after liver transplantation[J].ClinTransplant,2009,23(Suppl 21):92-101.
[3] BANC-HUSU AM,ANUPINDI SA,LIN HC.Resolution of hepatic artery thrombosis in 2 pediatric liver transplant patients[J].JPediatrGastroenterolNutr,2016,62(4):546-549.
[4] ZHOU J,FAN J,WANG JH,etal.Continuous transcatheter arterial thrombolysis for early hepatic artery thrombosis after liver transplantation[J].TransplantProc,2005,37(10):4426-4429.
[5] BOYVAT F,AYTEKIN C,FIRAT A,etal. Diagnostic and therapeutic management of hepatic artery thrombosis and stenosis after orthotopic and heterotopic liver transplantation[J].TransplantProc,2003,35(7):2791-2795.
[6] PIARDI T,LHUAIRE M,BRUNO O,etal.Vascular complications following liver transplantation:A literature review of advances in 2015[J].WorldJHepatol,2016,8(1):36-57.
[7] SHIMIZU K,TANI T,TAKAMURA H,etal. Partial portal arterialization in living-donor liver transplantation for hepatic artery occlusion[J].Transplantation,2004,77(6):954-955.
[8] KIM BW,WON JH,LEE BM,etal. Intraarterial thrombolytic treatment for hepatic artery thrombosis immediately after living donor liver transplantation[J].TransplantProc,2006,38(9):3128-3131.
[9] SEMBA CP,BAKAL CW,CALIS KA,etal.Alteplase as an alternative to urokinase.Advisory panel on catheter-directed thrombolytic therapy[J].JVascIntervRadiol,2000,11(3):279-287.
[10] ORONS PD,SHENG R,ZAJKO AB.Hepatic artery stenosis in liver transplant recipients:prevalence and cholangiographic appearance of associated biliary complications[J].AJRAmJRoentgenol,1995,165(5):1145-1149.
[11] YAMAKADO K,NAKATSUKA A,TAKAKI H,etal.Stent-graft for the management of hepatic artery rupture subsequent to transcatheter thrombolysis and angioplasty in a liver transplant recipient[J].CardiovascInterventRadiol,2008,31(Suppl 2):S104-S107.
[12] HAMBY BA,RAMIREZ DE,LOSS GE,etal.Endovascular treatment of hepatic artery stenosis after liver transplantation[J].JVascSurg,2013,57(4):1067-1072.
[13] COTRONEO AR,DI STASI C,CINA A,etal.Stent placement in four patients with hepatic artery stenosis or thrombosis after liver transplantation[J].JVascIntervRadiol,2002,13(6):619-623.
[14] HUANG M,SHAN H,JIANG Z,etal.The use of coronary stent in hepatic artery stenosis after orthotopic liver transplantation[J].EurJRadiol,2006,60(3):425-430.
[15] SINGHAL A,STOKES K,SEBASTIAN A,etal.Endovascular treatment of hepatic artery thrombosis following liver transplantation[J].TransplInt,2010,23(3):245-256.
[16] PINTO S,REDDY SN,HORROW MM,etal.Splenic Artery Syndrome after orthotopic liver transplantation:a review[J].IntJSurg,2014,12(11):1228-1234.
[17] NUSSLER NC,SETTMACHER U,HAASE R,etal.Diagnosis and treatment of arterial steal syndromes in liver transplant recipients[J].LiverTranspl,2003,9(6):596-602.
[18] TROISI R,HOSTE E,VAN LANGENHOVE P,etal.Modulation of liver graft hemodynamics by partial ablation of the splenic circuit:a way to increase hepatic artery flow?[J].TransplantProc,2001,33(1-2):1445-1446.
[19] VOGL TJ,PEGIOS W,BALZER JO,etal.Arterial steal syndrome in patients after liver transplantation:transarterial embolization of the splenic and gastroduodenal arteries[J].Rofo,2001,173(10):908-913.
Interventional therapy for acute hepatic artery thrombosis after liver transplantation
ZHANG Hua1,3, WANG Jian-hua1,3△, YAN Zhi-ping1, CHENG Jie-min1,LIU Rong1, QIAN Sheng1, ZHOU Jian2
(1DepartmentofInterventionalRadiology,2DepartmentofLiverSurgery,ZhongshanHospital,FudanUniversity,Shanghai200032,China;3ShanghaiInstituteofMedicalImaging,Shanghai200032,China)
Objective To evaluate the short-term and long-term efficacy of interventional therapy for acute hepatic artery thrombosis. Methods We analyzed retrospectively the interventional treatment and long-term follow-up data of 34 patients with acute hepatic artery thrombosis in Zhongshan hospital of Fudan University from March 2003 to October 2015. Results Thirty-four patients with acute hepatic artery thrombosis were performed with urokinase thrombolytic therapy.Twenty-one patients were implanted stents in the thrombolytic therapy.Splenic artery embolization were performed in 3 patient with splenic artery steal syndrome.Technical and clinical success rates were 91% (31/34).The complication associated with interventional procedures were observed in 2 patients.The patency rates of hepatic artery in 1,2,3 and 5 years were 82%,73%,57% and 57% respectively.The median obstruction free time was 94 months.Conclusions Good short-term and long-term effect have been obtained in interventional treatment for acute hepatic artery thrombosis,which can be used as the first treatment for acute hepatic artery thrombosis after liver transplantation.
liver transplantation; acute hepatic artery thrombosis; interventional treatment
R657.3
A
10.3969/j.issn.1672-8467.2017.02.009
2016-08-09;编辑:王蔚)
△Corresponding author E-mail:wang.jianhua@zs-hospital.sh.cn
