不同产地桑叶总酚、黄酮含量及抗氧化活性比较
2017-05-10俞燕芳杜贤明黄金枝夏裕辉
俞燕芳 杜贤明 黄金枝 夏裕辉
(江西省蚕桑茶叶研究所 330202)
不同产地桑叶总酚、黄酮含量及抗氧化活性比较
俞燕芳 杜贤明 黄金枝 夏裕辉
(江西省蚕桑茶叶研究所 330202)
以7个地区的“农桑14号”桑叶和4个地区的“强桑1号”桑叶为原料,采用比色法分别测定了桑叶总酚、总黄酮含量,以及桑叶提取液清除DPPH、清除ABTS能力和 FRAP等体外抗氧化活性。结果表明产地不同桑叶总酚、总黄酮的含量及其体外抗氧化活性有显著差异,其中江西永新地区“农桑14号”总酚和总黄酮的含量最高。
桑叶;产地;总酚;黄酮;抗氧化
桑叶营养丰富、药用价值高,是药食两用的植物资源。桑叶具有降血糖、降血压、降血脂、抗衰老、抗肿瘤、消炎退肿等功效,其中多酚和黄酮,是桑叶发挥功效的主要活性成分[1~3]。我国地域辽阔,桑树分布遍及全国各地,不同地域气候土壤等环境条件差异大,势必在很大程度上影响桑叶的物质代谢及其植物化学物组成。有研究表明产地不同桑叶中的活性物质含量也有差异[4~6],但是大部分文献中原料都是桑科植物桑MorusalbaL.的干燥叶,而未标明具体的桑树品种。
选取不同产地相同品种桑叶为材料,对桑叶的总酚、黄酮含量及抗氧化活性进行比较研究,为不同产地桑叶资源的利用提供参考依据。
1 材料与方法
1.1 材料
1.1.1 样品
2015年10月20日采集四川、江西、湖北的“农桑14号”和“强桑1号”桑叶,60℃烘干,粉碎,过60目筛备用。
1.1.2 试剂
没食子酸、芦丁、抗坏血酸、Trolox、DPPH、ABTS等标准品购自Sigma,无水乙醇、过二硫酸钾、亚硝酸钠、硝酸铝、氢氧化钠(分析纯)等试剂购自国药集团有限公司。
1.1.3 仪器
BIO-TEK ELX800 酶标仪(美国伯腾仪器有限公司)、722型分光光度计(上海精密科学仪器有限公司)、SK3310HP超声清洗器(上海科导超声仪器有限公司)。
1.2 方法
1.2.1 桑叶酚类物质的提取[7]
采用超声辅助法提取桑叶多酚和黄酮。称取桑叶粉 0.5 g,置50 mL离心管中,加 70% 乙醇30 mL,超声(300W)提取2次,每次30 min,合并提取液,以70%乙醇定容至100 mL,4℃保存。
1.2.2 总酚和总黄酮含量的测定[7]
桑叶总酚含量采用福林酚比色法测定,吸取 1.0 mL 桑叶提取液于 25 mL 容量瓶中,加入 2.0 mL Folin-Ciocalteu试剂,充分摇匀,5 min后加人 3 mL 10% Na2CO3溶液,混匀,加水定容,混匀后在30℃下避光放置反应60min,以去离子水代替样品溶液为空白,在760 nm处测定吸光值。桑叶样品中的多酚含量以没食子酸标准品计,结果表示为mg GAE/ g DW。
总黄酮含量采用亚硝酸钠-硝酸铝法测定:吸取 1.0 mL 桑叶提取液于 10 mL容量瓶中,加入 5% 亚硝酸钠 0.4 mL。摇匀,放置 6 min,加入 10% 硝酸铝 0.4 mL,摇匀,放置 6 min,加 4% NaOH 溶液 10.0 mL,加水定容,摇匀,放置 15 min,在 510 nm处测吸光值。桑叶样品中的总黄酮含量以芦丁标准品计,结果表示为mg RE/ g DW。
1.2.3 桑叶提取液体外抗氧化能力的测定1.2.3.1 DPPH清除能力[8]
将100 μL的DPPH甲醇溶液(0.065 mmol/L)与20 μL的样品溶液或空白溶液混溶在96孔板中,在室温下反应30 min,使用酶标仪在517nm下测定其吸光值。以不同浓度的Trolox溶液(50、100、200、300、400和500 μmol/L)及其相应的清除率绘制标准曲线,样品溶液的DPPH清除能力以Trolox为参考标准,结果表示为μmol TE/g DW。 清除DPPH自由基能力用如下公式计算:

其中:Ai为样品溶液加DPPH试剂混合液的吸光度,Aj为样品溶液加乙醇的吸光度,A0为DPPH溶液加样品溶剂的吸光度。
1.2.3.2 ABTS清除能力[9]
将5 mL7.4 mmol/L ABTS储备液与88 μL 2.6 mmol /L K2S2O8混匀,静置12~16h,配制成ABTS工作液。ABTS工作液用80%的乙醇稀释,使混合溶液在734nm处吸光值为0.7±0.1,然后于96孔板中分别加入200 uL ABTS溶液和20 uL样品溶液,震荡混合均匀6 min后,在734 nm波长下测定吸光值。以不同浓度的Trolox溶液(25、50、100、200、400和500 μmol/L)及其相应的清除率绘制标准曲线,样品溶液的ABTS清除能力以 Trolox为参考标准,结果表示为μmol TE/g DW。清除率计算公式如下:

其中:A0为ABTS溶液和样品溶剂混合液的吸光度,Ai为ABTS溶液和样品溶液混合液的吸光度,Aj为80%乙醇和样品溶液的吸光度。
1.2.3.3 铁离子还原能力(FRAP)[10]
在96孔酶标板的每孔中,依次加入10 μL不同浓度的抗坏血酸标准品溶液(200、300、400、600、800和1 000 μmol/L)和300 μL的ferric-TPTZ工作液,室温反应30 min后,于593 nm下用酶标仪测定其吸光度。桑叶提取液测定结果以抗坏血酸为参考标准,结果表示为μmol AAE/g DW。
1.2.4 统计分析
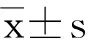
2 结果与分析
2.1 不同地区“农桑14号”的研究结果
从表1结果看出,不同产地 “农桑14号”桑叶多酚、黄酮含量及体外抗氧化活性呈现显著性差异,总酚、总黄酮含量在12.52~23.69 mg GAE/g DW和20.97~62.19 mg RE/g DW,清除DPPH、清除ABTS和 FRAP水平分别为 45.92~68.67 μmol TE/g DW、68.49~70.83 μmol TE/g DW 和 71.69~120.47 μmol AAE/g DW。其中江西永新的“农桑14号”桑叶总酚、总黄酮含量最高,而四川南桥的总酚含量最低,四川中安的总黄酮含量最低。江西三个地区桑叶体外抗氧化能力无显著差异,且普遍高于湖北武汉、四川南桥和四川中安。

表1 不同产地“农桑14号”桑叶多酚、黄酮含量及抗氧化活性比较
2.2 不同地区“强桑1号” 的研究结果
从表2可知,不同产地 “强桑1号”桑叶多酚、黄酮含量也呈现显著性差异。其中江西永新 “强桑1号”桑叶总酚、总黄酮含量最高,分别为20.27 mg GAE/g DW和 45.92 mg RE/g DW,江西修水桑叶的总酚、总黄酮含量最低,分别为15.59 mg GAE/g DW 和27.34 mg RE/g DW。四个地区中桑叶提取物DPPH清除能力最高的是江西永新(69.6μmol TE/g DW),最低的是江西修水(66.88μmol TE/g DW);清除ABTS能力水平无显著性差异; FRAP水平最高的是江西永新(120.74 μmol AAE/g DW),最低的是湖北武汉(100.76μmol AAE/g DW)。

表2 不同地区“强桑1号” 桑叶多酚、黄酮含量及抗氧化活性比较
3 讨论
不同产地“农桑14号”和“强桑1号”桑叶提取液总酚、总黄酮含量及其体外抗氧化能力呈显著差异性,表明地域对桑叶成分影响很大。由于试验所选择的几个地区气候、土壤或者栽培措施管理等条件不是完全一致的,因此引起不同地区桑叶在营养功能成分含量差异的原因还有待于进一步研究。
江西三个产地“农桑14号”和“强桑1号”桑叶的总酚、总黄酮含量由高到低呈相同趋势:永新>乐安>修水,且在这三个产地均是“农桑14号”含量高于“强桑1号”,说明在选择药食用桑叶原料时,需考虑不同品种的差异。
[1] 王芳,励建荣.桑叶的化学成分、生理功能及应用研究进展[J].食品科学,2005,26(增刊):111~116.
[2] 沈维治,廖森泰,邹宇晓,等.不同类型桑种质资源的桑叶总多酚及单体酚类物质含量测定[J].蚕业科学,2014,40(3):493~497.
[3] 杨燕,王洪庆,陈若芸.桑叶中的黄酮类化合物[J].药学学报,2010(1):77~81.
[4] 张如松,许静怡,叶益萍,等.产地对桑叶中黄酮类成分含量的影响[J].中国现代应用药学,2000,17(1):11~13.
[5] 游元元,万德光,杨文宇,等.HPLC 法比较不同产地桑叶药材品质差异[J].中国药房,2010,21(35):3314~3316.
[6] 冯颖,何俊,刘虹,等.不同产地桑叶中 6 种化学成分含量的液相色谱-质谱联用同时测定[J].时珍国医国药,2013,24 ( 3 ):572~574.
[7] 张亮亮,汪咏梅,徐曼,等.不同品种桑叶多酚和黄酮含量变化规律研究[J].时珍国医国药,2013,24(5):1064~1066.
[8] Li H, Deng Z, Liu R, et al. Carotenoid compositions of coloured tomato cultivars and contribution to antioxidant activities and protection against H2O2-induced cell death in H9c2 [J]. Food Chemistry ,2013, 136:878~888.
[9] 韩光亮,李翠梅,Eduardo Cacace,等.改良的ABTS+法及其在优化抗氧化活性物质提取中的应用[J].卫生研究,2004,33(5):620~622.
[10] Khanizadeh S, Tsao R, Rekika D, et al. Polyphenol composition and total antioxidant capacity of selected apple genotypes for processing [J]. Journal of Food Composition and Analysis, 2008, 21(5): 396~401.
江西省科技计划项目(编号:20151BBB60096)。
