对比2015版《中国药典》与《美国药典》中含量均匀度检测法
2017-05-10纪建勋
纪建勋
对比2015版《中国药典》与《美国药典》中含量均匀度检测法
纪建勋
目的 比较2015版《中国药典》0941章中和《美国药典》905章(2011修订版)中的含量均匀度检测法的宽松度。方法 在多个总体参数设置下通过随机模拟法分析国内外两种检测法的抽样特性曲线。结果 两个抽样特性曲线展现了两个检测法通过概率与总体标准差的关系,及两个检测法之间的相对严格度。结论 基于抽样特性曲线,现行的国内检测法与国外检测法宽松度近似。文章最后对如何展开进一步研究作了建议。
含量均匀度;中国药典;美国药典
1 资料与方法
1.1 背景
现实生产小分子药物通常采用混合法,混合一种或多种活性药物成分(active pharmaceutical ingredient)与赋形剂(excipient),不可能产出含量完全相同的单个制剂。而单个制剂中活性药物成分的含量与其临床药效及安全性有直接联系。因而,对单剂量含量均匀度(Uniformity of Dosage Unit,简写UDU)的检测是小分子药(即small molecule,non-biologics)批次放行检验中的一个重要部分。
含量均匀度具体是指单剂量的固体、半固体和非均相液体制剂含量符合标示量(label claim)的程度,因此通常测量数据单位为(%)。2015版《中国药典》(下文简写成ChP 2015)中的0941章[1]对如何进行含量均匀度检测进行了具体描述。国际上,《美国药典》(US Pharmacopeia,通常简写成USP)的905章(2011修正版)是通用的指导文件,且该章节内容已与欧洲药典和日本药典相关规定的协同(harmonization)。过去已有文章[2-8]选取某些角度对旧版的ChP和USP中含量均匀度检测法宽松度进行了比较。现根据新版国内外检测法的内容,通过完整描绘出两种检测法在多个总体均值设定下的抽样特性曲线(operational characteristic curve,下文简称OC曲线),讨论其统计特性,并直观的进行宽松度比较。
1.2 方法
1.2.1 含量均匀度(UDU)检测法 国内外药典中单剂量含量均匀度的检测法均是双阶段设计,方法表示如表1。注意,本文作如下符号约定:X表示随机单剂量含量均匀度,x表示某当计量含量均匀度的观测值,表示n个样本值的算数均值,表示n个样本值的标准差,即。另外,为突出重点简化细节,本文通篇假设含量均匀度是以标示量的%作计量,且假设测试药品的含量均匀度上下限的平均值(或目标均匀度)为100%。当目标含量均匀度过高或过低时,国内与国际法规均对表1中的检测法进行微调,调整主要在于公式里的M值设定或样本标准差的系数。由于国内外在此情况下的法规尚未统一,且实际生产中大多数药物均以100%标示量为目标均匀度,本文仅在最后小节进行讨论。
1.2.2 OC曲线—蒙特卡罗模拟法(Monte-Carlo simulation)在给定总体均值下,含量均匀度检测法的OC曲线描述了其通过概率与总体标准差间的关系,可以通过蒙特卡罗模拟法求出。本小节对此进行详尽解释。
将含量均匀度检测法看成是一个复杂的非随机模型,非随机意味着模型中的参数和条件限制均是给定的,该模型的投入量是30个随机样本值,输出量是合格或者不合格。由于投入量具有随机性,输出量也带有随机性。一般而言,如果非随机模型是简单的线性模型,输出量的随机分布可以根据模型公式和投入量的随机分布推导求出。但是国内国外的含量均匀度检测法均是双阶段的复杂判定模型,因而输出量的随机分布(即合格概率)无法轻易推导求出。Bergum[9]曾在大样本的渐进假设下求出近似的合格概率,求出的近似合格概率是真实合格率的置信下限,即比近似合格概率低。这种情况下,蒙特卡洛模拟法是最常用且最适宜的方法。
假设某批次的含量均匀度观测值服从正态分布,即X~N(μ,σ2),其中μ是总体均值,σ是总体标准差。通过蒙特卡罗随机模拟法,在给定总体均值和标准差的情况下,ChP和USP检测法的通过概率可以求得近似值。具体操作如下,在给定某总体均值和总体标准差后,从分布中随机生成30个样本值,当作30个供试品的含量均匀度观测值,然后依表1中的方法,分别判定ChP和USP检测法的结果。如此重复10 000次,每次重复可以得到两个检测法各自的判定结果(合格或者不合格),重复次数中两个检测法下各自累计的通过比例即是通过概率的近似值。由蒙特卡洛模拟法求取的通过概率也是近似值,但是并非由于任何近似假设,而是由于重复次数。重复次数越多,模拟得到的通过概率越接近近似值。由于现实中模拟肯定是基于有限次数,假设是K次,模拟求的通过概率存在误差近似,其中p是真实不可知的通过概率。由此可知,不论真实通过概率在0~1间取何值,p(1-p)≤0.25,这意味着10 000次重复可以将误差控制在0.002 5内。另外注意,虽然每次重复中总生成30个随机样本值,但如果依表1中方法判定不用进入阶段2,则舍弃30个随机值中的后20个。
依照这样的方法,ChP与USP检测法各自的OC曲线可以被完全描绘。一般而言,随着总体标准差增大,通过概率会非线性减小。在这样的设定下,如果两条OC曲线的其中一条靠左,即该曲线在每一个总体标准差设置下通过概率均比另一条曲线低,则代表该检测法更严苛。
1.2.3 参数设定 本文考虑如下总体参数设置:总体均值取95、98.5或100(单位%),总体标准差取值在0.2~10.0。当目标均匀度为100%时,总体均值95%在现实中已经属于比较极端的情况。另外选择总体均值在98.5%,是因为可以通过它观察总体均值在100%时OC曲线是如何变化到总体均值在95%时的OC曲线。注意到表1中描述的ChP和USP检测法均是关于100%对称,该对称性主要是由于M值的设定是关于100%对称以及判定公式中的绝对值运算,因此总体均值在101.5%和105.0%时的OC曲线将分别和总体均值在98.5%和95.0%时的OC曲线一致,鉴于篇幅考虑而省略给出当总体均值大于100%的OC曲线。
2 结果
图1~3分别显示了ChP和USP含量检测发在总体均值在95.0%、98.5%和100.0%时的OC曲线,其中ChP检测法为圆点线,USP检测法为十字点线。由此三图可见,在三种总体设置下,新版国内药典中含量均匀度检测法的OC曲线与USP检测法近乎重叠。数值上,两条OC曲线在三种总体设置下的差异无统计学意义(即绝对差异大于或等于两倍的模拟误差,模拟误差的最大值在1.2.2中推导为0.002 5)。因而可以认为两条OC曲线在三种总体设置下均近似相等。
另外,由图形显示,随着总体均值偏离100%,OC曲线向左偏移(看图3变化到图1),这意味着检测法变得严苛。直白的说,当总体均值为100%而总体标准差为6时,该批次通过国内外检测法的概率近乎100%,但是如果总体均值为95%而总体标注差为6时,通过概率仅略高于50%。这意味着,如果制造工艺能够确保批次总体均匀度靠近100%,那么国内外检测法能对工艺中和测量中不可以避免的变化差多一点包容性。而当总体均值由100.0%变化到98.5%时(即图3变化到图2),OC曲线几乎没有什么变化。这是主要是由于,如表1所示,M的取值在样本均值处于98.5%~101.5%时均与样本均值相等,因而判定公式中左侧的绝对值等于0。换言之,判定公式仅对样本均值偏离98.5%~101.5%时进行惩戒。
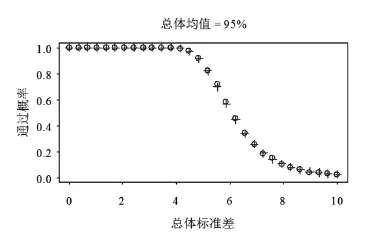
图1 ChP(圆点线)和USP(十字点线)含量均匀度检测法(表1)当总体均值在95%时的OC曲线
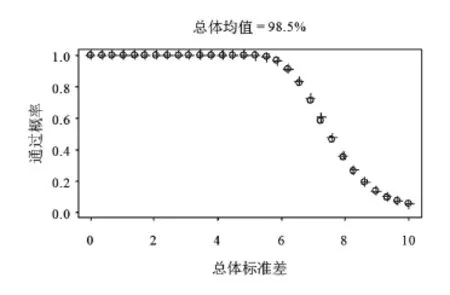
图2 ChP(圆点线)和USP(十字点线)含量均匀度检测法(表1)当总体均值在98.5%时的OC曲线

表1 国内外药典中的单剂量含量均匀度检测法
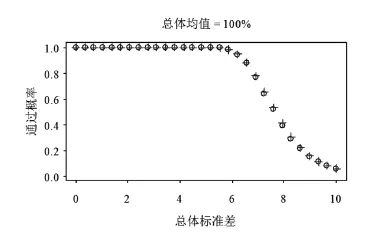
图3 ChP(圆点线)和USP(十字点线)含量均匀度检测法(表1)当总体均值在100%时的OC曲线
3 讨论
陶巧凤等[2-4]也通过OC曲线对旧版国内的含量均匀度和USP检测法进行比对,均发现旧版国内检测法虽然工作量和USP检测法相当,但严格程度略微宽松。然而,根据小节2中的结果,由于2015版《中国药典》中0941章对含量均匀度方法进行了修改,现行的检测法与国际上通用的USP<905>(2011修订版)的检测法具有近似相等的OC曲线,即宽松度一致。鉴于篇幅和侧重点,本文仅考虑了目标均匀度为100%的情况,2015版《中国药典》中特别指出,当目标均匀度(T)大于100%时,表1中M的取值不再固定于100%,而是根据样本均值而取值[1],因而检测法不再关于总体均匀度100%对称。值得一提的时,USP检测法在T> 101.5%时也有类似规定。所以现结论不能笼统的成立,但分析方法是共通的,且选择的总体设置在现实运用中最具代表性。后续有兴趣的学者还可以运用同样的分析方法比较两种检测法在总体分布非正态时的稳定性(robustness)。
另外值得一提的是,FDA在2013年以无统计外推性(过于宽松)为由,撤回《混粉及制剂单位——制剂单位过程中分层取样与评估》(Powder Blends and Finished Dosage Units-Stratified In-Process Dosage Unit Sampling and Assessment)指南草案。该指南草案中推荐的正是USP检测法。这样的检测法被认定不是一个统计学取样方案,因而其结果不能外推到更大的总体。FDA不再支持意味着各公司需要针对含量均匀对制定具有统计学约束性更严苛的药品放行检验法。研究新的检测法并通过比对OC曲线正是近年来的新课题。
[1] 国家药典委员会.中华人民共和国药典2015年版(第四部)[M].北京: 中国医药科技出版社,2015: 124-125.
[2] 陶巧凤. 含量均匀度检查方法的比较与评价[J]. 中国药品标准,2005,6(4): 32-34.
[3] 陶巧凤. 美国药典29版与中国药典含量均匀度检查方法的比较分析[J]. 中国药品标准,2006,7(5): 75-77.
[4] 徐万魁,毕开顺,王玺. 《中华人民共和国药典》与美、英、日3国《药典》含量均匀度检查法的比较[J]. 沈阳药科大学学报,2008(11),901-903.
[5] 姜雄平. 含量均匀度计量法检查的统计学依据与多国药典方案比较[J]. 中国药品标准,2010,11(2): 89-94.
[6] 王玺,钟大放,罗旭, 等. 日本药典Ⅹ Ⅲ 版含量均匀度检查法的统计特性分析[J]. 沈阳药科大学学报,1999,16(1): 40-43.
[7] 徐万魁. 中、美、日含量均匀度检查方法的比较与新方案初探[D].沈阳: 沈阳药科大学硕士学位论文,2008.
[8] 韩鹏,王玉,李涛,等. 一个含量均匀度检查的新方案[J]. 中国药品标准,2013,14(5): 333-337.
[9] Bergum JS, Li H. Acceptance Limits for the New ICH USP 29 Content Uniformity Test[J]. Pharm Technol,2007,10(2): 90-100.
Comparison of Content Uniformity Test in Chinese Pharmacopeia (2015 Edition) and US Pharmacopeia
JI Jianxun Pharmacology Department, The First Affiliated Hospital of Xiamen University, Xiamen Fujian 361003, China
Objective This paper aims at comparing the strictness of the content uniformity test in Chinese and US pharmacopeia. Methods Monto carlo simulation approach is deployed to generate the operational characteristic (OC) curves of the content uniformity test under domestic and international regulation respectively. Results The two OC curves demonstrate the relationship between the passing probability and population standard deviation for the two content uniformity regulations. Conclusion Based on the two OC curves, the current domestic regulation is approximately as strict or as loose as the international regulation. At the end of the paper, some directions for further researches are suggested.
content uniformity; Chinese pharmacopeia; US pharmacopeia
R97
A
1674-9316(2017)08-0065-03
10.3969/j.issn.1674-9316.2017.08.038
厦门大学附属第一医院药学部,福建 厦门 361003
纪建勋
