微波辅助提取茶籽多糖的工艺优化及其体外抗氧化活性评价
2017-05-10张智敏夏伯候周万猛廖燕林江豪杰林丽美李亚梅
张智敏,夏伯候,周万猛,廖燕林,彭 粲,江豪杰,林丽美,罗 堃,李亚梅
(1.湖南中医药大学 药学院,长沙 410208; 2.湖南金昌生物技术有限公司,湖南 衡阳 421300)
微波辅助提取茶籽多糖的工艺优化及其体外抗氧化活性评价
张智敏1,夏伯候1,周万猛2,廖燕林1,彭 粲1,江豪杰1,林丽美1,罗 堃1,李亚梅1
(1.湖南中医药大学 药学院,长沙 410208; 2.湖南金昌生物技术有限公司,湖南 衡阳 421300)
采用微波辅助提取油茶籽粕中的茶籽多糖。在单因素实验的基础上,利用正交实验优化茶籽多糖提取条件。并对茶籽多糖的体外抗氧化活性进行了研究。结果表明,茶籽多糖最佳提取工艺条件为:微波功率800 W,微波时间6.5 min,料液比1∶60,提取时间2 h,提取温度100℃。在最佳工艺条件下,茶籽多糖得率为(7.61±0.5)%。茶籽多糖对羟自由基、DPPH自由基和亚硝酸盐都呈现出一定的清除能力,但清除超氧阴离子自由基能力和还原能力较弱。
茶籽多糖;微波辅助提取;抗氧化活性
油茶属山茶科植物,是我国特有的木本食用油料树种。然而,我国油茶籽利用率不高,油茶籽榨油后的油茶籽饼粕中含有大量的蛋白质、茶皂素、粗纤维、多糖等,如能充分利用,必将产生巨大的经济效益和社会效益。茶籽多糖是油茶籽中一种重要的生物大分子,具有抗血栓、降血糖、抑制UK562(人体白血病细胞)增长,促进淋巴细胞增殖的作用,此外还可能有修复糖代谢紊乱的功能[1]。国内外对茶籽多糖的理化性质、分离纯化方法和生理活性的研究报道较为全面。
茶籽多糖的提取方法主要有水提法[2]、酸碱提取法[3]、有机溶剂提取法[4]、超临界CO2萃取法[5]、酶法[6]、超声波辅助提取法[7]和微波辅助提取法[8]。陈桂冰等[9]以油茶籽粕为原料,提取条件为料液比1∶10、提取温度70℃、提取时间3 h,茶籽多糖得率为30.31%,是已有的研究成果中得率较高的。研究[10]表明,茶籽多糖热稳定性差,高温、过酸或偏碱的条件均会使其部分降解。而微波的热效应可以穿透到介质内部,迅速破坏细胞壁,使提取物快速分离出来[11]。因此,本课题采取微波辅助法提取茶籽多糖,以期提高油茶籽的利用率,推动油茶产业的发展。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
油茶籽粕:湖南金昌生物技术有限公司提供。
考马斯亮蓝G250(进口分装)、牛血清白蛋白,国药集团化学试剂有限公司;无水乙醇、浓硫酸、浓盐酸、苯酚、丙酮、石油醚、抗坏血酸、邻二氮菲、硫酸亚铁、过氧化氢、DPPH、铁氰化钾、三氯乙酸、三氯化铁、Tris、邻苯三酚、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、磷酸氢二钠、磷酸二氢钠、咔唑、磷酸、盐酸羟胺等,均为分析纯。
1.1.2 仪器与设备
CP114电子天平,美国奥豪斯;G80F23DC微波炉,格兰仕;STARTER3 pH计,美国奥豪斯;UV-1800紫外可见分光光度计,日本岛津;is5傅里叶变换红外光谱仪,美国热电;721721分光光度计,上海舜宇。
1.2 实验方法
1.2.1 茶籽多糖的提取
将油茶籽粕粉碎过40目筛后,准确称取油茶籽粕粉末2 g,加95%乙醇80℃回流至冷凝管的下端滴出的乙醇不含油脂,除去单糖、低聚糖及脂类等醇溶性物质,趁热抽滤。滤渣烘干后加入一定体积的蒸馏水,静置润湿0.5 h。在固定微波功率下处理一定时间后,回流提取一定时间,提取2次,合并提取液。将提取液减压浓缩至原来的1/3,用Sevage法[12]脱蛋白质,离心(3 000 r/min,15 min)取上清液,向上清液中加入无水乙醇调至70%乙醇,4℃静置24 h,离心(4 800 r/min,15 min),沉淀物依次用无水乙醇、丙酮、石油醚反复洗涤3次,于40℃下干燥得茶籽多糖。
1.2.2 多糖得率的测定
采用苯酚-硫酸法[9],以葡萄糖为参照,在490 nm 处测定吸光度,并代入下式计算多糖得率。

1.2.3 茶籽多糖的体外抗氧化活性及清除亚硝酸盐能力测定
采用周晓薇等[13]的方法,以VC为阳性对照,在536 nm下测定清除羟自由基能力;采用Williams等[14]的方法,以VC为阳性对照,在517 nm下测定清除DPPH自由基能力;采用文献[15]的方法,以VC为阳性对照,在700 nm下测定还原能力;采用文献[16]的方法,以VC作为阳性对照,在325 nm下测定清除超氧阴离子自由基能力;采用文献[17]的方法,以NaNO2为标准,在538 nm下测定清除亚硝酸盐能力。
1.2.4 光谱性质分析
紫外扫描分析:将样品配成质量浓度为0.1 mg/mL 的溶液,采用紫外-可见分光光度计在190~400 nm范围内进行光谱扫描分析[18]。
红外扫描分析:取干燥样品1 mg,采用美国热电is5傅里叶变换红外光谱仪在400~4 000 cm-1进行红外光谱扫描分析[19]。
2 结果与分析
2.1 单因素实验
微波功率、微波时间、料液比、提取时间、提取温度对茶籽多糖得率的影响分别如图1~图5所示。
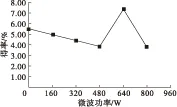
注:料液比1∶40,微波时间5 min,提取温度80℃,提取时间1.5 h。
图1 微波功率对茶籽多糖得率的影响
注:料液比1∶40,微波功率320 W,提取温度80℃,提取时间1.5 h。
图2 微波时间对茶籽多糖得率的影响

注:微波功率320 W,微波时间5 min,提取温度80℃,提取时间1.5 h。
图3 料液比对茶籽多糖得率的影响

注:料液比1∶40,微波功率320 W,微波时间5 min,提取温度80℃。
图4 提取时间对茶籽多糖得率的影响

注:料液比1∶40,微波功率320 W,微波时间5 min,提取时间1.5 h。
图5 提取温度对茶籽多糖得率的影响
由图1可知,当微波功率低于480 W时,茶籽多糖得率随着微波功率的升高而缓慢下降;当微波功率为640 W时,茶籽多糖得率突然增至高峰。综合考虑能耗及经济效益,选择微波功率为640 W左右为宜。
由图2可知,微波时间对茶籽多糖得率的影响较小,当微波时间超过6.5 min时,茶籽多糖得率稍有下降。因此,选择微波时间为6.5 min左右为宜。
由图3可知,当料液比低于1∶60时,茶籽多糖得率随着料液比的升高而增加;当料液比高于1∶60时多糖得率开始降低。因此,选择料液比为1∶60左右为宜。
由图4可知,提取时间在1.5 h时,茶籽多糖得率显著高于其他提取时间的。因此,选择提取时间为1.5 h左右为宜。
由图5可知,前期茶籽多糖得率受提取温度影响较小,在80℃后提取温度对茶籽多糖得率的影响较大,茶籽多糖得率随提取温度的升高快速升高。这是由于细胞壁在热水中更易被破坏,从而使更多的水溶多糖从中萃取出来。Klaus等[20]从裂褶菌中提取水溶性多糖,也得到相似的结论。因此,选择提取温度为90℃左右为宜。
2.2 正交实验
根据单因素实验结果,固定微波时间为 6.5 min,选取微波功率(A)、料液比(B)、提取时间(C)和提取温度(D)为因素,以茶籽多糖得率为指标进行正交实验优化,确定茶籽多糖提取的最佳工艺条件。正交实验设计及结果见表1。

表1 正交实验设计及结果
由表1可知,各因素对茶籽多糖得率的影响大小为D(提取温度)>B(料液比)>A(微波功率)>C(提取时间),其中提取温度对茶籽多糖得率的影响最大,料液比及微波功率次之,而提取时间对茶籽多糖得率影响较小。茶籽多糖最佳提取工艺组合为A3B2C3D3,即微波功率800 W,料液比1∶60,提取时间2 h,提取温度100℃。
按最佳工艺条件设计3组平行实验进行验证,得到茶籽多糖的平均得率为(7.61±0.5)%,高于正交实验表中各实验的结果。
2.3 茶籽多糖的体外抗氧化活性
2.3.1 清除羟自由基能力(见图6)
羟自由基在活性氧自由基中的活性最强。它能诱导周围的核酸、蛋白质、不饱和脂肪酸等生物大分子产生严重损伤,从而引发癌症、衰老等疾病。由图6可知,羟自由基的清除效果与茶籽多糖质量浓度呈现量效关系。当茶籽多糖质量浓度为5 mg/mL时,羟自由基的清除率达到23.23%。但与VC相比,其羟自由基清除能力很弱。

图6 茶籽多糖对羟自由基的清除能力
2.3.2 清除DPPH自由基能力(见图7)

图7 茶籽多糖对DPPH自由基的清除能力
DPPH是一种合成的较为稳定的自由基。由图7可知,随着茶籽多糖质量浓度的增加,其对DPPH自由基清除能力增强。当茶籽多糖质量浓度为1.6 mg/mL时,DPPH自由基的清除率达到72.09%。但与VC相比,其DPPH自由基清除能力较弱。
2.3.3 还原能力(见图8)
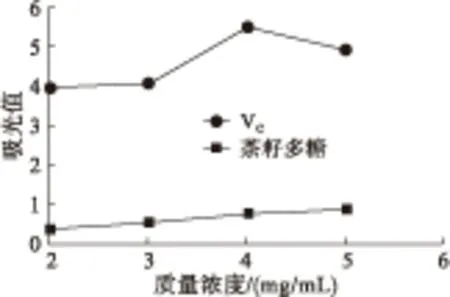
图8 茶籽多糖的还原能力
由图8可知,随着茶籽多糖质量浓度的增加,其还原能力无明显变化。当VC质量浓度为2 mg/mL时,其吸光值为3.99,而茶籽多糖质量浓度为5 mg/mL时,吸光值仅为0.854。这说明茶籽多糖几乎没有还原能力。
2.3.4 清除超氧阴离子自由基能力(见图9)
由图9可知,随着茶籽多糖质量浓度的增加,超氧阴离子自由基的清除能力稍有增强。当茶籽多糖质量浓度为5 mg/mL时,超氧阴离子自由基清除率仅为32.80%。由此可见,茶籽多糖对超氧阴离子自由基的清除能力较弱。
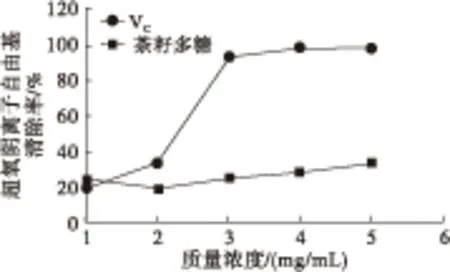
图9 茶籽多糖对超氧阴离子自由基的清除能力
2.4 清除亚硝酸盐能力(见图10)
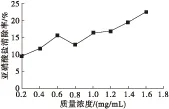
图10 茶籽多糖对亚硝酸盐的清除能力
由图10可知,茶籽多糖对亚硝酸盐有较好的清除能力,其清除效果与茶籽多糖的剂量呈正相关性,呈现出良好的量效关系。当茶籽多糖质量浓度达到1.6 mg/mL时,亚硝酸盐的清除率为22.76%。
2.5 紫外扫描分析(见图11)
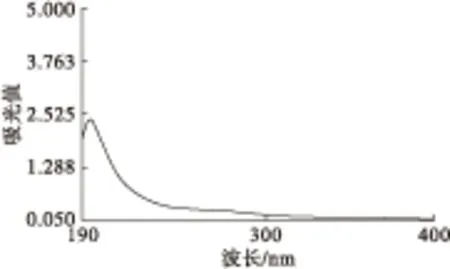
图11 紫外扫描图谱
由图11可知,茶籽多糖在190~200 nm间具有多糖的特征吸收峰[21],在260 nm波长处均没有吸收峰,说明不含核酸成分;在280 nm波长处均略有吸收,说明其中含有蛋白质,这是因为Sevage法虽然对蛋白质的清除率较高,但蛋白质与多糖常形成糖蛋白复合物,使蛋白质的清除较为困难。
2.6 红外扫描分析(见图12)

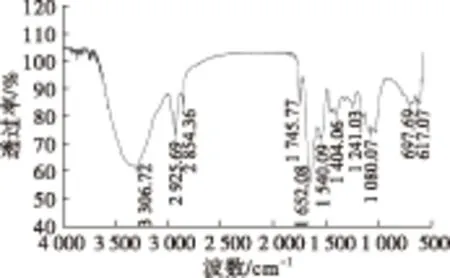
图12 红外扫描图谱
3 结 论
采用微波辅助提取茶籽多糖,经单因素实验及正交实验优化得到茶籽多糖的提取工艺条件为:微波功率800 W,微波时间6.5 min,料液比1∶60,提取时间2 h,提取温度100℃。在优化工艺条件下,茶籽多糖的平均得率为(7.61±0.5)%。
茶籽多糖对羟基自由基、DPPH自由基和亚硝酸盐都呈现出一定的清除能力,但清除超氧阴离子自由基能力和还原能力较弱。
紫外扫描结果表明:茶籽多糖在260 nm处均没有吸收峰,说明多糖中不含核酸成分;在280 nm处都略有吸收,说明其含有少量蛋白质。红外扫描结果表明:根据特征吸收峰可以初步判定为多糖,且含有蛋白质和糖醛酸。
本研究仅从体外化学实验法的角度考察了茶籽多糖对自由基的清除活性,未开展动物活体实验,因此大量纯化富集茶籽多糖,并结合多糖构效关系以及动物活体实验,全面充分验证茶籽多糖的抗氧化生理活性宜作为今后研究方向之一。
[1] WEI X L,MAO F F,CAI X,et al. Composition and bioactivity of polysaccharides from tea seeds obtained by water extraction[J]. Int J Biol Macromol,2011,49(4):587-590.
[2] 卢金珍,孙金龙,任俊,等. 绿茶茶多糖提取工艺优化研究[J]. 现代农业科技,2012,28(7):335-336,339.
[3] 陈小强,周瑛,叶阳,等. 碱溶性茶多糖的提取及其分析[J]. 应用化学,2008(12):1496-1498.
[4] 谢爱泽,邹登峰,章艳,等. 丙酮沉淀法提取金花茶多糖的研究[J]. 安徽农业科学,2011(25):15268-15269.
[5] 陈明,熊琳媛,袁城. 茶叶中多糖提取技术进展及超临界萃取探讨[J]. 安徽农业科学,2011(8):4770-4771.
[6] 李星科,彭星星,李素云,等. 酶法提取信阳红茶多糖的工艺研究[J]. 食品工业科技,2012,33(20):168-170,175.
[7] 许子竞,廖敏富,陈海燕,等. 金花茶叶多糖超声波辅助提取工艺优化和含量测定[J]. 食品科学,2010,31(4):53-58.
[8] 陈义勇,窦祥龙,黄友如,等. 响应面法优化超声-微波同辅助提取茶多糖工艺[J]. 食品科学,2012,33(4):100-103.
[9] 陈桂冰,孙培冬,季晓彤,等. 茶籽多糖的提取及脱蛋白工艺研究[J]. 中国油脂,2016,41(8):74-77.
[10] 崔宏春,余继忠,黄海涛,等. 茶多糖的提取及分离纯化研究进展[J]. 茶叶,2011,37(2):67-71.
[11] 吴世荣. 黄酮类化合物的提取分离及定量构效关系研究[D]. 重庆:重庆大学,2005.
[12] 张丽美. 茶粕多糖提纯工艺、结构初探及体外抗氧化研究[D]. 南昌:南昌大学,2013.
[13] 周晓薇,王静,段浩,等. 铁棍山药蛋白质的分离纯化及体外抗氧化活性[J]. 食品科学,2011,32(9):31-35.
[14] WILLIAMS W B,CUVELIER M E,BERSER C. Use of a free radical method to evaluate antioxidant activity[J]. Lebensmittel Wissenseaft Technol,1995,28(1):25-30.
[15] LI X M,LI X L,ZHOU A G. Evaluation of antioxidant activity of the polysaccharides extracted fromLyciumbarbarumfruits in vitro[J]. Eur Polym J,2007,43(2):488-497.
[16] GE Y,DUAN Y F,FANG G Z,et al. Polysaccharides from fruit calyx ofPhysalisalkekengivar. francheti:isolation,purification,structural features and antioxidant activities[J]. Carbohydr Polym,2009,77:188-193.
[17] 李粉玲,蔡汉权,陈利生. 金丝草多糖的抗氧化性及还原能力的研究[J]. 有机化学研究,2015,3(1):16-24.
[18] ZHAO M M,YANG N,YANG B,et al. Structural characterization of water-soluble polysaccharides fromOpuntiamonacanthacladodes in relation to their anti-glycated activities[J]. Food Chem,2007,105:1480-1486.
[19] PARIKH A,MADAMWAR D. Partial characterization of extracellular polysaccharide from cyanobacteria[J]. Bioresour Technol,2006,97:1822-1827.
[20] KLAUS A,KOZARSKI M,JAKOVIJEVIC D,et al. Antio-xidant activities and chemical characterization of polysaccharides extracted from the basidiomycete Schizophyllum commume[J]. LWT-Food Sci Technol,2011,44:2005-2011.
[21] 陶俊. 油茶籽多糖分离纯化及降脂机理的研究[D]. 合肥:安徽农业大学,2010.
Microwave-assisted extraction and antioxidant activity in vitro of oil-tea camellia seed polysaccharides
ZHANG Zhimin1, XIA Bohou1, ZHOU Wanmeng2, LIAO Yanlin1, PENG Can1, JIANG Haojie1, LIN Limei1, LUO Kun1, LI Yamei1
(1. College of Medicine, Hunan University of Chinese Medicine, Changsha 410208, China; 2. Hunan Jinchang Biotechnology Co., Ltd., Hengyang 421300, Hunan, China)
The microwave-assisted technology was applied to extract polysaccharides from oil-tea camellia seed meal.According to single factor experiment, the extraction conditions of oil-tea camellia seed polysaccharides were optimized by orthogonal experiment. And the in vitro antioxidant activity of oil-tea camellia seed polysaccharides was studied. The results showed that the optimal extraction conditions of oil-tea camellia seed polysaccharides were obtained as follows:microwave power 800 W, microwave time 6.5 min, ratio of material to liquid 1∶60, extraction time 2 h, extraction temperature 100℃. Under these conditions, the yield of oil-tea camellia seed polysaccharides was (7.61±0.5)%. The oil-tea camellia seed polysaccharides had certain scavenging activity on hydroxyl free radical, DPPH free radical and nitrites, nevertheless, its scavenging ability on superoxide anion free radical and reducing ability were weak.
oil-tea camellia seed polysaccharides; microwave-assisted extraction; antioxidant activity
2016-06-29;
2016-11-25
湖南中医药大学中药技能大学生创新训练中心创新性实验计划项目(201502);湖南省教育厅科学研究项目(16C1223);湖南中医药大学校级青年教师科研基金项目(99820001-194)
张智敏(1986),女,助理实验师,硕士,主要从事油茶籽综合开发利用研究工作(E-mail)cslgdxzzm@163.com。
夏伯候,讲师,博士(E-mail)xiabohou@163.com。
TS229;R151
A
1003-7969(2017)04-0131-05
