老年脑梗死患者外周血调节性T细胞水平及其与缺血性脑损伤和颈动脉粥样硬化严重程度的相关性
2017-05-10戴贤勇
戴贤勇
(临海市第二人民医院神经内科,浙江 临海 317016)
老年脑梗死患者外周血调节性T细胞水平及其与缺血性脑损伤和颈动脉粥样硬化严重程度的相关性
戴贤勇
(临海市第二人民医院神经内科,浙江 临海 317016)
目的 探讨老年动脉粥样硬化性脑梗死患者外周血调节性T细胞水平及其与缺血性脑损伤和颈动脉粥样硬化严重程度的相关性。方法 选择老年动脉粥样硬化性脑梗死患者120例作为梗死组和同期体检的老年健康者120例作为对照组,梗死组根据梗死时间分为梗死组1 d、梗死组3 d、梗死组7 d;根据神经功能缺损程度分为轻度组、中度组和重度组;根据梗死灶大小分为小梗死灶组、中梗死灶组、大梗死灶组;根据颈动脉粥样硬化程度分为颈动脉内膜增厚组、颈动脉斑块组、颈动脉狭窄组。测定患者外周血CD4+CD25+调节性T细胞百分比和白细胞、中性粒细胞含量。结果 梗死组外周血调节性T细胞水平明显低于对照组(P<0.05)。梗死组1 d外周血调节性T细胞水平明显低于对照组(P<0.05),梗死组3 d与对照组比较无差异(P>0.05),梗死组7 d明显高于对照组(P<0.05);梗死组1 d白细胞和中性粒细胞高于对照组(P<0.05),梗死组3 d白细胞高于对照组(P<0.05),梗死组3 d中性粒细胞和对照组比较无差异(P>0.05),梗死组7 d白细胞和中性粒细胞和对照组比较无差异(P>0.05)。重度组外周血调节性T细胞水平低于轻度组和中度组(P<0.05),中度组外周血调节性T细胞水平低于轻度组(P<0.05)。大梗死灶组外周血调节性T细胞水平高于小梗死灶组和中梗死灶组(P<0.05),中梗死灶组外周血调节性T细胞水平低于小梗死灶组(P<0.05)。颈动脉狭窄组外周血调节性T细胞水平低于颈动脉内膜增厚组和颈动脉斑块组(P<0.05),颈动脉斑块组外周血调节性T细胞水平低于颈动脉内膜增厚组(P<0.05)。结论 老年动脉粥样硬化性脑梗死患者外周血调节性T细胞水平降低,外周血调节性T细胞水平与缺血性脑损伤和颈动脉粥样硬化严重程度关系密切。
动脉粥样硬化;脑梗死;调节性T细胞
动脉粥样硬化本身和动脉粥样硬化性脑梗死都存在炎症反应,过度的局部炎症反应比缺血对脑组织的损伤更严重〔1,2〕。CD4+CD25+调节性T细胞是一种免疫调节性T细胞〔3,4〕,对动脉粥样硬化、动脉粥样硬化性脑梗死的免疫损伤有对抗作用〔5,6〕,不少研究发现其与缺血性脑卒中的关系比较密切〔7〕,本文对老年动脉粥样硬化性脑梗死患者外周血CD4+CD25+调节性T细胞水平及其与缺血性脑损伤和颈动脉粥样硬化严重程度的关系进行研究。
1 对象与方法
1.1 研究对象 选择浙江省临海市第二人民医院2011年1月至2014年12月神经内科住院的70岁以上老年动脉粥样硬化性脑梗死患者120例作为梗死组和同期在院体检的健康老年者120例作为对照组。梗死组年龄(74.35±3.21)岁,男72例,女48例;对照组年龄(75.12±3.07)岁,男65例,女55例,两组年龄和性别比较差异无统计学意义(P>0.05),具有可比性。梗死组根据梗死时间分为梗死组1 d、梗死组3 d、梗死组7 d;根据神经功能缺损程度分为轻度组、中度组和重度组;根据梗死灶大小分为小梗死灶组、中梗死灶组、大梗死灶组;根据颈动脉粥样硬化程度分为颈动脉内膜增厚组、颈动脉斑块组、颈动脉狭窄组。本研究经浙江省临海市第二人民医院伦理委员会审批,患者签署知情同意书。排除标准:年龄<70岁者,3个月内有脑出血、心源性脑栓塞、血管闭塞性疾病、急性心肌梗死史者,3个月内有肿瘤、炎症、输血、手术等影响外周血调节性T细胞水平者,患全身活动性感染者,患自身免疫性疾病者,患血液系统疾病者,患其他系统疾病者,患严重肝肾功能异常者,拒绝参与实验者。
1.2 神经功能缺损评分 采用美国国立卫生研究院脑卒中量表对脑梗死患者进行神经功能缺失评分,轻度神经缺损者评分0~15分,中度神经缺损者评分16~30分,重度神经功能缺损者31~45分。
1.3 梗死大小测量 梗死灶体积计算根据Pullicino公式计算,小梗死灶组为梗死灶体积<5 cm3,中梗死灶组为梗死灶体积为5~10 cm3,大梗死灶组为梗死灶体积为>10 cm3。
1.4 颈动脉粥样硬化程度测量 采用彩色多普勒超声仪测量各患者的颈动脉粥样硬化情况。正常颈动脉者颈动脉内中膜厚度<1.0 mm;颈内动脉增厚:1.0 mm≤颈动脉内中膜厚度<1.5 mm;颈动脉狭窄:颈动脉内中膜厚度≥1.5 mm。
1.5 血液标本采集 梗死组采集入院第2天外周血、对照组采集体检当天外周血,梗死组另收集梗死3 d、梗死7 d外周血(其中入院第2天外周血作为梗死1 d)进行血液化验。
1.6 外周血CD4+CD25+调节性T细胞百分比和白细胞、中性粒细胞测定 采用流式细胞仪测定外周血CD4+CD25+调节性T细胞百分比,白细胞和中性粒细胞送化验室化验。
1.7 统计学方法 采用SPSS20.0软件进行t及χ2检验,多组均数比较采用方差分析,组内两两比较采用LSD检验。
2 结 果
2.1 梗死组和对照组外周血调节性T细胞水平比较 梗死组外周血调节性T细胞水平低于对照组〔(8.53±1.13)% vs (11.47±1.06)%,t=6.475,P=0.000〕。
2.2 梗死组不同梗死时间外周血调节性T细胞水平比较 梗死组1 d外周血调节性T细胞水平低于对照组(P<0.05),梗死组3 d外周血调节性T细胞水平和对照组比较无差异(P>0.05),梗死组7 d外周血调节性T细胞高于对照组(P>0.05);梗死组1 d白细胞和中性粒细胞高于对照组(P<0.05),梗死组3 d白细胞高于对照组(P<0.05),梗死组3 d中性粒细胞和对照组比较差异无统计学意义(P>0.05),梗死组7 d白细胞和中性粒细胞和对照组比较差异无统计学意义(P>0.05)。见表1。
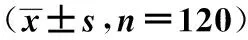
表1 梗死组不同梗死时间外周血调节性 T细胞水平比较
与对照组比较:1)P<0.05
2.3 不同程度神经缺损脑梗死患者外周血调节性T细胞水平比较 轻度组〔(10.41±0.92)%〕、中度组〔(8.67±0.85)%〕、重度组〔(7.05±0.83)%〕外周血调节性T细胞水平比较差异显著(P<0.05),重度组外周血调节性T细胞水平低于轻度组和中度组(P<0.05),中度组外周血调节性T细胞水平低于轻度组(P<0.05)。
2.4 不同梗死灶脑梗死患者外周血调节性T细胞水平比较 小梗死灶组〔(10.47±1.21)%〕、中梗死灶组〔(8.76±1.08)%〕、大梗死灶组〔(7.01±0.95)%〕脑梗死患者外周血调节性T细胞水平比较差异显著(P<0.05),其中大梗死灶组高于小梗死灶组和中梗死灶组(P<0.05),中梗死灶组低于小梗死灶组(P<0.05)。
2.5 不同颈动脉粥样硬化程度脑梗死患者外周血调节性T细胞水平比较 颈动脉内膜增厚组〔(10.32±1.02)%〕、颈动脉斑块组〔(8.37±0.94)%〕、颈动脉狭窄组〔(6.52±1.14)%〕外周血调节性T细胞水平比较差异显著(P<0.05),其中颈动脉狭窄组低于颈动脉内膜增厚组和颈动脉斑块组(P<0.05),颈动脉斑块组低于颈动脉内膜增厚组(P<0.05)。
3 讨 论
因动脉粥样硬化和动脉粥样硬化性脑梗死都存在炎症免疫反应,过度的炎症反应对脑组织的损伤也比较严重〔8〕,因此抑制动脉粥样硬化性脑梗死过度表达的炎症反应,调节免疫调节性T细胞核致病性T细胞的动态平衡具有重要意义。外周血CD4+CD25+调节性T细胞是评价血管内皮功能的指标,血管内皮功能常用的检测方法有内皮细胞分泌物测定、血管内超声检查、冠状动脉造影检查等,但因上述检查不能重复使用、有一定创伤性、比较复杂、价格昂贵,使其在临床中的应用受到限制。CD4+CD25+调节性T细胞检测血管内皮功能具有一定优势:外周血CD4+CD25+调节性T细胞对内皮细胞的炎性分泌和抗原提呈功能有抑制作用,对外周血内皮祖细胞的黏附、迁移和增殖能力有促进作用,因此可以调节受到损失的内皮细胞的功能,在血管内皮功能变化的早期CD4+CD25+调节性T细胞水平已发生变化,能够比较早的提示血管病变的发生风险;CD4+CD25+调节性T细胞可以多次检测、价格低廉、没有创伤性,在评估动脉粥样硬化方面也具有一定价值〔9,10〕。
外周血CD4+CD25+调节性T细胞水平和心肌梗死的关系被不少学者研究,发现急性心肌梗死患者外周血CD4+CD25+调节性T细胞水平下降〔11~15〕,外周血调节性T细胞水平和缺血性脑卒中的关系也越来越受关注〔16,17〕。本研究显示老年动脉粥样硬化性脑梗死患者外周血调节性T细胞水平降低,且与缺血性脑损伤和颈动脉粥样硬化严重程度关系密切。老年动脉粥样硬化性脑梗死患者,白细胞和中性粒细胞随着梗死时间的延长不断下降至正常,考虑急性脑梗死患者脑梗死后出现局部炎症免疫反应,早期炎症反应主要为促炎反应,使外周致病性细胞被动员致病性细胞通过血脑屏障进入缺血性炎性反应区域,因此外周血调节性T细胞水平降低,随着梗死时间的延长,机体诱导外周血调节性T细胞水平大量产生,抑制促炎因子的表达,抑制过度的炎症反应,调节免疫平衡,因此外周血调节性T细胞水平高于正常对照组。神经功能缺损和脑梗死灶大小都反映脑梗死的严重程度,神经功能缺损越严重、脑梗死灶越大,患者外周血调节性T细胞水平越低,表明外周血调节性T细胞水平和动脉粥样硬化性脑梗死的严重程度关系密切,可以反映动脉粥样硬化脑梗死的严重程度。外周血调节性T细胞水平和动脉粥样硬化严重程度关系也比较密切,随着动脉粥样硬化严重程度的增加外周血调节性T细胞水平降低。
1 Li Q,Wang Y,Yu F,etal.Peripheral Th17/Treg imbalance in patients with atherosclerotic cerebral infarction〔J〕.Int J Clin Exp Pathol,2013;6(6):1015-27.
2 张 梅,田 英,刘翠萍,等.脑梗死与炎症反应关系研究进展〔J〕.现代中西医结合杂志,2011;20(15):1946-8.
3 Pircher A,Gamerith G,Amann A,etal.Neoadjuvant chemo-immunotherapy modifies CD4(+)CD25(+) regulatory T cells (Treg) in non-small cell lung cancer (NSCLC) patients〔J〕.Lung Cancer,2014;85(1):81-7.
4 Ding KY,Ji WC,Wu JS,etal.Higher frequency of CD4(+)CD25(high) Treg cells in hemophilia patients with factor Ⅷ inhibitor〔J〕.Genet Mol Res,2014;13(1):1774-81.
5 Weirather J,Hofmann UD,Beyersdorf N,etal.Foxp3+ CD4+ T cells improve healing after myocardial infarction by modulating monocyte/macrophage differentiation〔J〕.Circ Res,2014;115(1):55-67.
6 Wigren M,Björkbacka H,Andersson L,etal.Low levels of circulating CD4+FoxP3+ T cells are associated with an increased risk for development of myocardial infarction but not for stroke〔J〕.Arterioscler Thromb Vasc Biol,2012;32(8):2000-4.
7 Li P,Mao L,Zhou G,etal.Adoptive regulatory T-cell therapy preserves systemic immune homeostasis after cerebral ischemia〔J〕.Stroke,2013;44(12):3509-15.
8 Cai Y,Li JD,Yan C.Vinpocetine attenuates lipid accumulation and atherosclerosis formation〔J〕.Biochem Biophys Res Commun,2013;434(3):439-43.
9 Shi ZW,Liu Y,Xu Y,etal.Tremella polysaccharides attenuated sepsis through inhibiting abnormal CD4+CD25(high)regulatory T cells in mice〔J〕.Cell Immunol,2014;288(1-2):60-5.
10 Tian M,Wang Y,Lu Y,etal.Effects of sublingual immunotherapy for dermatophagoides farinae on Th17 cells and CD4(+)CD25(+) regulatory T cells in peripheral blood of children with allergic asthma〔J〕.Int Forum Allerg Rhinol,2014;4(5):371-5.
11 鞠延玲,鲍百丽.冠心病患者T淋巴细胞亚群、同型半胱氨酸与疾病的相关性〔J〕.中国老年学杂志,2014;34(9):2432-3.
12 Uchiyama R,Hasegawa H,Kameda Y,etal.Role of regulatory T cells in atheroprotective effects of granulocyte colony-stimulating factor〔J〕.J Mol Cell Cardiol,2012;52(5):1038-47.
13 张 彤,刘小青,范 谦,等.不同面积的急性心肌梗死患者外周血调节性T细胞表达分析〔J〕.细胞与分子免疫学杂志,2011;27(3):315-6.
14 Matsumoto K,Ogawa M,Suzuki J,etal.Regulatory T lymphocytes attenuate myocardial infarction-induced ventricular remodeling in mice〔J〕.Int Heart J,2011;52(6):382-7.
15 Zhang D,Wang S,Guan Y,etal.Effect of oral atorvastatin on CD4+CD25+ regulatory T cells,FoxP3 expression,and prognosis in patients with ST-segment elevated myocardial infarction before primary percutaneous coronary intervention〔J〕.J Cardiovasc Pharmacol,2011;57(5):536-41.
16 Wang M,Wang Y,He J,etal.Albumin induces neuroprotection against ischemic stroke by altering Toll-like receptor 4 and regulatory T cells in mice〔J〕.CNS Neurol Disord Drug Targets,2013;12(2):220-7.
17 Wigren M,Björkbacka H,Andersson L,etal.Low levels of circulating CD4+FoxP3+ T cells are associated with an increased risk for development of myocardial infarction but not for stroke〔J〕.Arterioscler Thromb Vasc Biol,2012;32(8):2000-4.
〔2015-12-31修回〕
(编辑 苑云杰/曹梦园)
戴贤勇(1979-),男,主治医师,主要从事神经内科疾病研究。
R743
A
1005-9202(2017)08-1930-03;
10.3969/j.issn.1005-9202.2017.08.047
