帕金森病患者外周血单核细胞趋化蛋白-1及巨噬细胞炎性蛋白-1α水平与非运动症状的相关性研究
2017-05-10马继光
董 坤, 牛 平, 苏 岑, 马继光
帕金森病患者外周血单核细胞趋化蛋白-1及巨噬细胞炎性蛋白-1α水平与非运动症状的相关性研究
董 坤1, 牛 平2, 苏 岑2, 马继光2
目的 检测帕金森病(PD)患者血清单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎性蛋白-1α(MIP-1α)水平,并探讨其与PD、尤其与非运动症状(non-motor symptoms,NMS)的相关性。方法 采用ELISA法对67例PD组患者及年龄、性别匹配的34例正常对照组血清MCP-1、MIP-1α水平进行检测。采用UPDRS Ⅲ评分和Hoehn-Yahr分级对PD患者运动功能进行评估,将其分为早期、中晚期;用PD非运动症状评定量表(NMSQuest)对NMS损害程度进行总体评估;用汉密尔顿抑郁量表(HAMD)、汉密尔顿焦虑量表(HAMA)、简易精神状态评价量表(MMSE)对患者抑郁、焦虑、认知功能评估,并用Pearson直线相关分析检验MCP-1、MIP-1α浓度与各量表评分之间的相关性。结果 PD患者血清MCP-1、MIP-1α水平明显高于健康对照组(P<0.01);血清MCP-1、MIP-1α水平与抑郁、焦虑、认知功能呈显著正相关,特别是发现PD早期患者血清MCP-1、MIP-1α水平与HAMD评分呈显著正相关,PD中晚期患者血清MCP-1、MIP-1α水平与MMSE评分呈负相关;中晚期PD患者血清MCP-1、MIP-1α水平显著高于PD早期,PD合并抑郁、认知功能障碍组血清MCP-1、MIP-1α水平显著高于PD未合并抑郁、认知功能正常组(P均<0.01)。结论 血清MCP-1、MIP-1α可能参与PD的发病过程,在PD早期与抑郁显著正相关,在PD晚期与认知功能障碍显著正相关。PD患者血清MCP-1、MIP-1α水平随着运动症状、非运动症状(如抑郁、认知功能)的加重而升高。
非运动症状; 单核细胞趋化蛋白-1; 巨噬细胞炎性蛋白-1α; 抑郁; 焦虑
帕金森病(Parkinson’s disease,PD)常见的临床表现包括以静止性震颤、肌强直、运动迟缓、姿势反射障碍等组成的运动症状,及以神经精神症状、认知障碍、睡眠相关障碍、自主神经症状、胃肠道紊乱、感觉异常等组成的非运动症状(non-motor symptoms,NMS)。NMS常在PD运动症状出现之前或更早期出现,易被忽视。一项多中心研究[1]证实NMS是导致PD患者晚期致残及生活质量下降的主要原因,可作为对PD患者残疾及生活质量预测及评估的重要指标[2]。近年研究表明PD的发病及进展与多种炎性细胞激活、浸润,及其分泌的炎性因子、趋化因子相互作用所介导的炎症反应激活与放大相关。趋化因子(Chemokines,CK)是一类趋化细胞定向移动的细胞因子,MCP-1、MIP-1α作为CK的典型代表,可作用于炎症反应的多个环节。相关报道发现脑脊液中炎性标志物水平与PD患者抑郁、焦虑等相关,脑脊液MCP-1水平与抑郁程度也明显相关。陈生弟等[3]发现PD早期患者外周血MIP-1α水平与抑郁、RBD呈负相关,提示特异性CK可能与PD伴发抑郁及RBD等NMS相关。
本研究通过检测PD患者外周血MCP-1、MIP-1α水平,探讨其与PD,尤其是NMS之间的相关性。
1 材料与方法
1.1 研究对象及分组 选择2016年5月-2016年12月就诊于沈阳军区总医院神经内科的原发性PD患者67例,诊断符合中华医学会神经病学分会运动障碍及帕金森病学组制定的原发性PD诊断标准[4]。男37例,女30例,年龄(40~85)岁,平均(64.58±10.69)岁,病程(1~20)年,平均(6.22±4.29)年。排除近期感染(如近期发烧、外周血白细胞计数超过正常)、肿瘤、免疫系统疾病、长期慢性感染、2个月内应用抗生素、应用非甾体类抗炎药及免疫抑制剂者。排除不能配合检查及合并精神疾病者。正常对照组34例,为同期健康体检者。男20例、女14例,年龄(40~85)岁,平均(62.15±9.50)岁。两组性别及年龄匹配。
1.2 方法 肘正中静脉采血5 ml,自然凝固,1 h内离心,分离血清,分装后保存于-80 ℃冰箱内。采用生物素双抗体夹心酶联免疫吸附法(Enzyme-Linked Immunolsorbent Assay,ELISA)定量测定血清中MCP-1、MIP-1α水平。
1.3 PD患者运动症状与非运动症状评估 采用UPDRSⅢ评分和Hoehn-Yahr分级对PD运动症状进行评估及分级。PD早期为1~2级、中晚期为2.5~5级。采用PD非运动症状评定量表(NMSQuest)对非运动功能损害进行评估,采用HAMD、HAMA分别对抑郁、焦虑状态进行评估,HAMD>20分确定存在抑郁状态,HAMA>14分确定存在焦虑状态;采用MMSE量表评估认知功能,MMSE<27分确定存在认知功能障碍,27≤MMSE≤30确定认知功能正常。

2 结 果
2.1 PD组与对照组血清MCP-1、MIP-1α水平比较 PD组血清MCP-1、MIP-1α水平分别为(43.08±12.00)ng/L、(23.96±6.18)ng/L;对照组血清MCP-1、MIP-1α水平分别为(20.90±11.36)ng/L、(9.15±4.16)ng/L。PD组血清MCP-1、MIP-1α水平均显著高于对照组,差异极显著(P<0.01)。
2.2 不同分期PD患者血清MCP-1、MCP-1α水平比较 按H-Y分级对PD组进行分组比较,1~2级为早期组;2.5~5级为中晚期组。结果表明PD早期血清MCP-1、MIP-1α水平分别为(33.79±4.45)ng/L、(18.85±2.51)ng/L;PD中晚期血清MCP-1、MIP-1α水平分别为(50.18±11.06)ng/L、(27.86±5.23)ng/L;PD中晚期血清MCP-1、MIP-1α水平显著高于PD早期,差异极显著(P<0.01)。
2.3 伴发不同NMS的PD患者血清MCP-1、MCP-1α水平比较 采用HAMD、HAMA、MMSE评分将PD组患者分为抑郁组与非抑郁组、焦虑组与非焦虑组、认知障碍组与认知正常组,分组比较各组间血清MCP-1、MIP-1α水平。结果表明抑郁组血清MCP-1、MIP-1α水平高于非抑郁组,差异极显著(P<0.01)(见表1);认知障碍组血清MCP-1、MIP-1α水平高于认知功能正常组,差异极显著(P<0.01)(见表2);焦虑组与非焦虑组血清MCP-1、MIP-1α水平无显著性差异(P>0.05)。
2.4 PD患者血清MCP-1、MIP-1α水平与UPDRSⅢ、NMSQuest、HAMD、HAMA、MMSE评分的相关性分析 采用UPDRSⅢ、NMSQuest、HAMD、HAMA、MMSE分别对PD组患者运动症状、非运动症状、抑郁、焦虑、认知功能进行评分。采用Pearson直线相关分析PD组血清MCP-1、MIP-1α水平与各评分的相关性,结果表明PD组血清MCP-1、MIP-1α水平与UPDRSⅢ、NMSQuest、HAMD、HAMA评分呈正相关,与MMSE评分呈负相关(见表3)。
2.5 不同分期PD患者血清MCP-1、MIP-1α水平与HAMD、HAMA、MMSE评分相关性分析 采用Pearson直线相关分析分别对早、中晚期PD患者血清MCP-1、MIP-1α水平与各评分的相关性,结果表明早期PD患者血清MCP-1、MIP-1α水平与HAMD评分呈显著正相关(见图1、图2);中晚期PD患者血清MCP-1、MIP-1α水平与MMSE评分呈显著负相关(见图3、图4);早、中晚期PD患者血清MCP-1、MIP-1α水平与HAMA 均无相关性。

表1 抑郁组与非抑郁组血清MCP-1、MIP-1α 水平比较
与非抑郁组比较*P均<0.01
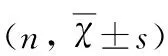
表2 认知功能障碍组与认知功能正常组血清 MCP-1、MIP-1α水平比较
与认知功能正常组比较*P均<0.01
表3 PD组血清MCP-1、MIP-1α水平与UPDRSⅢ HAMD、HAMA、MMSE评分相关性(r)
双变量相关性△P<0.01,*P<0.05

图1 早期PD患者血清MCP-1水平与HAMD评分相关性分析
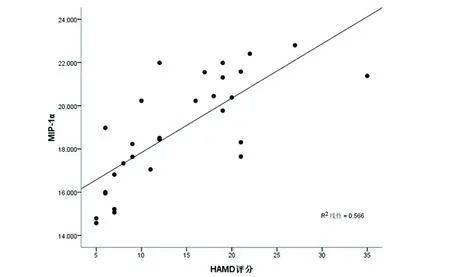
图2 早期PD患者血清MIP-1α水平与HAMD评分相关性分析

图3 中晚期PD患者血清MCP-1水平与MMSE评分相关性分析

图4 中晚期PD患者血清MIP-1α水平与MMSE评分相关性分析
3 讨 论
近年研究发现PD病程中通常伴随着免疫炎症的发生,表现为胶质细胞激活、外周免疫细胞浸润、免疫复合物沉积,并产生与释放大量的促炎细胞因子。多种炎症细胞激活、浸润,并与其分泌的细胞因子相互作用,介导了炎症的激活与放大。Block等[5]发现小胶质细胞作为脑内固有的免疫细胞,在免疫刺激和神经元细胞死亡后,会持续活化,并产生促炎因子如 TNF-α、PGE2、IFN-γ等,引起多巴胺能神经元凋亡,多巴胺能神经元损伤可能又进一步加剧了炎症反应。Gordon等[6]在PD小鼠实验模型中发现小胶质细胞上蛋白激酶Cδ上调能驱动神经炎症反应和多巴胺能神经元退行性变。药理抑制蛋白激酶Cδ和基因敲除能够抑制NF-κB活化,减少细胞因子和CK的释放,减轻炎症反应。
一些研究证实中枢神经系统内MCP-1、MIP-1α等CK通过与相应受体结合,参与PD等神经退行性疾病的发生发展。Nagata等[7]发现PD患者脑脊液中MCP-1水平显著高于脊髓小脑共济失调患者及健康人群。本研究发现PD组患者外周血MCP-1、MIP-1α水平显著高于正常对照组,PD组血清MCP-1、MIP-1α水平与反应PD运动症状的UPDRS Ⅲ评分呈正相关。对不同临床分期的PD患者进行分组比较,结果表明中晚期PD患者血清MCP-1、MIP-1α水平显著高于早期PD患者,提示血清MCP-1、MIP-1α水平随病情加重而增高,可能与PD的进展相关。
TANG[8]等在体外实验中发现纹状体神经细胞死亡后,MCP-1和MIP-1α对于诱导脑室下区(SVZ)来源的神经前体细胞迁移具有重要作用。并在体内实验中通过检测成年大鼠MCP-1、MIP-1α浓度,分析脑室下区神经前体细胞迁移的个体效应。研究结果提示MCP-1、MIP-1α能够显著增加脑室下区神经前体细胞迁移到纹状体的密度,证实了MCP-1和MIP-1α对于纹状体神经细胞的趋化作用。Lindqvist等[9]发现脑脊液中MCP-1、MIP-1β、IL-6、CRP等水平与PD患者抑郁、焦虑、疲劳和认知严重程度呈正相关,脑脊液中MCP-1与抑郁严重程度显著相关。本研究结果发现PD组患者外周血MCP-1、MIP-1α水平与抑郁、焦虑、认知障碍显著相关,早期PD患者血清MCP-1、MIP-1α水平与抑郁呈显著正相关;中晚期PD患者血清MCP-1、MIP-1α水平与认知功能障碍呈显著正相关。与Lindqvist等结论一致。
抑郁为PD患者最常见的非运动症状[10]。已证实脑内某些神经环路,尤其是边缘叶-皮质纹状体-苍白球-丘脑环路在抑郁发生中起重要作用[11]。研究证实[12]PD早期,蓝斑、中缝核及脑桥相关核团受损,中缝核、蓝斑主要为5-HT、去甲肾上腺素能神经元,5-HT是调控情感活动的重要神经递质。PD患者5-HT系统广泛变性,其病理改变早于黑质纹状体多巴胺能神经元变性,导致抑郁先于运动症状出现。与未伴发抑郁的PD患者比较,伴发抑郁者中缝背核5-HT能神经元丢失更多,暗示了5-HT水平的异常变化与抑郁严重程度有明显相关性[13]。随着疾病进展,脑内神经递质包括5-HT、多巴胺、去甲肾上腺素等水平发生明显变化,抑郁程度进而加重[14]。本研究还发现伴发抑郁、认知功能障碍的PD患者血清MCP-1、MIP-1α水平明显高于未伴发抑郁、认知功能障碍的PD患者。提示MCP-1、MIP-1α水平可能可以作为PD合并抑郁、认知功能障碍诊断的一个指标。
PD伴发焦虑多在临床确诊PD之前1 y出现,认为是运动症状出现前期的危险因素。Gaenshen等[15]通过问卷调查的形式,分析96例PD患者19项非运动症状和6项早期运动症状,发现焦虑早于运动症状出现。本研究结果表明血清MCP-1、MIP-1α水平与HAMA评分呈显著正相关,但是,伴焦虑PD组患者血清MCP-1、MIP-1α水平与未伴焦虑PD组比较无显著性差异。
超过80%的PD患者有认知功能损害,近30%发展为痴呆,约为正常组的6倍[16]。早期识别认知功能障碍,并给予治疗,可明显改善患者的生活质量。本研究结果发现中晚期PD组血清MCP-1、MIP-1α水平与MMSE评分呈显著负相关,与认知功能障碍显著相关。Braak等提出PD的病理进程可按照路易体出现的先后分为6期。认知功能障碍出现在PD病理进程的5、6期,即路易体已累及边缘系统、新皮质。PD患者非运动症状至运动症状出现的时间约为10~20 y[17]。本研究发现PD组血清MCP-1、MIP-1α水平与其运动症状、抑郁、焦虑、认知功能等均密切相关,提示其可能有助于PD病变程度的监测。
近年来对MCP-1、MIP-1α为代表的CK家族与PD相关性的研究报道较多,Thome等[18]通过敲除趋化因子受体基因的小鼠PD模型与未敲除趋化因子受体基因小鼠比较,前者的小胶质细胞吞噬能力减弱,炎症反应减轻。通过MCP-1、MIP-1α受体拮抗剂、敲除CK及其受体基因、功能性封闭抗体等方法,将有助于PD的诊断治疗,进而延缓疾病进展。
[1]Hely MA,Morris JG,Reid WG,et al.Sydney multicenter sdudy of Parkinson’s disease:non-L-dopa-responsive problems dominate at 15 years[J].Mov Disord,2005,20:190-199.
[2]Ray Chaudhuri K,Rojo JM,Schapira AH,et al.A proposal for a comprehensive grading of Parkinson’s disease severitycombining motor and non-motor assessment:meeting an unmet need[J].PLoS One,2013,8:57221.
[3]马建芳,陈生弟.血浆巨噬细胞炎性蛋白与早期帕金森病的相关性[J].中华神经科杂志,2015,48(6):464-468.
[4]中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森病的诊断标准(2016版)[J].中华神经医学杂志,2016,49(4):268-271.
[5]Block ML,Hong JS.Chronic microglial activation and progressive dopaminergic neurotoxicity[J].Biochem Soc Trans,2007,35(5):1127-1132.
[6]Gordon R,Singh N,Lawana V,et al.Protein kinase Cδ upregulation in microglia drives neuroinflammatory responses and dopaminergic neurodegeneration in experimentalmodels of Parkinson’s disease[J].Neurobiology of Disease,2016,93:96-114.
[7]Nagata T,Nagano I,Shiote M,et al.Elevation of MCP-1 and MCP-1/VEGF ratio in cerebrospinal fluid of amyotrophic lateral sclerosis patients[J].Neurological Research,2007,29(8):772-776.
[8]Tang SK,Knobloch RA,Maucksch C,et al.Redirection of doublecortin-positive cell migration by over-expression of the chemokines MCP-1,MIP-1α and GRO-α in the adult rat brain[J].Neuroscience,2014,260(28):240-248.
[9]Lindqvist D,Hal S,Surova Y,et al.Cerebrospinal fluid inflammatory markers in Parkinson’s disease-Associations with depression,fatigue,and cognitive impairment[J].Brain,Behavior,and Immunity,2013,33:183-189.
[10]Aarsland D,Taylor JP,Weintraub D.Psychiatric issues in cognitive impairment[J].Mov Disord,2014,29(5):651-662.
[11]Drevets WC,Price J,Furey ML.Brain and structural and functional abnormalities in mood disorder:implications for neurocircuitry models of depression[J].Brain Struct Funct,2008,213(1/2):93-118.
[12]Braak H,Ghebremedhin E,Rub U,et al.Stages in the development of Parkinson’s desease related pathology [J] .Cell Tissue Res,2004,318(1):121-134.
[13]Huot P,Fox SH.The serotonergic system in motor and non-motor manifestations of Parkinson’s disease[J].Exp Brain Res,2013,230(4):463-476.
[14]Aarsland D,Pahlhagen S,Ballard,et al.Depression in Parkinson disease-epidemiology,mechanisms and management[J].Nat Rev Neurol,2011,8(1):35-47.
[15]Gaenshen A,Swid I,Liepelt-Scarfone I,et al.The patients perception of prodromal symptoms before the initial diagnosis of Parkinson’s dlsease[J].Mov Disord,2011,26:653-658.
[16]Aarsland D,Andersen K,Larsen JP,et al.Prevelence and characteristics of dementia in Parkinson disease:an 8-year prospective sdudy[J].Arch Neurol,2003,60(3):387-392.
[17]Banks WA,Farr SA,Morley JE.Entry of blood-borne cytokines into the central nervous system:effects on cognitive processes[J].Neuroimmunnomodulation,2002,10(6):319-327.
[18]Thome AD,Standaert DG,Harms AS.Fractalkine signaling regulates the inflammatory response in an α-synuclein model of Parkinson disease[J].PLoS One,2015,10(10):1-13.
The correlation between the serum levels of monocyte chemoattractant protein-1、macrophage inflammatory protein-1α and non-motor symptoms in patients with Parkinson’s disease
DONGKun,NIUPing,SUCen,etal.
(JinzhouMedicalUniversity,GeneralHospitalofShenyangMilitaryRegionofPLATrainingBaseforGraduate,Jinzhou121001,China)
Objective To detect the serum concentration of MCP-1,MIP-1α and to explore the correlation with PD,especially the NMS.Methods The serum levels of MCP-1 and MIP-1α of 67 patients with PD and 34 healthy subjects with age and sex matched were measured by ELISA.By using the UPDRSⅢ and Hoehn-Yahr classification the motor function was evaluated,which can be divided into the early and the late.The NMSQuest is used to evaluate the general NMS.With the use of HAMD、HAMA、MMSE, the depression、 anxiety、cognitive function were assessed and correlation between the serum MCP-1,MIP-1α levels and all scale scores by Pearson correlation analysis.Results The serum MCP-1 and MIP-1α levels were significantly higher than the control group(P<0.01).The serum MCP-1 and MIP-1α levels were significantly correlated with the scores of HAMD、HAMA and MMSE,especially the serum MCP-1 and MIP-1α levels in the early of PD were significantly positively correlated with the HAMD scores,the serum MCP-1 and MIP-1α levels in the late of PD was significantly negatively correlated with the MMSE scores.The serum MCP-1 and MIP-1α levels in the late of PD were significantly higher than that of the early of PD(P<0.01).The levels of the serum MCP-1 and MIP-1α were significantly higher in PD patients combined with depression and cognitive impairment than those without depression and cognitive impairment(P<0.01).Conclusion The serum MCP-1 and MIP-1α may play an important role in the pathogenesis of PD,and have significant positively correlation with depression in the early stage of PD and significantly positively correlation with cognitive impairment in PD.The levels of the serum MCP-1 and MIP-1α in PD were increased with the aggravate of motor symptoms and NMS such as depression and cognitive function.
Non-motor symptoms; MCP-1; MIP-1α; Depression; Anxiety
1003-2754(2017)04-0312-04
2017-02-13;
2017-03-29
辽宁省科技攻关课题(No.2010225003)
(1.锦州医科大学中国人民解放军沈阳军区总医院研究生培养基地,辽宁 锦州 121001;2.沈阳军区总医院神经内科,辽宁 沈阳 110016)
牛 平,E-mail:np0702@sina.com
R742.5
A
