利用氮氧同位素示踪技术解析巢湖支流店埠河硝酸盐污染源
2017-05-07王允青王道中吕国安郭熙盛
王 静,叶 寅,王允青 ,王道中 ,吕国安,郭熙盛
(1.安徽省农业科学院 土壤肥料研究所,安徽 合肥 230031;2.华中农业大学 资源与环境学院,湖北 武汉 430070;3.安徽省养分循环与资源环境省级实验室,安徽 合肥 230031)
1 研究背景
河流在陆地表层系统的氮(N)循环中起着重要作用,随着人为氮素排放的增加,世界范围内多数河流的硝酸盐(NO3-)浓度明显增加[1-2],NO3-是进入水环境中无机氮的主要成分,可被生物迅速利用[3]。水体中NO3-污染可导致水体富营养化并严重威胁饮用水安全。目前,水体NO3-污染已成为全球面临的主要水环境问题之一[4-5]。
厘清水体NO3-污染的来源,是减少甚至阻断人为氮输入到水生生态系统的前提[6]。传统水化学方法是利用各种污染源的排放数据、NO3-浓度及其他离子浓度特征来分析水体NO3-的来源[7-8]。然而,由于流域内的NO3-有多种来源(化肥与粪肥、大气氮沉降、生产和生活污水、土壤有机氮等)[4],不同污染源受到迁移转化过程中多种因素(地形、水文条件、处理工艺、降水等)的影响,尤其是非点源污染具有的分散性、隐蔽性、随机性、不易监测和难以量化等特征[9],使得研究结果存在许多不确定性的因素。随着技术的进步,水体NO3-的氮氧同位素联合测定成为可能,其在识别水体NO3-的来源及迁移转化过程显示出较强的优越性。研究人员根据不同NO3-污染来源的氮氧同位素特征值的差异性原理,成功地对水体中的NO3-进行了源解析[10]。如:Johannsen等[11]对德国5条河流的研究发现,秋季和冬季水体NO3-含量高,水体NO3-的δ15N值为8.2‰~11.3‰,δ18O值为0.4‰~2.2‰,来源主要是土壤氮的硝化作用、生活污水和有机肥;Ren等[12]利用氮氧同位素技术辨识了北京城市NO3-的来源。随着科技的发展,研究者已不再满足于定性分析NO3-的来源。现如今,研究者已利用氮氧同位素模型并结合其它环境同位素,定量计算了地表水、地下水、降水中NO3-不同来源贡献率、评价硝化/反硝化过程,有效判别了水体NO3-的污染来源[10]。如:贺国平等[13]利用氮氧同位素和物质平衡模型定量识别了永定河洪积扇地下水NO3-的来源,认为粪肥对地下水NO3-的贡献为58%~81%;Xue等[5]利用SIAR模型计算得到了3种不同土地利用类型河流5种硝酸盐源(降雨中硝酸盐、化肥中硝酸盐、化肥和降雨中铵盐、土壤氮、有机肥和生活污水)在冬季和夏季的贡献比例;金赞芳等[14]评价了西湖沉积物-水界面氮的硝化/反硝化过程。
巢湖是全国富营养化最为严重的淡水湖泊之一,近年来,政府部门和众多学者对巢湖的污染过程、富营养化机制、内源控制和区域水质变化等方面开展了大量的研究[15-17],采取了一系列的措施,并出台了相关政策,取得了较好的成果。然而巢湖水体富营养的趋势仍未得到根本性改观,巢湖西部湖区夏季蓝藻暴发依然普遍,水体富营养化已经成为制约该区域经济和社会可持续发展的“瓶颈”因素[18]。NO3--N是巢湖水体中N素的主要赋存形态[17],是引起水体富营养化的重要因子。入湖河流作为污染物转移到湖泊中的主要路径,集中了所在流域的各种点源和面源污染[19]。查明周围河流NO3--N的污染来源对巢湖的水环境保护和富营养化防治具有重要意义。因此,本研究利用水体NO3-的氮、氧同位素示踪技术,以巢湖支流-店埠河为研究对象,综合分析丰、枯水期水体各形态氮浓度及硝酸盐δ15N和δ18O的变化特征,讨论NO3-的可能来源,并引入稳定同位素源解析混合模型(SIAR,Stable Isotope Analysis in R)定量评价NO3-各污染源的贡献率,以期为巢湖流域氮污染控制提供科学依据。
2 材料与方法
2.1 研究区概况店埠河是巢湖入湖支流南淝河的最大支流,位于安徽省的肥东县和新站区境内,主河道自北向南流经元疃镇、众兴乡、牌坊乡、磨店乡、店埠镇、撮镇镇等乡镇,于三汊河口入南淝河,主要支流有于湾河、永安河、定光河、马桥河等。研究区主河道全长41.5 km,流域面积483.1 km2。店埠河流域属于亚热带季风气候区,年均气温15.5℃,年均降雨量940~1000 mm,且多集中分布在夏季(6—8月),无霜期为224~252 d。在店埠河上游区域主要以种植业和养殖业为主,对于耕地而言,主要种植水稻、小麦、油菜、棉花和玉米等,化肥(主要是尿素、复合肥和铵态氮肥,很少有单独使用硝态氮肥)通常以约400 kg(N)·ha-1·a-1的用量施入农田。为了研究整个店埠河区域的水质的空间分布特征,依据土地利用类型和河流流向,将研究区划分为上游、中游和下游区域,上游主要流经传统的农业耕作区,而中下游主要流经城镇生活区。
2.2 样品采集于2016年1月(枯水期)和2016年7月(丰水期)对店埠河干流及主要支流河水进行了采集,共设置17个采样点,所有样点均以GPS定位,采样点分布图用Arcgis10.0绘制(图1),每次采样选用顺流采样方式,即按照从上游到下游的方式采取水样。采样点R1—R9、R10—R14和R15—R16分别位于河流的上游、中游和下游,样品采集后冷藏并迅速运回实验室分析。
另外,于2015年1月—2016年12月期间,采集了店埠河硝酸盐的潜在污染源,用于分析其氮氧同位素特征值,包括:雨水(14个),不同土地利用类型的未施肥土壤(8个),畜禽粪便(8个),化肥(8个),污水(16个,包括生活污水、养殖废水和污水处理厂出水)。
2.3 样品分析水体溶解氧(DO)、温度(T)采用便携式溶氧仪(DO200A,YSI)采样现场测定,pH值采用便携性pH计(雷磁PHB-4)现场测定。水样取回后一般迅速分为两部分,一部分用0.45 μm微孔滤膜过滤,用于测定硝态氮(NO3--N)、铵态氮(NH4+-N)、亚硝酸盐氮(NO2--N)、氯离子(Cl-)、δ15N-NO3-和δ18O-NO3-,另一部分未经过滤的水样用于测定总氮(TN)。参照《水和废水监测分析方法》(第四版)[20],水样总氮(TN)采用碱性过硫酸钾氧化-紫外分光光度法测定,铵态氮(NH4+-N)采用纳氏试剂分光光度法测定,硝态氮(NO3--N)采用紫外分光光度法测定,氯离子(Cl-)采用硝酸银滴定法。
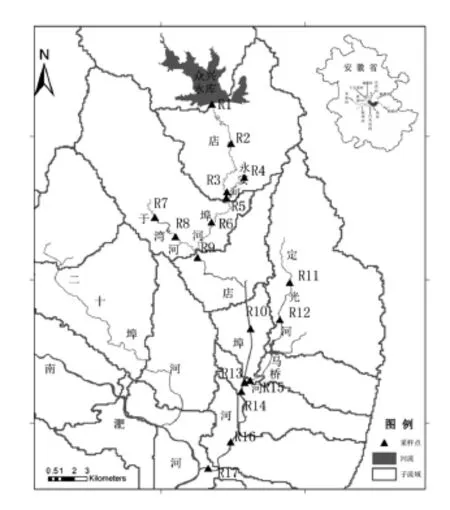
图1 店埠河采样点位置示意图
δ15N-NO3-和δ18O-NO3-采用反硝化细菌法进行测定[21]。该方法的实验原理是:在水样中加入缺乏N2O活性酶(该酶使得N2O转化为N2)的反硝化细菌-致金色假单胞菌(Pseudomonas aureofaciens)将水样中的硝酸盐全部转化为N2O,生成的N2O经分离纯化后进入同位素比值质谱仪测定δ15N-NO3-和δ18O-NO3-。具体步骤为:选用Pseudomonas aureofacien(sATCC13985,美国农业部菌种保存中心)菌株进行活化,并划出单菌落;接种到5 ml带有NO3-的TSB灭菌培养液中,在摇床上(26℃,180 r/min)培养1 d;转接到500 ml培养瓶中,在摇床上(26℃,180 r/min)培养7 d;将培养7 d菌液在18℃,以30 000 r/min离心20 min,弃上层清液,剩余菌体用无NO3-的TSB培养液悬浮,浓缩成1/12的菌液;吸取3 ml浓缩菌液注入容积为20 ml的顶空瓶中,每瓶用高纯氦气(流速为10~20 ml/min)吹扫3 h以上,注入50 nmol NO3-水样,26℃过夜恒温培养;第2天注入0.15 ml的10 mol/L NaOH,消散细菌,并吸收产生的CO2;将每个顶空样品瓶中产生的N2O气体用气密性注射器抽取2 ml,注入提前抽真空的试管中,通过痕量气体分析仪(TraceGas)的Gilson自动进样器将N2O气体输送至TraceGas,经TraceGas提取纯化和捕集N2O气体,最后由同位素比质谱仪测定氮氧同位素组成。采用USGS32、USGS34、USGS35为标样,用2点校正的方法对所测定的气体进行校正。测定的同位素值分别与国际标准物质相对应:

式中:δ样品为硝酸盐中N、O同位素的相对比值,即样品的同位素比值相对于参照标准的同位素比值的千分偏差;R为同位素比值,即元素的重同位素原子丰度与轻同位素原子丰度之比,R样品和R标准分别为样品和标准的15N/14N或18O/16O,N同位素参照标准是标准大气(AIR),O同位素参照标准是维也纳标准平均海水(Vienna Standard Mean Oceanic Water,V-SMOW)。
土样、肥料和畜禽粪样品中的δ15N采用燃烧法测定。样品自然风干,以粉碎机粉碎并过100目筛,在1 120℃下在填充有WO3的氧化管中进行燃烧,形成的气体在填有还原铜的管内还原为N2(850℃),气体通过氦载气流经水阱(高氯酸镁),N2经过吸附与解吸附柱分离,最后进入同位素质谱仪(IRMS)测定同位素。利用USGS24和USGS41对标准气体进行校正。
δ15N-NO3-、δ18O-NO3-和固体中δ15N测定的实验均在中国农业科学院稳定同位素实验室进行。
2.4 同位素源解析模型(SIAR)引入SIAR同位素源解析模型,对水体硝酸盐各污染源进行计算,解析不同的污染源在不同季节中的贡献率。SIAR模型是由Parnell等人开发的一个基于R统计软件的稳定同位素混合模型[22]。该模型基于Dirichlet分布作为对贡献率的先验分布,然后利用贝叶斯方法分析在获取观测数据后各污染贡献率的后验分布。当定义有N个测量值、J种同位素、K种污染源,SIAR模型可表示为:
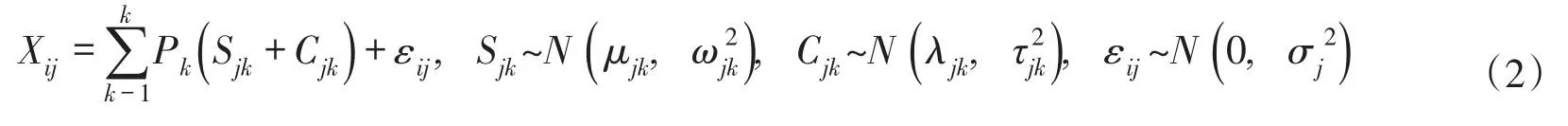
式中:Xij为混合样i中同位素j的比值(i=1,2,3,…,N;j=1,2,3,…,J);Sjk为源k中同位素j的比值(k=1,2,3,…,K),其平均值为μ,标准偏差为ω;Pk为所要计算的源k的比例;Cjk为源k中同位素j的分馏因子(平均值λ,标准偏差τ);εij为混合样i中同位素j比值的残余误差(平均值0,标准偏差σ)。
3 结果与讨论
3.1 店埠河潜在硝酸盐污染源氮氧同位素特征值结合对店埠河污染源实际情况的调查分析和目前河流污染源解析的可操作性,将店埠河水中NO3-的来源主要分为4类,分别为:雨水源、粪肥污水源、化肥源和土壤源,其氮氧同位素特征值见表1。雨水源和粪肥污水源的δ15N和δ18O的范围由研究区的雨水样品和污水样品分析得到。化肥源和土壤源中的δ15N的范围由研究区所采集的肥料样品以及土壤样品分析得到。所测的δ15N和δ18O值与前人的研究结果一致。化肥源和土壤源中的氧同位素比率是根据硝化反应的理论推算得到的。从理论上讲,当硝化反应发生时,新形成的硝酸盐中两个氧原子来自周围环境中的H2O,另外一个氧原子来自于大气中的O2[23]。根据这一理论,推算由硝化反应生成的硝酸盐中的δ18O的变化范围是-0.1‰到+9.2‰,因为周围环境水中的氧同位素的比率为-11.8‰到+2.1‰(国际原子能协会南京站点数据)[24],而大气中氧同位素比率为+23.5‰。

表1 店埠河流域潜在硝酸盐污染源氮氧同位素特征值
3.2 店埠河水体的水化学特征店埠河枯水期与丰水期水体样品的主要参数和水化学组成情况分别如表2、表3所示。店埠河水体pH值呈中性偏弱碱性,枯水期和丰水期pH范围分别为7.63~8.46和7.38~8.27,均值分别为8.04和7.76,枯水期的pH值普遍高于丰水期。大气降水是店埠河河水的主要来源,研究区附近的合肥市2005—2012年大气降水的pH值一直低于5.0,酸雨频率高于50%,在2012年达到86.6%[25]。因此,较低pH值的大气降水的输入可能是丰水期店埠河河水pH值较枯水期低的重要原因。溶解氧(DO)是衡量水质优劣与水体自净能力的重要参数。店埠河水体枯水期和丰水期DO范围分别为4.96~11.51和3.46~9.50 mg/L,均值分别为7.67和5.10 mg/L,所有采样点DO值均高于反硝化反应的阈值(1~2 mg/L)[23],并且呈现出枯水期大于丰水期的特征。研究发现,从整体上看,无论是枯水期还是丰水期的pH和DO值都呈现出上游区域要高于中下游区域的特点。
水质总氮(TN)包括硝态氮(NO3--N)、氨态氮(NH4+-N)和亚硝态氮(NO2--N)等无机态氮以及蛋白质、氨基酸和有机胺等有机态氮,其中TN、NO3--N、NH4+-N和NO2--N等常被用于表征水体受污染的严重程度。店埠河水体各形态氮浓度具有很强的时空变异性。上游区域水体TN、NO3--N和NH4+-N浓度在丰水期变化范围分别为0.99~6.84、0.67~4.54和0.07~1.70 mg/L,均值分别为4.87、2.73和0.52 mg/L;在枯水期的变化范围分别为0.81~4.42、0.40~2.12和0.27~2.34 mg/L,均值分别为3.09、1.17和1.10 mg/L。TN和NO3--N浓度丰水期显著高于枯水期,而NH4+-N浓度则是枯水期较丰水期高。店埠河中下游区域水体TN、NO3--N和NH4+-N在丰水期变化范围分别为4.05~10.60、2.18~4.65和0.71~3.19,均值分别为6.62、3.23和1.57 mg/L;在枯水期的变化范围分别为6.75~18.50、2.98~6.00和1.37~8.20 mg/L,均值分别为10.52、4.26和3.66 mg/L。可见,中下游区域水体TN、NO3--N和NH4+-N浓度随时间变化趋势表现出与上游区域水体不同的特征,其浓度均是枯水期显著高于丰水期。河流污染物的浓度受水量、污染物入河量及河流自净能力的综合作用的影响。枯水期的水质主要反映点源污染的情况,而丰水期主要反映面源污染和稀释作用的影响。刘玉年[26]对淮河中游水质进行的研究表明,枯水期的水质污染较为严重,受到了水量变化的调控。但Yang等[27]对浙江合溪水库流域的水质氮素季节性变化特征研究表明,尽管丰水期水量的增加对污染物的浓度产生了稀释效应,但TN、NO3--N和NH4+-N的浓度在流域内为湿季高于干季。
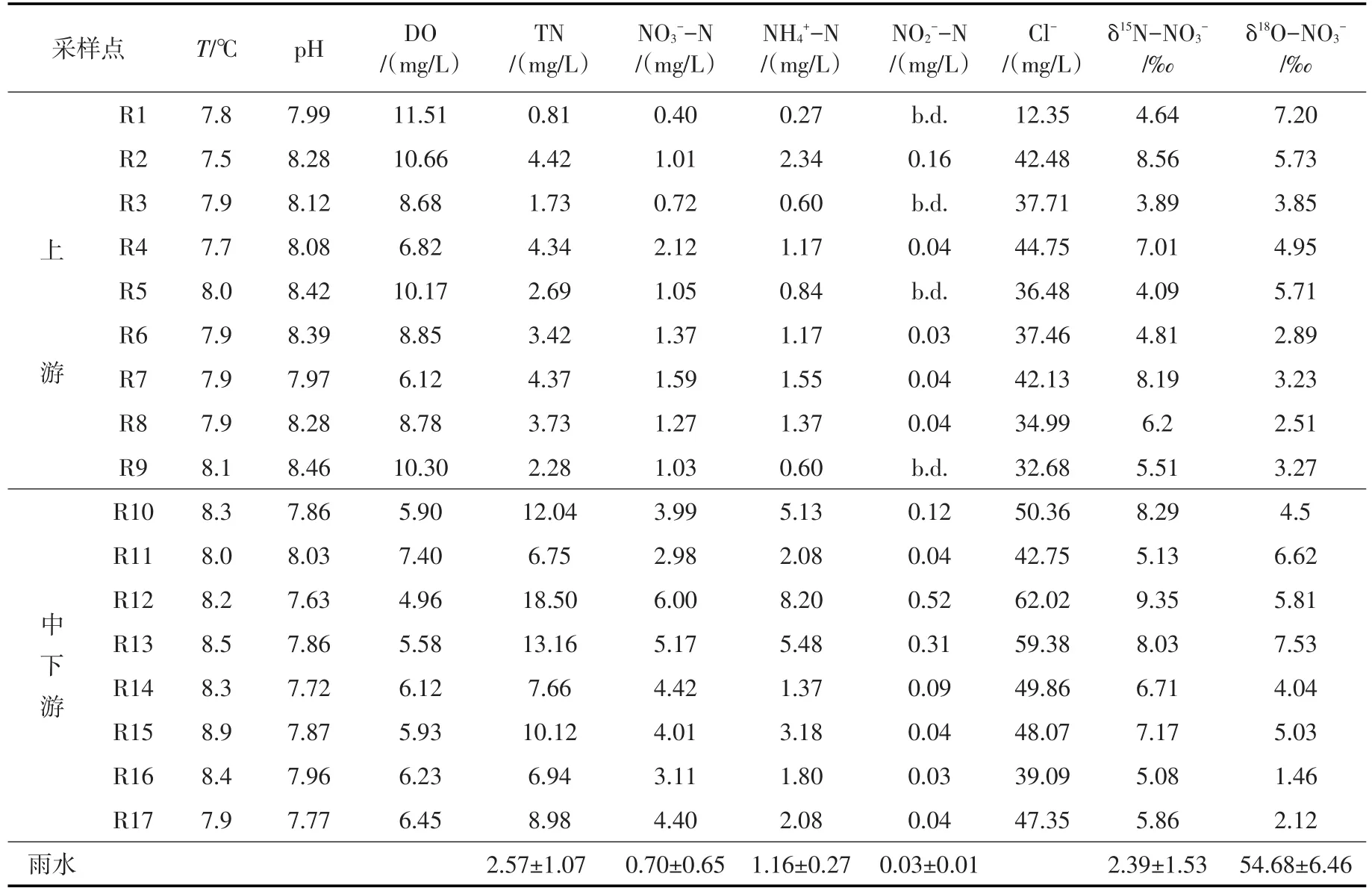
表2 枯水期店埠河流域河水水文化学参数及硝酸盐氮、氧同位素组成
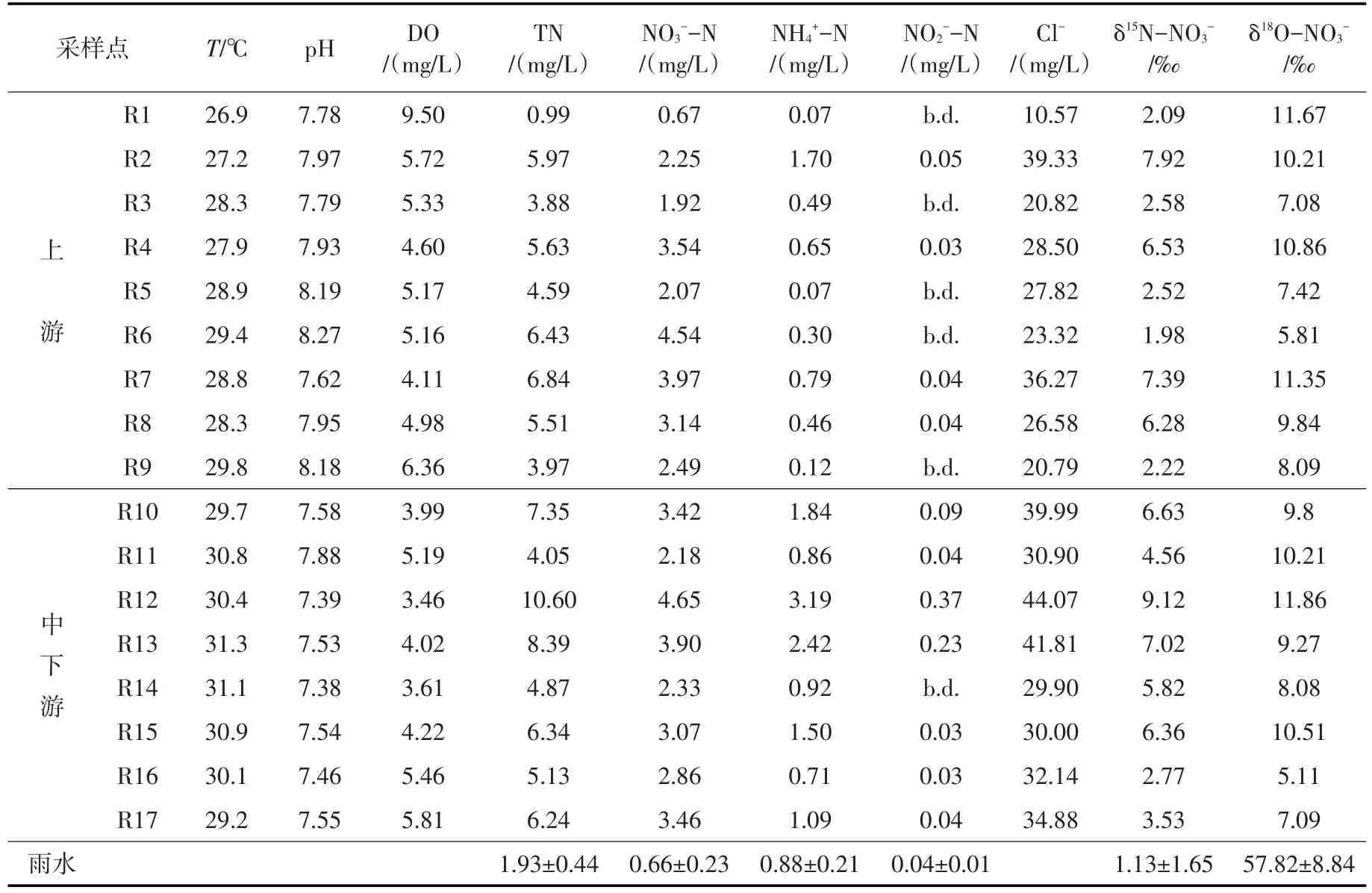
表3 丰水期店埠河流域河水水文化学参数及硝酸盐氮、氧同位素组成
本研究结果表明,店埠河上游区域水体TN和NO3--N浓度表现为丰水期显著高于枯水期,NH4+浓度枯水期较丰水期高,而中下游区域水体的TN、NO3--N和NH4+-N的浓度则呈现出枯水期高于丰水期的特点。分析其原因,一方面,店埠河上游区域水体主要流经传统农业耕作区,丰水期是农业施肥的集中时期,大量未被农作物吸收利用的N素在降雨的作用下,主要以NO3--N的形式通过径流或淋溶进入水体,再加上农业活动频繁,土壤侵蚀加剧,从而导致TN和NO3--N浓度整体升高;另一方面,丰水期气温,溶解氧等水体条件适宜,有利于硝化作用的进行,也引起了NO3--N和TN浓度的升高。店埠河中下游河段主要流经城镇生活区,沿途接纳大量城镇生活污水和工业废水,污染物排放量基本不变,TN、NO3--N和NH4+-N的浓度在丰水期和枯水期的变化主要受到水量变化的调控,丰水期水量的增加对污染物的浓度有显著的稀释作用。就空间分布来看,店埠河水体各形态氮浓度中下游区域要高于上游区域,特别是支流定光河(R12)和马桥河(R13)污染较重,各形态氮浓度均较高。NO2--N含量较低,部分样品低于检测限,但仍有4个水样(枯、丰水期的R12和R13)的NO2--N含量超过世界卫生组织推荐的长期饮用水中亚硝酸氮含量不高于0.2 mg·L-1的标准[28]。同时,这几个水样的其它形态的氮含量也都较高,表明该河段(定光河和马桥河的水体污染严重。从氮存在形态来看,水体无机氮主要以NO3--N形态存在,而污水则以NH4+-N为主。同时NO3--N含量较低,这有可能是生活污水输入的有机氮或氨态氮还未完全转化为硝态氮。
3.3 店埠河硝酸盐来源的定性解析Cl-是硝酸盐污染源解析的重要辅佐工具,它具有生物和化学惰性,不易受物理、化学和生物进程的影响[29],是表征污水输入和稀释作用较好的指标,因此,常用作辅助判定硝酸盐污染来源[30]。Cl-可能来自于母岩风化、大气沉降、农用化肥(如KCl)以及污水排放,由于该地区很少施用含氯肥料,因此,污水及粪肥被认为是该区域Cl-的主要来源。枯水期和丰水期Cl-范围分别为12.35~62.02(表2)和10.57 ~ 44.07 mg/L(表3),均值分别为49.86和35.46 mg/L,枯水期的Cl-值普遍高于丰水期,这可能主要是由于丰水期雨水的稀释作用。从图2可以看出,店埠河源头区(S1)NO3-和Cl-浓度较低,表明该地区受人类活动影响较小,随着河流流经传统农耕区和城镇生活区,沿岸含有较高浓度的NO3-和Cl-的农业用水、生活污水或工业废水汇入店埠河,导致河水NO3-和Cl-的浓度不断升高。研究发现,枯水期整个河段水体的NO3-与Cl-浓度之间呈显著正相关(P<0.05)(y=0.132x-2.978,R2=0.710,n=17)(图2),且Cl-浓度较高,表明粪肥污水可能对水体NO3-浓度有较大贡献;丰水期上游区域NO3-与Cl-浓度之间无显著相关(P>0.05)(y=0.067x-0.985,R2=0.236,n=9),并且Cl-浓度较低,这说明上游区域水体NO3-受到多种污染源的共同影响,而中下游区域其相关性较好(y=0.127x-1.293,R2=0.802,n=8),表明粪肥污水是NO3-的重要来源。
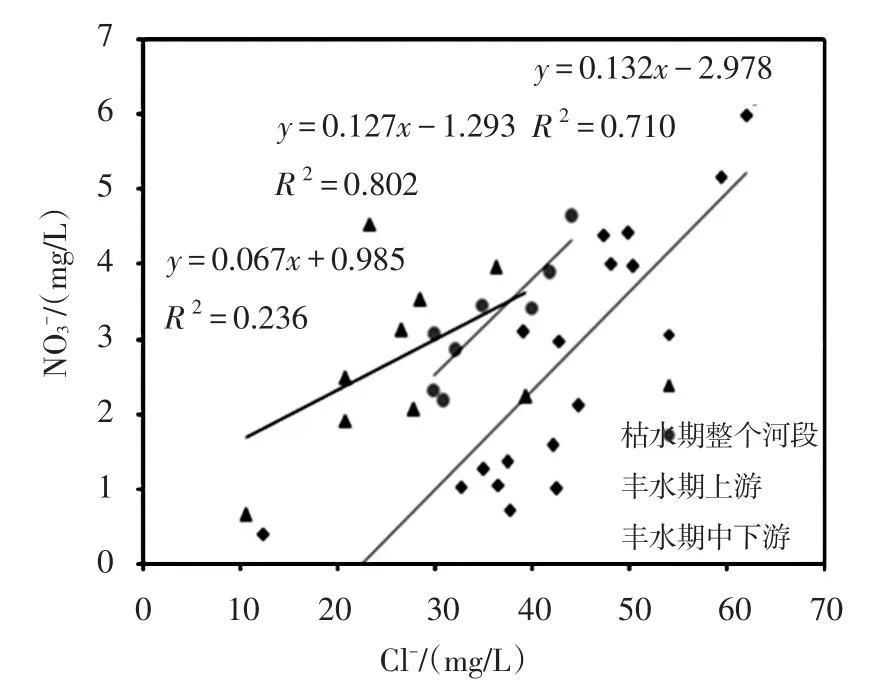
图2 店埠河河水NO3-和Cl-浓度变化相关关系
店埠河水体δ15N-NO3-和 δ18O-NO3-在丰水期的变化范围分别为1.98‰~9.12‰和5.11‰~11.86‰,均值分别为5.02‰和9.17‰;在枯水期的变化范围分别为3.89‰~9.35‰和1.46‰~7.53‰,均值分别为6.38‰和4.50‰。将店埠河河水、雨水和粪肥污水的δ15N-NO3-和δ18O-NO3-的值在典型来源的硝酸盐δ15N和δ18O分布图中表示[31-32](图3),可以发现,店埠河水体硝酸盐同位素主要分布在粪肥污水、土壤有机氮以及化肥区间,说明粪肥污水、土壤有机氮以及化肥是店埠河水体NO3-的主要来源。

图3 典型硝酸盐端元组分氮、氧同位素范围及店埠河河水硝酸盐氮、氧关系分布
从整体上看,各采样点丰水期δ15N-NO3-值低于枯水期,而δ18O-NO3-的值却较高。这可能与丰水期丰沛的降雨有关。相对粪肥污水和土壤有机氮而言,大气氮沉降具有较低δ15N-NO3-和较高δ18O-NO3-的特征值[33],因此,丰水期大气氮沉降对店埠河水体NO3-贡献不容忽视。研究还发现,无论是丰水期还是枯水期,中下游区域水体δ15N-NO3-的值不仅比较高,且变化区间较窄,这就更进一步证明,粪肥污水是中下游区域水体硝酸盐的主要污染源。而上游区域水体δ15N-NO3-的值不仅较低,而且变化区间较宽,这意味着其NO3-来源于多种污染源。
大气沉降、合成化肥和硝化作用下δ15N-NO3-的值存在着重叠现象,但其δ18O-NO3-的值有着不同的变化区间[31],因此,运用δ18O-NO3-可以有效的区分这3种污染源。本研究区域,根据理论推算得由硝化反应生成的硝酸盐中的δ18O的变化范围是-0.1‰到+9.2‰。可看出,绝大多数δ18O-NO3-值都在微生物硝化作用的范围,却有少量的δ18O值却高于理论推算的最高值。可能存在以下两方面的原因,一方面是较高δ18O特征值大气降水的输入,丰水期的δ18O-NO3-值较枯水期高恰恰验证了这一点;另一方面,在硝化反应的过程中,周围环境中水的δ18O由于蒸发或者呼吸作用而发生了同位素的分馏效应,使得其δ18O的值有所提高,或者在硝化过程中氧元素已经发生了同位素分馏[31,34],从而使得实际测得由硝化作用产生的硝酸盐δ18O值高于理论推算的最高值。
因此,初步判定,店埠河上游水体NO3-主要来源于化肥、粪肥污水以及土壤有机氮的硝化,而粪肥污水则是中下游水体中NO3-的主要来源。丰水期大气氮沉降对店埠河水体硝酸盐的贡献也不容忽视。
3.4 店埠河硝酸盐来源的定量解析自然界中N在迁移转化过程中N、O同位素会因为一系列物理、化学和生物反应而发生分馏,使得水环境中的NO3-同位素组成并不能精确反应出其来源的同位素组成[10],其中微生物的反硝化作用对同位素组成的影响十分显著。反硝化作用将水体中的NO3-转化成N2和N2O,同时导致水体中剩余的NO3-的δ15N值会随NO3-浓度的变化呈指数增加,且δ18O与δ15N的比值在1∶1.3~1∶2.1之间[33,35-36]。因此,识别反硝化作用的发生与否是用同位素方法识别硝酸盐来源的一个重要前提。在本研究中,店埠河水体NO3-浓度和δ15N-NO3-、δ18O-NO3-并不存在明显的反相关关系,说明河流可能没有发生明显的反硝化作用。并且δ15N-NO3-和δ18O-NO3-之间不存在明显的正相关关系,这进一步说明了研究区河水没有经历明显的反硝化作用。这可能与采样点所处的水环境有关,采样期间各采样点DO的范围为3.46~11.51 mg/L,平均值为6.39 mg/L,不利于反硝化作用的发生。
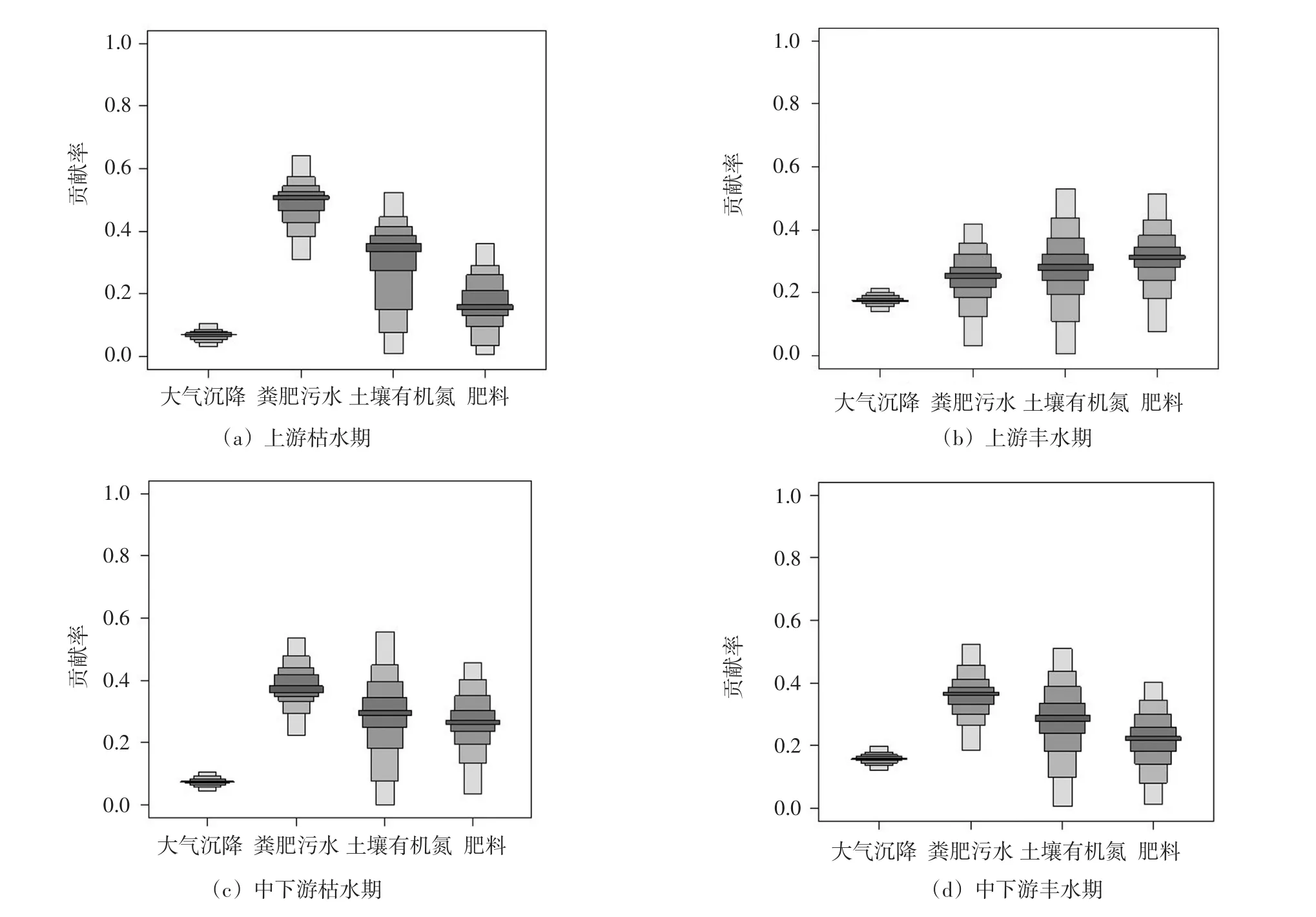
图4 利用SIAR模型计算4类污染源对店埠河水体的贡献率(箱线图图例从浅到深表明5%、25%、50%、75%和95%的比例)
本研究采用SIAR模型计算4类污染源(大气沉降源(AD),粪肥污水源(M&S),化肥源(NF)和土壤源(NS))对店埠河水体NO3-的贡献率。各种源的初始同位素特征的均值和方差见表1,根据上文分析,店埠河水体不存在明显的微生物反硝化作用,因此公式(1)中分馏系数Cjk=0。SIAR采用的是Dirichlet分布作为独立的源信息输入,且各源的贡献率之和为1。
根据SIAR模型的输出结果,4类污染源对店埠河水体NO3-的贡献比率具有较大的差异性(图4)。店埠河上游水体NO3-在枯水期主要来源于粪肥污水,其贡献率为38%,土壤有机氮和化肥的贡献率分别为29%和26%,大气氮沉降的贡献率比较小,仅为7%;丰水期时上游水体NO3-主要来源于化肥,其贡献率为30%,粪肥污水和土壤有机氮的贡献率分别为28%和24%,丰沛的降雨使得大气氮沉降的在丰水期贡献率比重增加到18%。中下游区域,4类污染源在枯、丰水期的贡献比例分别为:粪污(48%)>土壤有机氮(27%)>化肥(18%)>大气氮沉降(7%)和粪污(36%)>土壤有机氮(27%)>化肥(22%)>大气氮沉降(16%)。综合来看,4类污染源对店埠河水体NO3-的贡献比率分别为:大气沉降源7%~18%,土壤源24%~29%,化肥源18%~30%,粪肥污水源28%~48%。不难发现,利用SIAR模型定量分析的结果与上述定性分析的结果是一致的。根据河流流域空间布局,店埠河上游应重点控制面源污染输入的养殖废水、人畜粪便以及农业化肥,中下游则应重点防控城镇生活污水和工业废水,可有效降低入湖河流硝酸盐的污染负荷。
4 结论
(1)店埠河水体各形态氮浓度具有很强的时空变异性。上游区域水体TN和NO3--N在丰水期的平均浓度显著高于枯水期,NH4+-N则是枯水期较丰水期高;而中下游区域TN、NO3--N和NH4+-N在丰水期的平均浓度显著低于枯水期。水体无机氮主要以NO3--N形态存在,而污水则以NH4+-N为主。(2)通过水体δ15N-NO3-和δ18O-NO3-同位素组成判定,店埠河水体上游区域水体NO3-主要来源于粪肥污水,化肥以及土壤有机氮,而中下游区域水体则主要来自于粪肥污水,另外,丰水期时大气氮沉降对水体NO3-的影响不容忽视。(3)店埠河水体未经历明显的反硝化作用。通过SIAR模型计算,4类污染源对店埠河水体NO3-的贡献比率分别为:大气沉降源7%~18%,土壤源24%~29%,化肥源18%~30%,粪肥污水源28%~48%。根据河流流域空间布局,店埠河上游应重点控制面源污染输入的养殖废水、人畜粪便以及农业化肥,中下游则应重点防控城镇生活污水和工业废水,可有效降低入湖河流硝酸盐的污染负荷。虽然目前利用不同来源的NO3-中δ15N和δ18O含量不同来对NO3--N进行溯源,并通过SIAR模型确定多种污染源的贡献率已得到广泛的应用,但其计算结果仍存在很大的不确定性。SIAR需要完整的污染源信息,如果源信息不完整,则会将未知源信息包含的贡献率分摊给已知的污染源。加之氮在水体迁移转化过程中复杂的同位素分馏均会对15N和18O的值造成影响,从而给示源结果带来一定的偏差。因此,在以后的研究中,研究者应该更加注重探讨氮氧同位素分馏系数在污染源-河道迁移过程中的变化情况,并进一步对模型进行优化,进而提高量化识别的精度。
参 考 文 献:
[1] MCISAAC G F,DAVID M B,GERTNER G Z,et al.Eutrophication:nitrate flux in the Mississippi River[J].Nature,2001,414(6860):166-167.
[2] MEYBECK M.Carbon,nitrogen,and phosphorus transport by word rivers[J].American Journal of Science,1982,282(4):401-450.
[3] DEUTSCH B,MEWES M,LISKOW I,et al.Quantification of disuse nitrate inputs into a small river system us⁃ing stabe isotopes of oxygen and nitrogen in nitrate[J].Organic Geochemistry,2006,37:1333-1342.
[4] NESTLER A,BERGLUND M,ACCOE F,et al.Isotopes for improved management of nitrate pollution in aque⁃ous resources:Review of surface water field studies[J].Environmental Science and Pollution Research,2011,18:519-533.
[5] XUE D M,BAETS B D,CLEEMPUT O V,et al.Use of Bayesian isotope mixing model to estimate proportional contributions of multiple nitrate sources in surface water[J].Environmental Pollution,2012,161:43-49 .
[6] FEWTRELL L.Drinking-water nitrate,methemoglobinemia,and global burden of disease:A discussion[J].Environmental Health Perfectives,2004,112(14):1371-1374.
[7] 邢光熹,施书莲,杜丽娟,等.苏州地区水体氮污染状况[J].土壤学报,2001,38(4):540-546.
[8] PETITTA M,FRACCHIOLLA D,ARAVENA R,et al.Application of isotopic and geochemical tools for the eval⁃uation of nitrogen cycling in an agricultural basin,the Fucino Plain,Central Italy[J].Journal of Hydrology,2009(1/4):124-135.
[9] 贺缠生,傅伯杰,陈利顶.非点源污染的管理及控制[J].环境科学,1998,19(5):87-91,96.
[10] 丁京涛,席北斗,许其功,等.稳定同位素技术在地表水硝酸盐污染研究中的应用[J].湖泊科学,2013,25(5):617-627.
[11] JOHANNSEN A,DÄHNKE K,EMEIS K.Isotopic composition of nitrate in five German rivers discharging into the North Sea[J].Organic Geochemistry,2008,39:1678-1689.
[12] REN Y F,XU Z W,ZHANG X Y,et al.Nitrogen pollution and source identification of urban ecosystem surface water in Bejing[J].Frontiers of Environmental Science&Engineering,2014,8(1):106-116.
[13] 贺国平,刘培斌,慕星,等.永定河冲积扇地下水中硝酸盐来源的同位素识别[J].水利学报,2016,47(4):585-588.
[14] 金赞芳,龚嘉临,施伊丽,等.沉积物-水界面氮的源解析和硝化反硝化[J].环境科学,2017,38(4):1423-1430.
[15] ZHANG Y C,MA R H,ZHANG M,et al.Fourteen-year record(2000-2013)of the spatial and temporal dy⁃namics of floating algae blooms in Lake Chaohu,observed from time series of Modis images[J].Remote Sensing,2015,7(8):10523-10542.
[16] 李超,王丹,杨金燕,等.巢湖沉积物有效磷的原位高分辨分析研究[J].环境科学,2015,36(6):2077-2084.
[17] 奚姗姗,周春财,刘桂建,等.巢湖水体氮磷营养盐时空分布特征[J].环境科学,2016,37(2):542-547.
[18] 李如忠,汪家权,钱家忠.巢湖流域非点源营养物控制对策研究[J].水土保持学报,2004,18(1):119-121,129.
[19] 朱骏,董辉,王寿兵,等.长江三峡库区干流水体主要污染负荷来源及贡献[J].水科学进展,2006,17(5):709-713.
[20] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[21] XU C Y,LI Y,LI Q Z,et al.Measurement of15N and18O isotope abundance of nitrate using denitrifier method on Tracegas-Isotope Ratio Mass Spectrometry[J].Advances in Materials Research,2013,726/731:1346-1349.
[22] PARNELL A C,INGER R,BEARHOP S,et al.Source portioning using stable isotopes:coping with too much variation[J].PLos ONE,2010,5(3):e9672 .
[23] RIVETT M O,BUSS S R,MORGAN P,et al.Nitrate attenuation in groundwater:a review of biogeochemical controlling processes[J].Water Res.,2008,42:4215-4232.
[24] IAEA(International Atomic Energy Agency).Statistical Treatment of Environmental Isotope Data in Precipitation[M].2nd ed.Vienna:International Atomic Energy Agency,1992.
[25] 石春娥,邓学良,杨元建,等.1992-2013年安徽省酸雨变化特征及成因分析[J].南京大学学报:自然科学,2015,51(3):508-516.
[26] 刘玉年.淮河中游水质时空变异研究[J].水资源保护,2009,25(4):1-4.
[27] YANG L P,HAN J P,XUE J L,et al.Nitrate source apportionment in a subtropical watershed using Bayesian mode[lJ].Science of the Total Environment,2013,463/464:340-347.
[28] WHO.Guidelines for Drinking Water Quality[M].3rd ed.Geneva:World Health Organization,2008.
[29] KELLMAN L,HILLAIRE-MARCEL C.Nitrate cycling in streams:using naturalabundances of NO3-to measure in-situ to denitrification[J].Biogeochemistry,1998,43:273-292.
[30] LIU C Q,LI S L,LANG Y C,et al.Using δ15N and δ18O to identify nitrate sources in karst ground water,Gui⁃yang,Southwest China[J].Environmental Science&Technology,2006,40:6928-6933.
[31] KENDALL C,McDONNELL J J.Isotope Tracers in Catchment Hydrology[M].Amsterdam:Elsevier,Science,1998.
[32] BURNS D A,KENDALL C.Analysis of δ15N and δ18O todifferentiate NO3-sources in runoff at two watersheds in⁃the Catskill Mountains of New York[J].Water Resources Research,2002,38:9-1,9-11.
[33] XUE D M,BOTTE J,BAETS B D,et al.Present limitations and future prospects of stable isotope methods for ni⁃trate source identification in surface and groundwater[J].Water Research,2009,43:1159-1170 .
[34] MAYER B,BOLLWERK S M,MANSFELDT T,et al.The oxygen isotope composition of nitrate generated by ni⁃trification in acid forest floors[J].Geochimica et CosmochimicaActa,2001,65:2743-2756 .
[35] BURNS D A,BOYER E W,ELLIOTT E M,et al.Sources and transformations of nitrate from streams draining varying land uses :evidence from dual isotope analysis[J].Journal of Environmental Quality,2009,38:1149-1159.
[36] MENGIS M,SCHIFF S L,HARRIS M,et al.Multiple geochemical and isotopic approaches for assessing ground water NO3-elimination in a riparian zone[J].Ground Water,1999,37(3):448-457.
