开花期干旱胁迫对向日葵叶片活性氧代谢的影响
2017-05-06杨恒山刘金刚崔良基
曹 倩,杨恒山,依 兵,刘金刚,崔良基
(1.内蒙古民族大学农学院,内蒙古通辽 028000; 2.辽宁省农业科学院作物研究所,辽宁沈阳 110161)
开花期干旱胁迫对向日葵叶片活性氧代谢的影响
曹 倩1,杨恒山1,依 兵2,刘金刚2,崔良基2
(1.内蒙古民族大学农学院,内蒙古通辽 028000; 2.辽宁省农业科学院作物研究所,辽宁沈阳 110161)
以抗旱型向日葵恢复系(TR5)和干旱敏感型向日葵恢复系(SR2)为材料,在开花期干旱胁迫条件下对其叶片的ASAR、HRS、H2O2、MDA、POD、CAT和SOD进行比较分析,探讨干旱胁迫下不同抗旱性向日葵叶片活性氧代谢差异。试验结果表明:随着开花期干旱的持续,TR5和SR2叶片中ASAR与对照相比有不同程度的降低,干旱胁迫12 dTR5 ASAR显著高于SR2。干旱胁迫后的前9 d,TR5和SR2的HRS变化差异不显著,干旱第12 d两个恢复系的HRS较对照降低,SR2降幅大于TR5。开花期干旱导致TR5和SR2叶片中H2O2和MDA含量增加,随着干旱的持续两个恢复系的H2O2和MDA含量与对照相比增加幅度不同,SR2受干旱胁迫影响大于TR5。TR5和SR2叶片中POD、CAT和SOD活性受开花期干旱胁迫影响存在较大差异,但干旱条件下TR5叶片中POD、CAT和SOD活性始终高于SR2,并且能保持较高的酶活性。
向日葵;干旱胁迫;活性氧;抗氧化酶活性
干旱是影响作物生产的主要非生物胁迫因子之一,对向日葵的产量形成产生巨大的影响。不同生育时期发生干旱,对作物生长发育和产量的影响也有所差异。干旱胁迫导致叶片中产生较高的活性氧,如:超氧阴离子、过氧化氢、羟自由基等,加速膜质过氧化,最终导致细胞膜损伤,蛋白质变性,酶活力降低,色素降解以及DNA结构破坏等一系列细胞衰老过程(Attipalli et al.,2004)。在水分亏缺时,作物可通过自身的活性氧代谢和抗氧化防护系统,减缓干旱胁迫产生大量活性氧对细胞膜和细胞器带来的损伤。有研究表明,在干旱胁迫条件下,不同作物或同一作物不同基因型间其活性氧代谢存在差异,并且抗逆性和抗氧化防护能力之间存在一定的相关性,但目前对作物减缓非生物胁迫损伤的抗氧化防护机理的研究并不完善(Zhang et al.,2007)。因此,深入研究向日葵叶片抗氧化防护系统可有效减轻干旱条件下产生大量活性氧对组织的伤害,对提高向日葵的抗旱性具有重要意义。
近年来,关于干旱条件下作物叶片活性氧代谢的研究在水稻(Liu et al.,2008;丁在松等,2012)、玉米(Rainer et al.,2011;张永福等,2015)、小麦(Zadfar et al.,2013;李思等,2015)、大豆(Sonia et al.,2012;李雪凝等,2016)等作物中报道较多,研究指出,干旱条件可以降低保护酶活性,使得活性氧不能被及时清除,对细胞及组织造成伤害,最终导致叶片衰老死亡。关于开花期干旱胁迫下向日葵叶片活性氧代谢的研究尚未见详细报道。本试验以不同抗旱性的向日葵品系为材料,对其在干旱条件下叶片的抗超氧阴离子自由基活力、抑制羟自由基能力、过氧化氢、丙二醛、过氧化物酶、过氧化氢酶和超氧化物歧化酶进行比较分析,探讨干旱胁迫下不同抗旱性向日葵叶片活性氧代谢差异,旨在为向日葵抗旱品种选育和高产优质栽培提供依据。
1 材料与方法
1.1 供试材料
抗旱型恢复系 TR5和干旱敏感型恢复系SR2,试验材料由辽宁省农业科学院作物所向日葵研究室所提供。
1.2 试验设计
试验于2015年5月至2016年11月,在辽宁省农业科学院综合试验基地采用盆栽抗旱棚滴灌控水的方式进行干旱胁迫试验。以抗旱型向日葵恢复系TR5和干旱敏感型向日葵恢复系SR2为供试品种,分别设开花期干旱胁迫(DS)处理,以正常水分供应为对照(CK)。干旱胁迫将土壤质量含水量控制在10%左右(中度干旱,参照GB/T 20481-2006,气象干旱等级),持续12 d,解除胁迫恢复正常水分供应至成熟。正常水分供应,将土壤质量含水量持续控制在17%左右。水分管理采用滴灌方式进行(稳压调节阀流速4 L/h),开花期前各处理水分用量一致,干旱胁迫期间,遇阴雨天利用可移动防雨棚进行覆盖防雨。试验采用完全随机区组设计,每处理24盆,3次重复,共288盆。盆钵直径45 cm,高50 cm,排列方式为大垄双行,大垄行距1.35 m,双行行距0.45 m,种植密度为33 000株/hm2。盆土取自辽宁省农业科学院试验基地旱田耕层,每盆均底施等量优质农家肥和磷酸二铵,现蕾期追施等量尿素。试验分别于干旱胁迫后3 d、6 d、9 d、12 d,利用打孔器对向日葵至上而下第4、5、6片叶分别进行取样,取样后精确称取叶片0.200 g左右,分装于2.0 m l离心管中液氮冷冻,-70℃超低温冰箱保存,用于以下物质和酶活性的测定。
1.3 测定项目
酶液的提取:将叶片样品利用液氮研磨成细粉末,称取0.25 g加1.5 m l提取液[0.1 mol/L磷酸钠(Na2HPO4-NaH2PO4)缓冲液,pH 7.2;2% PVP]。高速冷冻离心机4℃条件下4 000转离心10 min,取上清液用于各项指标的测定。
H2O2含量:钼酸显色法。单位为每克叶片鲜样中含H2O2的毫摩尔量(mmol/g FW)。
丙二醛含量:采用TBA法进行测定。单位为每克叶片鲜样中含MDA的纳摩尔量(nmol/g FW)。
POD活性:取10 m l离心管依次加入2.9 m l 0.05 mol/L磷酸缓冲液,1 m l 2%H2O2,1 m l 0.05 mol/L愈创木酚,0.1 m l酶提取液(以磷酸缓冲液替换酶提取液作为对照)。反应体系置于37℃水浴中反应15 min,然后立即加入2 m l20%三氯乙酸终止反应,以5 000 rpm离心10 m in,取上清液于1 cm比色皿中,测定470 nm吸光度值。POD活性单位定义为在37℃条件下,每g叶片鲜重每min催化1μg H2O2的酶量定义为一个酶活力单位(U/g FW)。
CAT活性:采用可见光法进行测定。取10 m l离心管依次加入1.5 m l 0.2 mol/L磷酸缓冲液,1 m l蒸馏水,0.2 m l酶提取液(以磷酸缓冲液替换酶提取液作为对照)。25℃预热后,加入0.3 m l 0.1 mol/L的H2O2,准确反应60 s,240 nm下测定吸光度值。CAT酶活单位定义为每g叶片鲜样每s分解1μmol H2O2的量为一个酶活力单位(U/g FW)。
SOD活性:采用羟胺法进行测定。每g叶片鲜样在1 m l反应液中SOD抑制率达到50%时所对应的SOD量为一个SOD活力单位(U/g FW)。
抗超氧阴离子自由基活力和抑制羟自由基能力采用南京建成生物工程研究所提供试剂盒进行测定。抗超氧阴离子自由基活力定义为在反应体系中,每g鲜重在37℃反应40 m in所抑制的超氧阴离子自由基相当于1 mg的维生素C所抑制的超氧阴离子自由基的变化值为一个活力单位(U/g FW)。抑制羟自由基能力定义为规定每g叶片鲜重在37℃下反应1 m in,使反应体系中H2O2的浓度降低1 mmol/L为一个抑制羟自由基能力单位位(U/g FW)。
1.4 统计分析
利用Excel 2003对数据进行整理和作图表。采用DPS 7.05进行方差分析和多重比较,多重比较方法为Duncan’s新复极差法。
2 结果与分析
2.1 抗氧化能力差异
2.1.1 抗超氧阴离子自由基活力(Anti-superoxide anion radical activity,ASAR)
如图1所示,随着干旱处理时间的推移,TR5和SR2的抗超氧阴离子自由基活力与对照相比有不同程度的降低。开花期干旱胁迫3 d,TR5的抗超氧阴离子自由基活力与对照相比降低13.24%,差异极显著,而SR2降低12.71%,差异显著。开花期干旱胁迫6 d,TR5和SR2的抗超氧阴离子自由基活力与对照相比分别降低20.05%和18.71%,差异极显著。开花期干旱胁迫9 d,TR5和SR2的抗超氧阴离子自由基活力与对照相比分别降低15.59%和15.49%,差异极显著。开花期干旱胁迫12 d,TR5的抗超氧阴离子自由基活力与对照相比降低9.42%,差异显著,而SR2降低5.19%,差异不显著。在3 d、6 d和9 d的干旱胁迫条件下,TR5的叶片抗超氧阴离子自由基活力与SR2相比无显著差异(p值分别为0.086 1、0.357 5、0.816 3),而开花期干旱胁迫12 d,干旱条件下TR5的叶片抗超氧阴离子自由基活力比SR2高11.41%,差异显著。
2.1.2 抑制羟自由基能力(Hydroxyl free radical scavenging capacity,HRS)
在干旱胁迫处理和无水分胁迫处理条件下,不同抗旱型向日葵恢复系之间相比,叶片抑制羟自由基能力均差异不显著。如图2所示,开花期干旱胁迫3 d,TR5和SR2的抑制羟自由基能力与对照相比呈增加趋势,分别增加8.79%和8.73%,但差异不显著。开花期干旱胁迫6 d、9 d,TR5和SR2的抑制羟自由基能力与对照相比均有所降低,差异不显著(p值分别为0.093 2和0.148 5)。开花期干旱胁迫12 d,TR5和SR2的抑制羟自由基能力与对照相比呈增加趋势,分别增加18.09%和18.34%,差异极显著。
2.2 过氧化氢含量(Hyd rogen peroxide,H2O2)
如图3所示,开花期干旱胁迫导致不同向日葵叶片中H2O2含量增加,不同干旱处理时长,使得不同抗旱型向日葵恢复系H2O2含量与对照相比增加幅度不同,SR2的叶片中H2O2含量受干旱胁迫影响增加幅度大于TR5。
开花期干旱胁迫3 d,TR5叶片中H2O2含量与对照相比增加39.58%,差异极显著,SR2叶片中H2O2含量与对照相比降低12.10%,差异极显著。干旱胁迫下,SR2叶片中H2O2含量与TR5相比高33.33%,差异极显著。开花期干旱胁迫6 d,TR5和SR2叶片中H2O2含量与对照相比分别高16.20%和25.09%,差异均极显著,但相同处理条件下,TR5与SR2叶片中H2O2含量相比差异均不显著(p=0.393 6)。开花期干旱胁迫9 d,TR5和SR2的叶片中H2O2含量与对照相比呈增加趋势(p=0.000 4),TR5叶片中H2O2含量比对照高12.85%,差异显著,而SR2高23.39%,差异极显著。开花期干旱胁迫12 d,TR5和SR2叶片中H2O2含量与对照相比分别高59.56%和18.74%,差异均极显著。
2.3 丙二醛含量(M ethane d icarboxy lic aldehyde,M DA)
由图4可以看出,干旱胁迫使得不同抗旱型向日葵恢复系叶片中的MDA含量增加,随着干旱处理的时间延续,叶片中MDA含量增加幅度不断变大,并且SR2的增加幅度大于TR5。
开花期干旱胁迫3 d,TR5和SR2叶片中MDA含量与对照相比分别增加223.6%和275.7%,差异均极显著。干旱处理条件下,TR5叶片MDA含量与SR2相比低22.58%,且差异极显著,正常供水条件下,TR5和SR2的叶片中MDA含量差异不显著。干旱胁迫6 d,TR5和SR2叶片中MDA含量与对照相比分别增加282.4%和296.6%,差异均极显著。无论是正常供水还是干旱胁迫条件下TR5与SR2相比MDA含量均差异不显著。干旱胁迫9 d,TR5和SR2叶片中MDA含量与对照相比分别增加308.2%和335.6%,差异均极显著。干旱处理条件下,TR5叶片MDA含量与SR2相比低11.78%,且差异极显著,正常供水条件下,TR5和SR2的叶片中MDA含量差异不显著。干旱胁迫12 d,TR5和SR2叶片中MDA含量与对照相比分别增加336.3%和447.1%,差异均极显著。干旱处理条件下,TR5叶片MDA含量与SR2相比低24.19%,且差异极显著,正常供水条件下,TR5和SR2的叶片中MDA含量差异不显著。
2.4 抗氧化酶活性
2.4.1 过氧化物酶活性(Peroxidase,POD)
干旱胁迫条件激活了叶片中POD活性,不同抗旱型向日葵材料叶片中POD活性对干旱胁迫的响应有所不同。正常供水条件下,TR5和SR2叶片中POD活性差异不显著。干旱处理各时长TR5的POD活性均高于SR2,在干旱6 d、9 d和12 d差异极显著。干旱条件下TR5的POD活性与对照相比均呈增加趋势,但增幅随着干旱时间的增长逐渐变小。干旱胁迫3 d、6 d、9 d和12 d条件下,TR5叶片中POD活性与对照相比分别增加55.73%、45.69%、15.83%和14.31%,差异极显著。开花期干旱条件下的SR2叶片中POD活性与对照相比表现为先增加又降低的趋势,干旱胁迫3 d和6 d,POD活性分别增加64.78%和26.90%,差异极显著;干旱胁迫9 d,叶片中POD活性开始下降,但差异不显著;干旱胁迫12 d,POD活性与对照相比降低34.19%,差异极显著。由此可见,开花期干旱胁提高了向日葵叶片中的POD活性,以减缓活性氧物质对叶片的损伤程度,并延缓叶片的衰老。不同抗旱型向日葵恢复系其叶片中POD活性的激活和持续时间存在较大差异,干旱条件下TR5叶片中POD活性均高于SR2,并且维持较高POD活性持续时间较长。

图1 开花期干旱胁迫下向日葵叶片抗超氧阴离子自由基活力的差异Figure 1 Differences of an ti-superoxide anion radical(ASAR)activity in sunflower leaves under drought stress at flowering stage
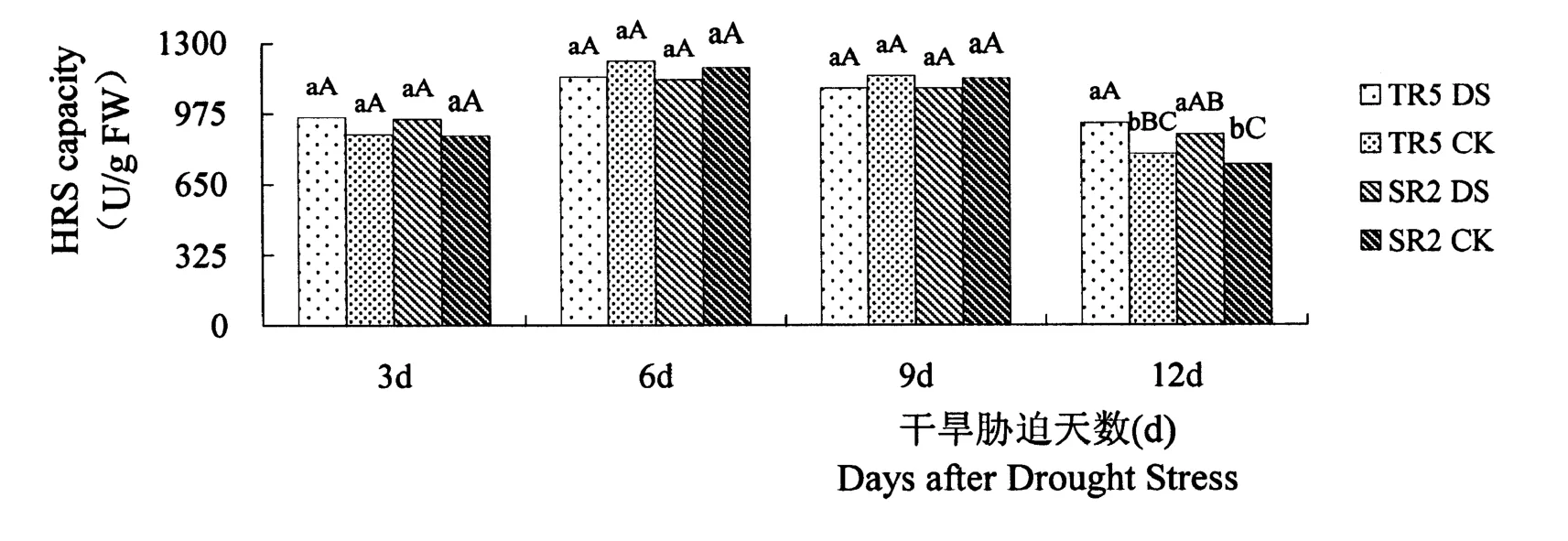
图2 开花期干旱胁迫下向日葵叶片抑制羟自由基能力的差异Figure 2 Differences of hydroxyl free radical scavenging(HRS)capacity in sunflower leaves under d rought stress at flowering stage
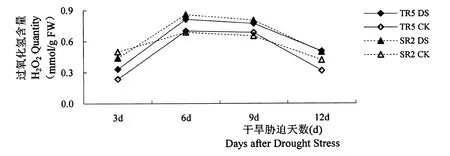
图3 开花期干旱胁迫下向日葵叶片中过氧化氢(H2O2)含量的差异Figure 3 Differences of hyd rogen peroxide(H2O2)quantity in sun flower leaves under d rought stress at flow ering stage

图4 开花期干旱胁迫下向日葵叶片中丙二醛(M DA)含量的差异Figure 4 Differences ofm alondialdehyde(M DA)quantity in Sun flower leaves under drought stress at flowering stage
2.4.2 过氧化氢酶活性(Catalase,CAT)
叶片中CAT活性随干旱时间呈先降低又升高再降低的趋势,TR5和SR2叶片中CAT活性对开花期干旱胁迫的响应有所差异,干旱胁迫下TR5叶片中CAT活性高于SR2。开花期干旱胁迫3 d,TR5和SR2叶片中CAT活性与对照相比呈降低趋势(p=0.000 1),TR5降低7.31%,差异不显著,SR2降低58.24%,差异极显著,并且SR2降幅大于TR5,干旱条件下TR5叶片中CAT活性与SR2相比高145.8%,差异极显著。开花期干旱胁迫6 d,TR5和SR2叶片中CAT活性与对照相比呈增强趋势(p=0.000 8),TR5的CAT活性增加18.53%,差异极显著,SR2增加14.20%,差异显著,并且TR5增幅大于SR2,干旱条件下TR5叶片中CAT活性与SR2相比高8.01%,差异不显著。开花期干旱胁迫9 d,TR5和SR2叶片中CAT活性与对照相比呈增强趋势(p=0.003 4),分别增加12.89%和12.28%,差异显著。开花期干旱胁迫12 d,TR5和SR2叶片中CAT活性与对照相比呈降低趋势(p=0.000 1),TR5降低78.11%,差异极显著,SR2降低48.73%,差异极显著,干旱条件下TR5叶片中CAT活性与SR2相比高7.71%,差异不显著。
2.4.3 超氧化物歧化酶活性(Superoxide dismutase,SOD)
向日葵叶片中SOD活性,受开花期干旱胁迫的影响呈降低的趋势。随着干旱时间的持续,SOD活性与对照相比降幅逐渐增,干旱后期SR2叶片中SOD活性受影响大于TR5。开花期干旱胁迫3 d,SR2的SOD活性与对照相比降低10.94%,差异显著。开花期干旱胁迫9 d,TR5叶片中SOD活性与对照相比降低9.24%,差异显著。开花期干旱胁迫12 d,TR5和SR2的叶片中SOD活性与对照相比分别降低13.86%和30.11%,差异极显著。正常供水条件下,两材料的SOD活性变化差异较小,差异不显著。干旱12 d,TR5叶片中SOD活性与SR2相比高27.81%,差异极显著。
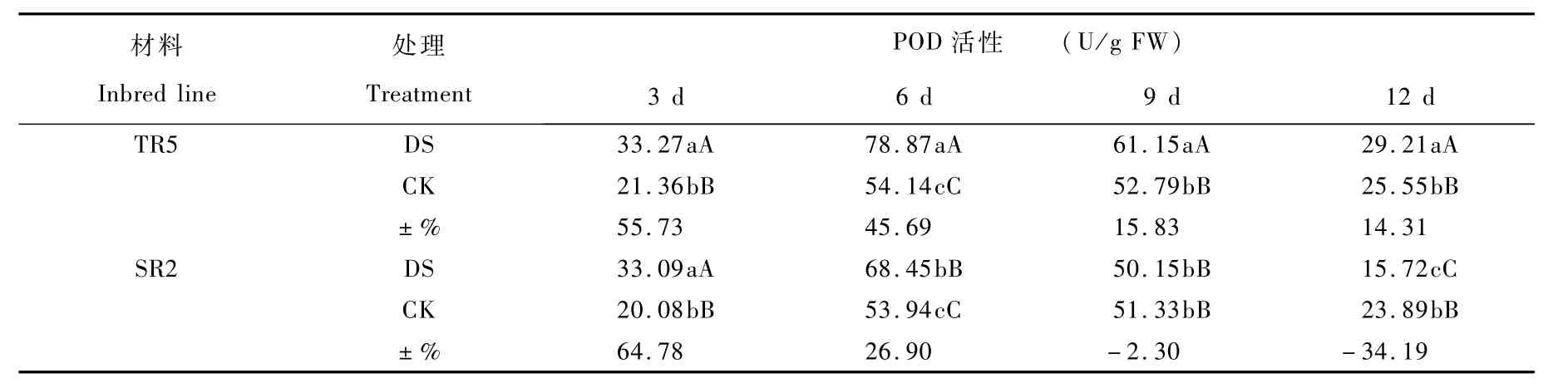
表1 开花期干旱胁迫对不同抗旱型向日葵叶片中POD活性的影响Table 1 Effect on POD activity in sunflower leaves under d rought stress at flowering stage
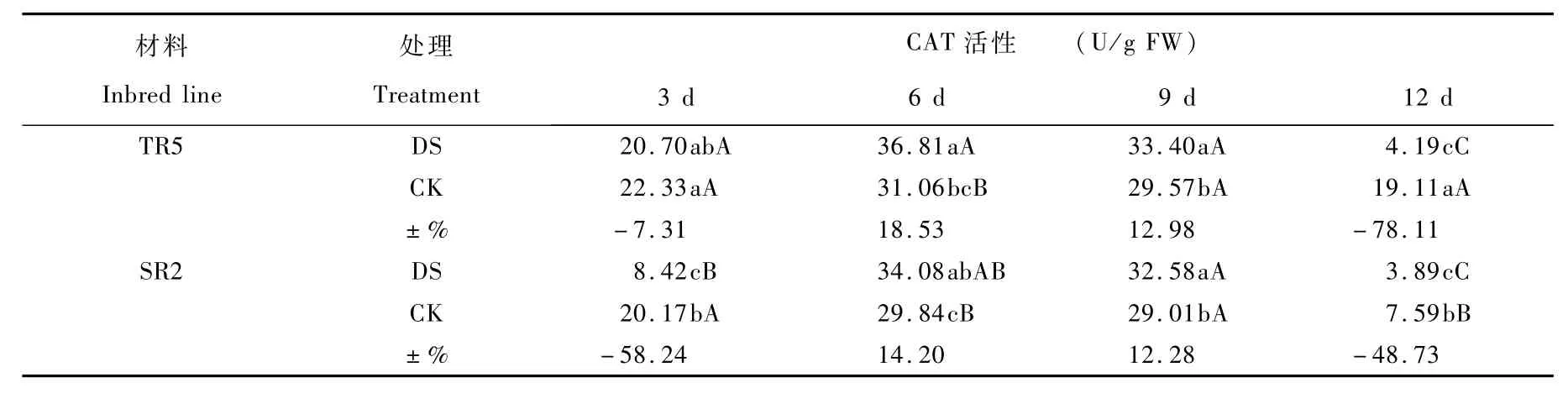
表2 开花期干旱胁迫对不同抗旱型向日葵叶片中CAT活性的影响Tab le 2 Effect on CAT activity in sun flower leaves under d rought stress at flow ering stage

表3 开花期干旱胁迫对不同抗旱型向日葵叶片中SOD活性的影响Tab le 3 Effect on SOD activity in sunflower leaves under d rough t stress at flowering stage
3 结论与讨论

干旱胁迫产生大量的活性氧使MDA含量增加,MDA含量被认为是氧化损伤的指标(Moller et al.,2007)。MDA是质膜过氧化适合的标记物。膜稳定性的降低反映了由活性氧引起的脂质过氧化的程度。此外,膜质过氧化是组织中自由基反应的普遍性的指标。氧气的吸收和H2O2是作物组织产生活性氧的两个来源,特别是光呼吸在过氧化物酶体中的乙醇酸氧化酶作用下产生的大量H2O2。本试验研究表明,开花期干旱胁迫导致不同向日葵叶片中H2O2含量增加,不同干旱处理时长,使得不同抗旱型向日葵恢复系H2O2含量与对照相比增加幅度不同,SR2的叶片中H2O2含量受干旱胁迫影响增加幅度大于TR5。干旱胁迫使得不同抗旱型向日葵恢复系叶片中的MDA含量增加,随着干旱处理的时间延续,叶片中MDA含量增加幅度不断变大,并且SR2的增加幅度大于TR5。干旱敏感型恢复系SR2受干旱胁迫影响产生活性氧物质较多,膜质过氧化程度较高,而抗旱型自交系受干旱胁迫影响相对较小。

综上所述,开花期干旱胁迫对向日葵叶片活性氧代谢产生了影响,并且不同抗旱型向日葵恢复系对干旱胁迫的反映存在差异。随着干旱胁迫时间的持续,向日葵叶片最终均受到损伤,但TR5受影响小于SR2,干旱后期TR5的抗氧化酶活性均高于SR2,膜质过氧化程度相对较小,仍能保持较高抗氧化能力。
[1] Apel K,H irt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction[J].Annu.Rev.Plant Biol.,2004,55:373~399.
[2] Attipalli Ramachandra Reddya,Kolluru Viswanatha Chaitanyaa,Munusamy Vivekanandanb.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J].Journal of Plant Physiology,2004,161(11):1189~1202.
[3] Aying Zhang,Mingyi Jiang,Jianhua Zhang,et al.Nitric oxide induced by hydrogen peroxide mediates abscisic acid-induced activation of the mitogen-activated protein kinase cascade involved in antioxidant defense in maize leaves[J].New Phytologist,2007,175(1):36~50.
[4] Farooq M,Wahid A,Kobayashi N,et al.Plant drought stress:effects,mechanisms and management[J].Agron.Sustain.Dev.,2009,29:185~212.
[5] Horváth E,Pál M,Szalai G,et al.Exogenous 4-hydroxybenzoic acid and salicylic acid modulate the effect of short-term drought and freezing stress on wheat plants[J].Biol.Plant.,2007,51:480~487.
[6] LIU Yu-feng,GAO Guo-qing,LI Dao-yuan.Comparison on physio-biochemical characteristics of different varieties under drought stress[J].Guangxi Agricultural Sciences,2008,39(4):456~461.
[7] Mittler R.Oxidative stress,antioxidants and stress tolerance[J].Trends Plant Sci.,2002(7):405~410.
[8] Moller IM,Jensen PE,Hansson A.Oxidative modifications to cellular components in plants[J].Annu.Rev.Plant Biol.,2007,58:459~481.
[9] Rainer Messmer,Yvan Fracheboud,Marianne B?nziger,et al.Drought stress and tropicalmaize:QTLs for leaf greenness,plant senescence,and root capacitance[J].Field Crops Research,2011,124:93~10.
[10] Samarah NH,Alqudah AM,Amayreh JA,et al.The effect of late-terminal drought stress on yield components of four barley cultivars[J].J.Agron.Crop Sci.,2009,195:427~441.
[11] Shigeoka S,Ishikawa T,Tamoi M,et al.Regulation and function of ascorbate peroxidase isoenzymes[J].J.Exp.Bot.,2002,53:1305~1319.
[12] Sonia Silvente,Anatoly P.Sobolev,et al.Metabolite adjustments in drought tolerant and sensitive soybean genotypes in response to water stress[J].PLoS ONE,2012,7(6):e38554.
[13] Zadfar P,GolabadiM.Genetic variability assessment in bread wheat(Triticum aestivum L.)cultivars under different drought stress treatments using multivariate statistical analysis[J].International Journal of Agriculture Innovations and Research,2013,2(3):369~372.
[14] 丁在松,周宝元,孙雪芳,等.干旱胁迫下PEPC过表达增强水稻的耐强光能力[J].作物学报,2012,38(2):285~292.
[15] 李思,张莉,姚雅琴.干旱对冬小麦叶片气孔、活性氧和光合作用的影响[J].河北大学学报(自然科学版),2015,35(5):44~50.
[16] 李雪凝,董守坤,刘丽君,等.干旱胁迫对春大豆超氧化物歧化酶活性和丙二醛含量的影响[J].中国农学通报,2016,32(15):93~97.
[17] 郁飞燕,张联合,李艳艳,等.干旱胁迫对水稻种子萌发的影响[J].山东农业科学,2011(8):36~39.
[18] 张永福,黄鹤平,银立新,等.冷(热)激对干旱胁迫下玉米活性氧清除及膜脂过氧化的调控机制[J].江苏农业科学,2015(5):56~60.
Effects of Drought Stress on Active Oxygen Metabolism of Sunflower Leaves at Flowering Stage
CAO Qian,YANG Heng-shan,YIBing,LIU Jin-gang,CUILiang-ji
(1.Agronomy College of Inner Mongolia University For The Nationlities,Tongliao,Inner Mongolia 028000; 2.Corp Research Institute of Liaoning Academy of Agricultural Sciences,Shenyang,Liaoning 110161)
Use drought resistant sunflower restorer line(TR5)and drought sensitive sunflower restorer line(SR2)to study on T-AOC、ASAR、HRS、H2O2content、MDAcontent、POD activties、CAT activties and SOD activties.To investigate the active oxygen metabolism in leaves of different drought-resistant sunflower under drought stress.The results showed that with the persistence of drought at flowering stage,ASAR in TR5 and SR2 leaves decreased compared with the control,and ASAR of TR5 leaves was significantly higher than that of SR2 during drought stress for 12 days.There was no significant difference in HRS between TR5 and SR2 before the 9 th day after drought stress.HRS of the two restorers on the 12 th day of droughtwas lower than that of the control.The quantity of H2O2and MDA in the leaves of TR5 and SR2 increased with the drought at the flowering stage.As the drought continued H2O2and MDA contents of two restorers have different enhanced,SR2 ismore affected by drought stress than TR5.The activities of POD,CAT and SOD in TR5 and SR2 leaves were significantly different under drought stress,but the activity of POD,CAT and SOD in TR5 leaves was higher than that in SR2,and to maintain a high enzyme activity.
Sunflower;Drought stress;Reactive oxygen species;Anti-oxidative enzyme activities
S565.5;S311
A
1002-1728(2017)02-0001-08
10.3969/j.issn.1002-1728.2017.02.001
2017-02-27
辽宁省科学事业公益研究人才培养项目(GY2015-B-013);国家向日葵产业技术体系建设项目(CARS-16)
曹倩(1987-),女,在读硕士研究生。E-mail:461113708@qq.com
崔良基(1964-),男,研究员,主要从事向日葵耕作制度和育种研究。E-mail:cuiliangji@163.com
