双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊在重型颅脑损伤患者中的应用效果
2017-05-04郐国虎金胜昔
郐国虎,金胜昔,周 游,刘 磊,陈 勇,王 鹏
重型颅脑损伤致死率和致残率较高,患者常合并高血压、糖尿病等,营养需求较大,自身代谢较快,且治疗后常遗留意识和吞咽功能障碍,易发生营养不良,会严重影响患者的生活质量[1-2]。因此,对重型颅脑损伤患者予以营养支持治疗具有重要的临床意义。目前,肠内营养混悬液是重型颅脑损伤患者营养支持治疗的常用药物,应用效果较好[3]。双歧杆菌四联活菌片是由婴儿双歧杆菌、嗜酸乳杆菌、粪肠球菌、蜡样芽孢杆菌组成的复方制剂,可改善肠道吸收功能,促进营养物质吸收。复方谷氨酰胺肠溶胶囊是一种肠道黏膜修复剂,具有保护肠黏膜、促进肠黏膜修复、增强肠道免疫屏障功能等作用。本研究旨在观察双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊在重型颅脑损伤患者中的应用效果,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年1月—2017年1月武汉科技大学附属天佑医院收治的重型颅脑损伤患者180例,均符合《神经外科学》[4]中的重型颅脑损伤诊断标准,并经颅脑CT检查确诊。纳入标准:(1)格拉斯哥昏迷量表(GCS)评分3~8分;(2)预计生存时间时间>15 d。排除标准:(1)双侧瞳孔散大并固定;(2)复合伤;(3)休克;(4)合并顽固性低氧血症;(5)发病至入院时间>12 h;(6)临床资料不完整;(7)存在消化系统疾病或严重心、肺、肾功能不全。采用随机数字表法将所有患者分为对照组与观察组,每组90例。两组患者性别、年龄、行手术治疗者所占比例比较,差异无统计学意义(P>0.05,见表1),具有可比性。本研究经武汉科技大学附属天佑医院医学伦理委员会审核批准,患者家属均签署知情同意书。
1.2 方法 对照组患者予以肠内营养混悬液(雅培制药有限公司生产,国药准字H20050453)治疗,参照《中国神经外科重症患者消化与营养管理专家共识(2016)》[1]中的能量标准(25~30 kal·kg-1·d-1)计算每天所需基本能量,第1天予以基本能量的1/4,后每天递增1/4,采用胃肠营养泵持续泵入,首次泵入速度为30 ml/h,次日改为80 ml/h持续泵入,第3天改为100 ml/h持续泵入,治疗期间每4 h或每次中断泵入给药期间予以30 ml温水冲管。观察组患者在对照组基础上予以双歧杆菌四联活菌片(吉林天三奇药业有限公司生产,国药准字S20000035)联合复方谷氨酰胺肠溶胶囊(地奥集团成都药业股份有限公司生产,国药准字H51023598)治疗,其中双歧杆菌四联活菌片3片/次,3次/d,鼻饲;复方谷氨酰胺肠溶胶囊2粒/次,3次/d,鼻饲,治疗期间床头抬高30°。两组患者均连续治疗30 d。
表1 两组患者一般资料比较
注:a为t值
1.3 观察指标 (1)采集两组患者治疗前后清晨空腹肘静脉血3 ml,采用迈瑞6800血分仪检测血红蛋白(Hb)水平、白细胞计数;采用西门子1800生化分析仪检测清蛋白(ALB)水平;采用贝克曼库尔特IMMAGE800蛋白仪检测C反应蛋白(CRP)水平。(2)采用GCS评估两组患者治疗前及治疗7 、21 d神经功能,GCS评分越高表明神经功能越好。(3)随访3个月,采用格拉斯哥预后量表(GOS)评估两组患者预后,GOS评分越高表明预后越好。(4)观察两组患者治疗期间不良反应发生情况。

2 结果
2.1 Hb、ALB水平 治疗前两组患者Hb、ALB水平比较,差异无统计学意义(P>0.05);治疗后观察组患者Hb、ALB水平高于对照组,差异有统计学意义(P<0.05,见表2)。
2.2 白细胞计数、CRP水平 治疗前两组患者白细胞计数、CRP水平比较,差异无统计学意义(P>0.05);治疗后观察组患者白细胞计数、CRP水平低于对照组,差异有统计学意义(P<0.05,见表3)。

Table2 Comparison of Hb and ALB between the two groups before and after treatment
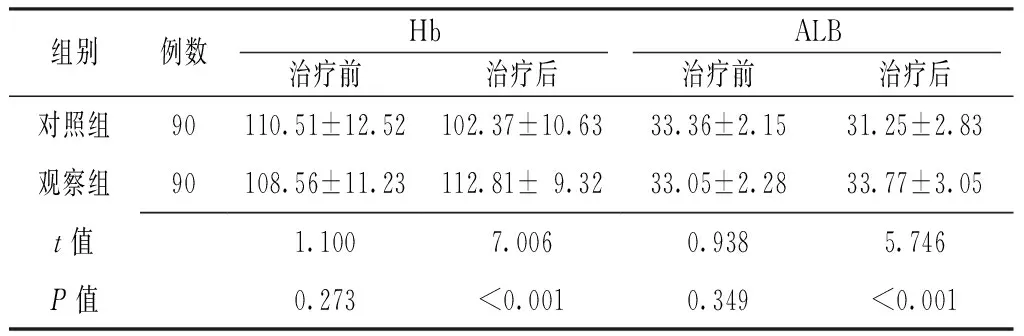
组别例数HbALB治疗前治疗后治疗前治疗后对照组90110.51±12.52102.37±10.6333.36±2.1531.25±2.83观察组90108.56±11.23112.81±9.3233.05±2.2833.77±3.05t值1.1007.0060.9385.746P值0.273<0.0010.349<0.001
注:Hb=血红蛋白,ALB=清蛋白

Table3 Comparison of WBC and CRP between the groups before and after treatment

组别例数白细胞计数(×109/L)CRP(mg/L)治疗前治疗后治疗前治疗后对照组9015.57±1.4310.48±1.87210.76±22.8878.46±9.52观察组9015.46±1.54 9.45±0.65 208.55±21.5420.43±3.38t值0.4978.2770.66754.495P值0.620<0.0010.506<0.001
注:CRP=C反应蛋白
2.3 GCS评分 治疗前对照组患者GCS评分为(7.1±0.8)分,观察组患者为(7.1±0.8)分;治疗7 d对照组患者GCS评分为(8.3±2.5)分,观察组患者为(8.5±3.5)分;治疗21 d对照组患者GCS评分为(9.6±2.8)分,观察组患者为(11.3±1.5)分。治疗前、治疗7 d两组患者GCS评分比较,差异无统计学意义(t值分别为1.000、0.441,P>0.05);治疗21 d观察组患者GCS评分高于对照组,差异有统计学意义(t=5.077,P<0.05)。
2.4 GOS评分 随访3个月,对照组患者GOS评分为(2.9±0.7)分,观察组患者为(3.7±0.8)分;观察组患者GOS评分高于对照组,差异有统计学意义(t=7.139,P<0.05)。
2.5 不良反应 治疗期间对照组患者出现便秘20例、腹泻18例、呕吐12例,不良反应发生率为55.6%;观察组患者出现便秘7例、腹泻8例、呕吐4例,不良反应发生率为21.1%。治疗期间观察组患者不良反应发生率低于对照组,差异有统计学意义(χ2=22.585,P<0.05)。
3 讨论
重型颅脑损伤患者常伴有高代谢状态,蛋白质及脂肪的分解代谢加速,糖异生增加,导致血糖升高、体质量下降;另外,颅脑损伤患者常因下丘脑、垂体等自主神经受累而导致全身代谢异常,能量消耗增加,脑水肿加重,免疫功能降低[5-6]。REINTAM BLASER等[7]研究表明,肠内营养支持对重型颅脑损伤患者具有积极作用。MAZAHERPUR等[8]研究表明,重型颅脑损伤患者超早期(<24 h)予以营养支持会加重肺部感染,而早期(24~48 h)予以营养支持的效果较好。
对重型颅脑损伤患者予以肠内营养支持可维持和改善肠道屏障功能,减少肠源性并发症的发生,降低致死率和致残率,改善患者预后。双歧杆菌四联活菌片是一种微生态制剂,其进入肠道后可在肠黏膜表面形成屏障,进而改善肠道微生态环境失衡,减少肠内细菌和内毒素易位,促进肠蠕动恢复,降低肠黏膜通透性,有利于胃肠道营养吸收,抑制肠黏膜局部炎性反应,增强肠道局部免疫功能[9-10]。复方谷氨酰胺肠溶胶囊具有促进蛋白质合成、增强巨噬细胞功能、减轻过度炎性反应、抑制肌肉过度分解、保护肠道黏膜等作用,同时可增强营养,调节免疫功能[11-12]。
张纪兰[13]研究结果显示,治疗4周后观察组患者GCS评分、ALB、淋巴细胞计数(LYM)、氮平衡(NB)高于对照组,白介素6(IL-6)、白介素8(IL-8)低于对照组(P<0.05)。大量临床研究表明,益生菌可抑制肠道致病菌繁殖,调节宿主微生态平衡紊乱,抑制IL-6、肿瘤坏死因子α(TNF-α)的产生,降低炎性反应,改善胃肠道功能[14-17]。KONDRUP等[2]研究表明,免疫增强添加剂(如谷氨酰胺、精氨酸、ω- 3脂肪酸等)可增加前清蛋白水平,提高免疫功能。KALLWEIT等[18]研究表明,谷氨酰胺可抑制热应激和氧化应激反应时肠上皮细胞凋亡。
Hb、ALB是临床评估营养状况的常用指标,白细胞计数、CRP是反映炎性反应的指标。本研究结果显示,治疗后观察组患者Hb、ALB水平高于对照组,提示双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊可有效改善重型颅脑损伤患者的营养状况;治疗后观察组患者白细胞计数、CRP水平低于对照组,与既往研究结果一致[19-21],提示双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊可有效减轻重型颅脑损伤患者炎性反应;治疗21 d观察组患者GCS评分高于对照组,提示双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊可有效改善重型颅脑损伤神经功能;随访3个月观察组患者GOS评分高于对照组,与既往研究结果一致[22-23],提示双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊可有效改善重型颅脑损伤患者预后;治疗期间观察组患者不良反应发生率低于对照组。
综上所述,双歧杆菌四联活菌片联合复方谷氨酰胺肠溶胶囊在重型颅脑损伤患者中的应用效果良好,可有效改善患者营养状况和预后,减轻患者炎性反应,提高患者神经功能,且不良反应较少,值得临床推广应用。但本研究样本量较小,未探讨营养支持在重型颅脑损伤患者中的具体作用机制,有待进一步进行深入研究。
[1]中华医学会神经外科学分会,中国神经外科重症管理协作组.中国神经外科重症患者消化与营养管理专家共识(2016)[J].中华医学杂志,2016,96(21):1643-1647.DOI:10.3760/cma.j.issn.0376-2491.2016.021.005.
[2]KONDRUP J,RASMUSSEN H H,HAMBERG O,et al.Nutritional risk screening(NRS 2002):a new method based on an analysis of controlled clinical trials[J].Clin Nutr,2003,22(3):321-336.
[3]于晓燕,朱京慈,尹华华,等.重型颅脑损伤后肠内营养支持的研究进展[J].护理研究,2010,24(28):2549-2552.DOI:10.3969/j.issn.1009-6493.2010.28.004.
[4]赵继宗,周定标.神经外科学[M].北京:人民卫生出版社,2014:139-140.
[5]STENGER R D,SCHMIDT S,BEYER B,et al.Use of the Glasgow Coma Scale in pediatric craniocerebral trauma[J].Kinderarztl Prax,1993,61(10):359-364.
[6]江基尧,朱诚.颅脑创伤临床救治指南[M].上海:第二军医大学出版社,2015:216-217.
[7]REINTAM BLASER A,STARKOPF J,ALHAZZANI W,et al,Early enteral nutrition in critically ill patients:ESICM clinical practice guidelines[J].Intensive Care Med,2017,43(3):380-398.DOI:10.1007/s00134-016-4665-0.
[8]MAZAHERPUR S,KHATONY A,ABDI A,et al.The Effect of Continuous Enteral Nutrition on Nutrition Indices,Compared to the Intermittent and Combination Enteral Nutrition in Traumatic Brain Injury Patients[J].J Clin Diagn Res,2016,10(10):JC01-JC05.DOI:10.7860/JCDR/2016/19271.8625.
[9]LAMONT R F,NHAN-CHANG C L,SOBEL J D,et al.Treatment of abnormal vaginal flora in early pregnancy with clindamycin for the prevention of spontaneous preterm birth:a systematic review and metaanalysis[J].Am J Obstet Gynecol,2011,205(3):177-190.DOI:10.1016/j.ajog.2011.03.047.
[10]TIBALDI C,CAPPELLO N,LATINO M A,et al.Maternal risk factors for abnormal vaginal flora during pregnancy[J].Int J Gynaecol Obstet,2016,133(1):89-93.DOI:10.1016/j.ijgo.2015.07.035.
[11]岳宏林,谢萍.添加谷氨酰胺的肠外营养应用于ICU重症颅脑损伤患者效果观察[J].安徽医药,2013,17(2):311-312.DOI:10.3969/j.issn.1009-6469.2013.02.058.
[12]马更平,康全利,陈善文,等.早期免疫营养对重型颅脑损伤患者营养状态及免疫学指标的影响[J].海南医学院学报,2015,21(4):498-500.DOI:10.13210/j.cnki.jhmu.20150104.004.
[13]张纪兰.益生菌强化早期肠内营养对重型颅脑损伤患者营养状况、免疫功能及炎症因子的影响[J].中国微生态学杂志,2017,29(4):462-464,468.DOI:10.13381/j.cnki.cjm.201704021.
[14]熊小伟,周已焰,董荔,等.益生菌联合早期肠内营养对重型颅脑损伤患者感染的影响[J].第三军医大学学报,2013,35(6):536-539.
[15]谢彩霞,朱京慈,温贤秀,等.添加益生菌的早期肠内营养对重型颅脑损伤病人TNF-α和IL-6的影响[J].护理研究,2012,26(29):2702-2705.DOI:10.3969/j.issn.1009-6493.2012.29.007.
[16]王彤,龙明智.益生菌与高血压、血脂异常及心血管疾病关系的研究进展[J].实用心脑肺血管病杂志,2017,25(7):7-10.
[17]王新岩,于朝霞,于湘友.添加益生菌的早期肠内营养对危重患者血脂和超敏C反应蛋白水平的影响[J].中国全科医学,2015,18(2):202-204.DOI:10.3969/j.issn.1007-9572.2015.02.019.
[18]KALLWEIT A R,BAIRD C H,STUTZMAN D K,et al.Glutamine prevents apoptosis in intestinal epithelial cells and induces differential protective pathways in heat and oxidant injury models[J].JPEN J Parenter Enteral Nutr,2012,36(5):551-555.DOI:10.1177/0148607112445579.
[19]姜明明,方强,孙勤,等.添加益生菌的早期肠内营养对重型颅脑损伤患者血清炎症因子与肠黏膜屏障功能的影响[J].中国微生态学杂志,2015,27(10):1177-1180.DOI:10.13381/j.cnki.cjm.201510017.
[20]陈露萍,刘维群,程军,等.早期肠内营养联合益生菌对重型颅脑损伤患者术后感染的影响研究[J].中华医院感染学杂志,2015,25(6):1357-1359.DOI:10.11816/cn.ni.2015-140581.
[21]华春晖,薛泳华,刘春,等.标准大骨瓣开颅减压术联合颅内压监测在重型颅脑损伤中的应用及对预后的影响[J].疑难病杂志,2015,14(6):568-571.DOI:10.3969/j.issn.1671-6450.2015.06.005.
[22]温韬雪.危重症临床护理指南[M].北京:人民卫生出版社,2013:40.
[23]AZIM A,HAIDER A A,RHEE P,et al.Early feeds not force feeds:Enteral nutrition in traumatic brain injury[J].J Trauma Acute Care Surg,2016,81(3):520-524.DOI:10.1097/TA.0000000000001089.
