结肠癌组织中Six1、FOXC2及E-cad表达变化及临床意义
2017-05-03王静苗贾喜花宋泰宁王晓博郑淑君
王静苗,贾喜花,宋泰宁,王晓博,郑淑君
(保定市第一中心医院,河北保定071000)
·临床研究·
结肠癌组织中Six1、FOXC2及E-cad表达变化及临床意义
王静苗,贾喜花,宋泰宁,王晓博,郑淑君
(保定市第一中心医院,河北保定071000)
目的 观察结肠癌组织中与上皮细胞-间充质转化相关的同源盒蛋白1(Six1)、叉头框蛋白C2(FOXC2)以及E-钙黏蛋白(E-cad)表达变化,并探讨其临床意义。方法 采用免疫组化SP法检测70例结肠癌组织和30例癌旁正常组织中的Six1、FOXC2及E-cad,分析三者在结肠癌组织中表达的相关性及其与患者临床病理特征的关系。结果 Six1、FOXC2在结肠癌组织中的阳性表达率分别为82.9%和74.3%,均高于癌旁正常组织中的16.7%和20.0%(P均<0.05);E-cad在结肠癌组织中的阳性表达率为21.4%,低于癌旁正常组织的80.0%(P<0.05)。Six1、FOXC2在结肠癌组织中的表达呈正相关(r=0.426,P<0.05),均与E-cad的表达呈负相关(r=-0.480、-0.728,P均<0.05)。Six1、FOXC2及E-cad表达与结肠癌TNM分期、浸润深度、淋巴结转移有关(P均<0.05),与患者年龄、性别及肿瘤直径、分化状态无关(P均>0.05)。结论 在结肠癌组织中,Six1和FOXC2高表达,E-cad低表达;三者可能共同促进上皮细胞-间充质转化,从而参与结肠癌的发生发展。
结肠癌;同源盒蛋白1;叉头框蛋白C2;E-钙黏蛋白;上皮细胞-间充质转化
研究发现,上皮细胞-间充质转化(EMT)现象与许多肿瘤的早期侵袭和转移密切相关。E-钙黏蛋白(E-cad)表达下调或抑制可以开启EMT,同源盒蛋白1(Six1)是一种促进细胞发生EMT的转录调控因子,而叉头框蛋白C2(FOXC2)被证实是EMT的重要调节者之一。本研究采用免疫组化法检测结肠癌组织中的Six1、FOXC2和E-cad,为进一步研究结肠癌的发生发展机制提供依据。
1 资料与方法
1.1 临床资料 收集2014年1月~2016年3月保定市第一中心医院外科手术切除并经病理检查证实的原发性结肠腺癌组织70例。患者中男31例,女39例;年龄25~86岁,中位年龄61岁;组织高分化25例,中分化29例,低分化16例;淋巴结有转移40例,无转移30例。TNM分期Ⅰ~Ⅱ期40例,Ⅲ~Ⅳ期30例;浸润深度T1~T245例,T3~T425例。患者术前均未行放化疗及生物靶向等治疗,病历资料完整。另留取距肿瘤边缘>5 cm的癌旁正常组织标本30例作为对照。
1.2 Six1、FOXC2和E-cad检测方法 采用免疫组化SP法,通用免疫组化SP试剂盒和DAB显色试剂购自福州迈新生物技术开发有限公司。兔抗人Six1单克隆抗体购自美国Sigma公司,兔抗人FOXC2单克隆抗体购自美国Arigo公司,兔抗人E-cad单克隆抗体购于北京中杉金桥生物试剂公司,3种抗体均以1∶100稀释。将组织石蜡切片置于65 ℃烤箱中烤2 h,常规脱蜡;依次在二甲苯中室温孵育10 min×2次,无水乙醇中室温孵育5 min×2次,95%的乙醇中室温孵育5 min×2次,蒸馏水洗2次,室温孵育。PBS冲洗3 min。高压抗原修复,PBS冲洗,5 min×3次。滴加一抗(用PBS液按1∶100)稀释,4 ℃孵育过夜;PBS冲洗,5 min×3次;滴加HRP标记二抗工作液50 μL,室温孵育60 min;PBS冲洗,5 min×3次。DAB显色试剂盒显色,显微镜下观察,用蒸馏水洗涤终止显色反应;苏木素复染,1%乙醇盐酸分化;自来水返蓝,蒸馏水洗涤,脱水、透明、封片。取已知阳性切片作为阳性对照,用PBS代替一抗作为阴性对照。将染色切片在双盲情况下由2名病理科医师观察评价,并进行病理图片采集。FOXC2、Six1和E-cad阳性染色均呈棕黄色颗粒,前两者主要定位于细胞质,后者主要定位于细胞膜。①阳性细胞数评分:每例标本每个指标随机观察5个高倍(×400)视野,计数阳性细胞数占细胞总数的百分比。阳性细胞数为0计0分,<10%计1分,10%~50%计2分,>50%计3分。②染色强度评分:无着色计0分,淡黄色计1分,棕黄色计2分,棕褐色计3分。两项积分之积0~2为阴性表达,3~9为阳性表达。
1.3 统计学方法 采用SPSS19.0统计软件。计数资料采用χ2检验或秩和检验,相关性分析行Spearman检验。P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌及癌旁组织中Six1、FOXC2和E-cad表达比较 Six1、FOXC2在结肠癌组织中的阳性表达率分别为82.9%(58/70)和74.3%(52/70),在癌旁正常组织中分别为16.7%(5/30)和20.0%(6/30),二者在结肠癌组织中的阳性表达率均高于癌旁正常组织(P均<0.05);E-cad在结肠癌组织中的阳性表达率为21.4%(15/70),低于癌旁正常组织的80.0%(24/30),差异有统计学意义(P<0.05)。
2.2 Six1、FOXC2和E-cad表达与结肠癌患者临床病理特征的关系 Six1、FOXC2、E-cad表达与结肠癌TNM分期、浸润深度、淋巴结转移有关(P均<0.05),而与患者性别、年龄及肿瘤直径、分化程度无关(P均>0.05)。见表1。
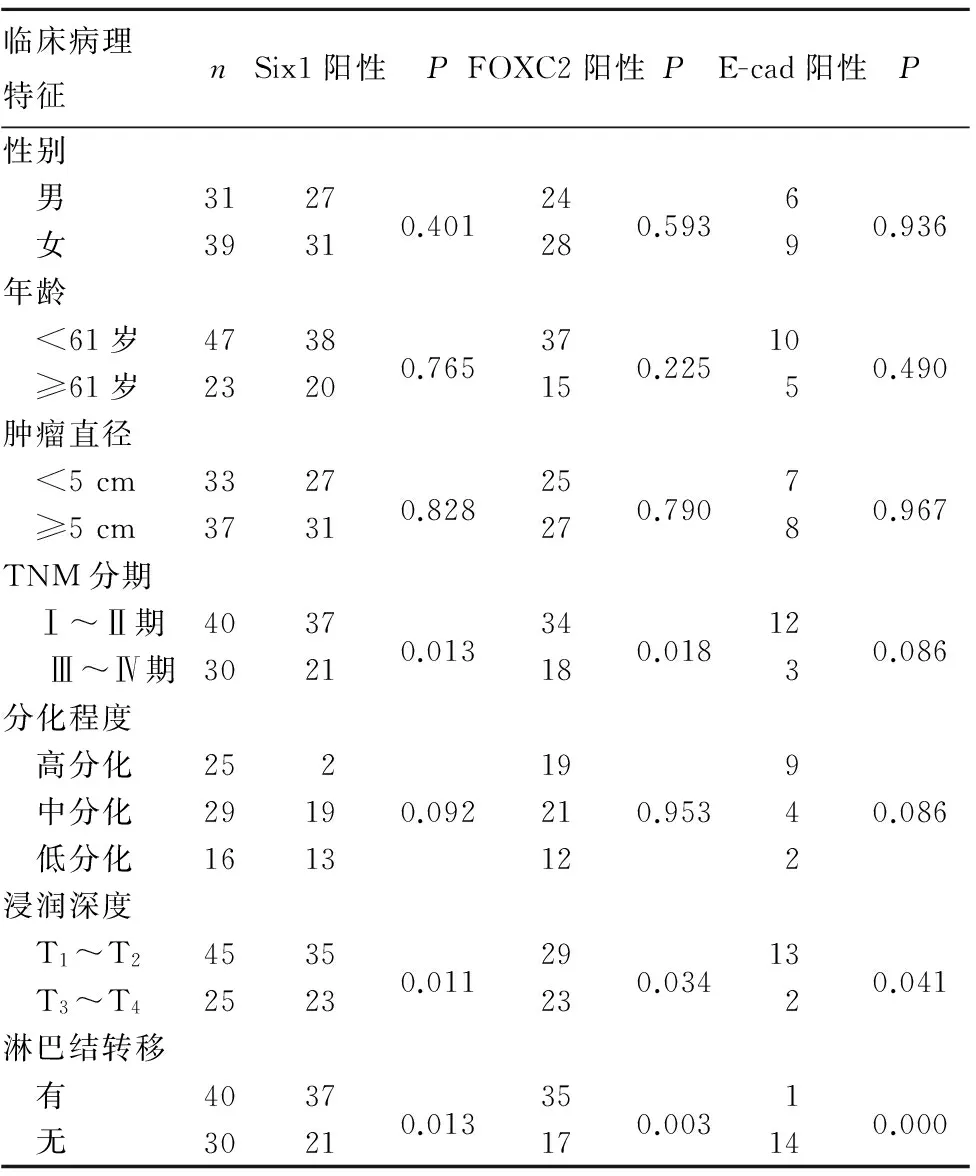
表1 Six1、FOXC2和E-cad表达与结肠癌患者临床病理特征的关系(例)
2.3 Six1、FOXC2和E-cad在结肠癌组织中表达的关系 在结肠癌组织中,Six1与E-cad表达呈负相关(r=-0.480,P<0.01),FOXC2与E-cad表达呈负相关(r=-0.728,P<0.05),Six1与FOXC2表达呈正相关(r=0.426,P<0.01)。
3 讨论
近年来,EMT与肿瘤转移的关系成为研究热点。EMT是指具有极性的上皮细胞在特定的病理和生理情况下转化为具有迁移能力的间质细胞的现象。近期研究表明,肿瘤细胞经历EMT后获得运动能力是其侵袭邻近组织和发生转移的前提。目前,已有报道提示EMT现象在结肠癌、乳腺癌等多种肿瘤中均有发生;它通过提高肿瘤细胞的侵袭性,促进远处转移,加速肿瘤的进展[1]。
Six1是同源盒基因家族成员之一,定位于人类染色体14q23上,其编码的蛋白是由一个183 bp高度保守的同源异型结构域(HD,61个氨基酸)和Six结构域(SD,110~115个氨基酸)组成的复合结构。该结构域DNA结合的特异性决定了其靶基因的特异性,不仅可影响多种组织器官的发育成熟,而且在肿瘤发生发展中发挥关键作用[2]。已有研究证实,Six1过表达既可上调间质标志物,又可下调上皮标志物,即其过表达能够引起EMT[3]。目前研究表明,Six1的表达与胰腺癌[4]、乳腺癌[5]等多种肿瘤的转移、预后密切相关。Jin等[6]研究表明,Six1过表达通过上调转化生长因子β(TGF-β)通路导致EMT,促进乳腺癌细胞的转移。本研究显示,Six1在结肠癌组织中的表达明显高于癌旁正常组织,并且与肿瘤TNM分期、浸润深度有关。这表明Six1的阳性表达与肿瘤细胞的恶性程度和疾病进展有着密切联系,与之前的研究结果相一致。
FOXC2亦称为间充质叉头框1(MHF1),定位于人类染色体的6q22~16q24,无内含子,仅由一个单独编码的外显子构成。其编码的蛋白质总共有494个氨基酸残基,具有显著的forkhead结构域,在细胞核中影响DNA的转录,调控一系列下游基因的表达[7]。近来研究表明,FOXC2既可促进血管和淋巴管新生,又能作为EMT过程中的一个重要诱导因子,促使肿瘤细胞发生EMT而增加侵袭转移能力[8]。已有研究发现,FOXC2在肿瘤细胞中的表达多伴随间质表型如Vimentin、平滑肌肌动蛋白-α(α-SMA)、N-钙黏蛋白(N-cad)表达上调,而上皮标记物E-cad、细胞角蛋白表达缺失[9];并且,在乳腺癌[10]、食管癌[11]等肿瘤细胞中均发现FOXC2参与了对EMT的调控,主要表现为与相关EMT转录因子的共表达,促进间质标志物表达上调,抑制上皮性标志物表达,从而促使肿瘤细胞获得迁移和侵袭能力。Hollier等[12]研究表明,在乳腺癌中,FOXC2表达与EMT和干细胞特性相关,干扰FOXC2表达能抑制细胞的间质表型和相关的侵袭行为及干细胞特性,而FOXC2过表达又能诱导肿瘤干细胞特性及乳腺癌细胞的转移。Nishida等[13]研究表明,FOXC2在食管癌中高表达,其表达与淋巴结转移、肿瘤分级相关,可能是评估食管癌预后的分子标志物。FOXC2在结肠癌中亦有部分报道,邓丹玲等[14]通过蛋白免疫印迹法、实时定量PCR法及免疫组化技术发现,FOXC2蛋白和mRNA在高转移潜能的结直肠癌细胞株中的表达明显高于低转移潜能的细胞株,在结直肠癌组织中的表达也高于正常结直肠黏膜组织。本研究结果显示,FOXC2在结肠癌组织中表达明显高于癌旁正常组织,其表达水平与肿瘤TNM分期、浸润深度、淋巴结转移有关,提示FOXC2高表达可能参与了结肠癌浸润转移过程,甚至促使结肠癌向更加恶性的阶段进展,同时也预示着FOXC2高表达可能与结肠癌患者的生存期短、预后不良具有相关性,这与之前的研究结果类似。
E-cad是一类主要介导同质细胞间黏附的跨膜糖蛋白,以二聚体形式分布于细胞膜表面,起到细胞与细胞之间黏附与通讯的作用。E-cad表达缺失可使细胞之间的极性丢失,黏附能力下降,使其本身表现出非上皮细胞独特性;在上皮细胞发生EMT及肿瘤发生过程中,经常会有E-cad表达下调;作为EMT现象最重要的标志性变化,转录因子上调表达和信号通路的开启都与E-cad表达下调有着密切的关系[15]。本研究结果显示,在结肠癌组织中Six1和FOXC2明显高表达而E-cad呈低表达,Six1、FOXC2与E-cad的表达均呈负相关,且二者表达呈正相关;表明Six1和FOXC2在促进结肠癌发生、发展过程中,均可能通过某种途径降低E-cad在细胞膜表面的表达,促使细胞发生EMT,进而促进结肠癌的浸润转移。
综上所述,Six1和FOXC2、E-cad在促进结肠癌发生、发展过程中可能存在相互作用,联合检测这三种蛋白在结肠癌中的表达水平可能会为EMT导致肿瘤浸润转移及未来新靶点的治疗提供新的理论基础,具体通过何种途径尚待进一步研究。另外,本实验对这三种蛋白的研究,可为后续随访研究进一步探讨其判断结肠癌患者的临床预后提供一定的研究基础。
[1] Lim SH, Becker TM, Chua W, et al. Circulating tumour cells and the epithelial mesenchymal transition in colorectal cancer[J]. Clin Pathol, 2014,67(10):848-853.
[2] Liu Y, Chu A, Chakroun I, et al. Cooperation between myogenic regulatory factors and Six family transcription factors is important for myoblast differentiation[J].Nucleic Acids Res, 2010,38(20):6857-6871.
[3] 洪甜,李玲,李文超,等.人Six1基因缺失突变体对上皮钙黏素启动子活性的影响[J].细胞与分子免疫学杂志,2016,32(2):224-227.
[4] Li Z, Tian T, Lv F, et al. Six1 promotes proliferation of pancreatic cancer cells via upregulation of cyclin D1 expression[J]. PLoS One, 2013,8(3):e59203.
[5] Wang CA, Jedlicka P, Patrick AN, et al. Six1 induces lym-phangiogenesis and metastasis via upregulation of VEGF-C in mouse models of breast cancer[J]. J Clin Invest, 2012,122(5):1895-1906.
[6] Jin H, Cui M, Kong M, et al. Sineoculis homeobox homolog protin is assiciated with breast cancer progression and survival outcome[J]. Exp Mol Pathol, 2014,97(2):247-252.
[7] Shimeld SM, Degnan B, Luke GN. Evolutionary genomics of the Fox genes: origin of gene families and the ancestry of gene clusters[J]. Genomics, 2010,95(5):256-260.
[8] Ren YH, Liu KJ, Wang M, et al. De-sumoylation of foxc2 by senp3 promotes the epithelial-mesenchymal transition in gastric cancer cells[J]. Oncotarget, 2014,5(16):7093-7104.
[9] You W, Gao H, Fan L, et al. Foxc2 regulates osteogenesis and angiogenesis of bone marrow mesenchymal stem cells[J]. BMC Muscul Dis, 2013,14(1):1235-1245.
[10] Ye J, Wu D, Wu E, et al. The cancer stem cell niche:cross talk between cancer stem cells and their microenvironment[J]. Tumour Biol, 2014,35(5):3945-3951.
[11] Wang J, Wang C, Meng Q, et al. siRNA targeting Notch-1 decreases glioma stem cell proliferation and tumor growth[J]. Mol Biol Rep, 2012,39(3):2497-2503.
[12] Hollier BG, Tinnirello AA, Werden SJ, et al. FOXC2 expression links eoithelial mesen chymaltransition and stem cell properties in breast cancer [J]. Cancer Res, 2013,73(6):1981-1992.
[13] Nishida N, Mimori K, Yokobori T, et al. FOXC2 is a novel prognostic factor in human esophageal squamous cell carcinnoma[J]. Ann Surg Oncol, 2011,18(2):535-542.
[14] 邓丹玲,崔艳梅,廖雯婷,等.FOXC2在结直肠癌中的表达及意义[J].诊断病理学杂志,2016,23(4):272-275.
[15] 赵俊卿,李云峰,赵婷,等.肿瘤细胞发生细胞上皮-间质转化的机制研究[J].肿瘤,2010,30(10):890-893.
10.3969/j.issn.1002-266X.2017.10.012
R735.3
B
1002-266X(2017)10-0039-03
2016-08-01)
