大肠癌石蜡包埋组织中MiR-21表达变化及意义
2017-05-03严晓丽杜梦楠郑纪宁
严晓丽,杜梦楠,郑纪宁
(承德医学院,河北承德067000)
大肠癌石蜡包埋组织中MiR-21表达变化及意义
严晓丽,杜梦楠,郑纪宁
(承德医学院,河北承德067000)
目的 观察大肠癌石蜡包埋组织中微小RNA-21(miR-21)的表达变化,并探讨其临床意义。方法 从40例大肠癌患者石蜡包埋的癌组织和癌旁5 cm范围外的正常黏膜组织中抽提RNA,采用反转录实时荧光定量PCR法检测miR-21,并分析癌组织中miR-21表达与大肠癌患者临床病理特征的关系。结果 miR-21在癌组织中相对表达量为-4.28±1.67,在癌旁正常组织为-2.05±1.85,miR-21在癌组织中的相对表达量较癌旁正常黏膜组织升高(P<0.05)。在不同性别、肿瘤形态及发病部位患者的癌组织中miR-21相对表达量比较差异无统计学意义(P均>0.05),在年龄大于中位年龄、存在淋巴结转移、分化程度低及已浸透浆膜层患者的癌组织组中miR-21相对表达量高于年龄小于中位年龄、无淋巴结转移、分化程度高及未浸透浆膜层患者的癌组织(P均<0.05)。结论 miR-21在大肠癌石蜡包埋组织中表达升高,其可能参与肿瘤的发生发展、分化及转移等生物学行为的调节;石蜡包埋组织可能成为研究肿瘤微小RNA的一种重要资源。
大肠癌;微小核糖核酸21;石蜡包埋组织;聚合酶链反应
大肠癌是临床上最常见的恶性肿瘤之一,2015年美国癌症协会进行的全球癌症数据评估[1]结果显示,大肠癌发病率在男性和女性中分别位列第3位和第2位。癌症在我国的发病也呈逐年增长趋势,在城市人口中大肠癌发病率已排在第2位[2]。早期大肠癌预后相对较好,但多数患者就诊时已属晚期。因此,早期诊断对于改善大肠癌患者的预后有非常重要的意义。近年来,有关大肠癌发病的分子机制及早期诊断的分子标志物研究受到了广泛关注,且焦点集中在微小RNA(miRNA)的研究上。诸多实验研究表明,miRNA在相同器官的正常组织和癌组织之间表达存在差异,且miRNA可作为癌基因或抑癌基因通过不同途径导致肿瘤的形成。因此,miRNA与肿瘤的发生发展密切相关,miRNA很可能成为大肠癌早期诊断和预后判断的新型分子标志物。诸多细胞水平的研究表明,miRNA-21(miR-21)可能与大肠癌的发生、发展、治疗、预后及多药耐药等方面都有密切关系,但因细胞水平的实验在临床上缺乏验证,不能为临床提供可靠的指导,而目前以甲醛固定石蜡包埋组织为材料进行miR-21表达研究的实验尚不多见。本实验以石蜡组织为材料,采用逆转录实时荧光定量PCR(RT-qPCR)法检测miR-21在大肠癌组织与相应5 cm范围外正常黏膜组织中的表达,探讨miR-21与大肠癌发生、发展及患者临床病理学特征的关系。
1 资料与方法
1.1 临床资料 标本来自2013年1月~2015年1月承德医学院附属医院和承德市中心医院40例大肠石蜡包埋组织,每例标本均包括大肠癌组织和相对应的5 cm范围外正常大肠黏膜组织。患者中男22例,女18例;年龄35~86岁,中位年龄58.5岁;结肠癌20例,直肠癌20例;溃疡型17例,隆起型23例;高分化25例,中低分化15例;浸润深度未浸透浆膜层16例,浸透浆膜层24例;无淋巴结转移25例,有淋巴结转移15例。
1.2 石蜡包埋组织中miR-21检测方法 采用RT-qPCR法,石蜡包埋组织总RNA纯化试剂盒、Hairpin-itTMmicroRNA和U6 snRNA标准化RT-PCR定量试剂盒均购于苏州吉玛基因股份有限公司。操作方法:①RNA提取:所有石蜡组织先经过HE染色,显微镜下观察。癌组织玻片划出边缘非癌组织范围,正常组织划出边缘非黏膜层。根据圈出的组织范围大小切片10~15张,每张切片厚度5 μm。癌组织玻片剔除边缘非癌组织,正常组织玻片剔除边缘非黏膜层。经过烤片,二甲苯Ⅰ、Ⅱ脱蜡,乙醇Ⅰ、Ⅱ洗脱二甲苯,然后将组织收集到干净的EP管中。接着按照试剂盒操作说明逐步提取RNA,提取出的RNA浓度采用紫外分光光度计进行测定。RNA样品纯度A260/A280值在1.9~2.1为纯度符合标准的RNA,否则重新提取。②RT-qPCR:提取的总RNA采用20 μL逆转录反应加样量体系进行逆转录获取cDNA,加样包括5×MMLV RT Buffer 4 μL、dNTP 0.75 μL、miR-21和U6 snRNA RT引物混合物各1.20 μL、MMLV逆转录酶0.2 μL、RNA样品质量取0.2 μg,以无酶水加至20 μL。逆转录程序:25 ℃ 30 s,42 ℃ 30 s,85 ℃ 5 s,4 ℃ 保存。miRNA 逆转录产物扩增采用20 μL逆转录反应加样量体系进行PCR,加样包括SYBR 10 μL、miR-21/U6 snRNA特异性引物各0.4 μL、Taq DNA 聚合酶0.2 μL、miRNA 逆转录产物2 μL,以无菌水加至20 μL。每个样品miR-21和U6均设3个复孔。实时荧光定量PCR反应程序:95 ℃ 3 min预变性;95 ℃ 12 s,62 ℃ 40 s,40个循环,采集荧光信号。③结果判定:独立3次重复试验,每次作3个复孔,任何1个样品的标准化基因的Ct值不能≥30,且每个样品复孔间的差异不>1,否则重复试验。为了使差异均一化,以ΔCt表示miR-21的相对表达量,ΔCt为miR-21 Ct平均值与内参U6 Ct 平均值的差值。

2 结果
2.1 miR-21在大肠癌组织和癌旁正常组织中的表达比较 miR-21在癌组织中相对表达量为-4.28±1.67,在癌旁正常组织为-2.05±1.85,miR-21在癌组织中相对表达量较癌旁正常黏膜组织升高(P<0.05)。
2.2 miR-21表达与大肠癌临床病理特征的关系 miR-21在不同性别、肿瘤形态、部位及浸润深度患者的大肠癌组织间比较差异无统计学意义(P均>0.05),在不同年龄、肿瘤分化程度及淋巴结是否转移患者的大肠癌组织间比较差异有统计学意义(P均<0.05)。见表1。
3 讨论
以美国癌症协会第6版定义的大肠癌分期为标准评估大肠癌5年生存率,结果显示Ⅰ期结肠癌患者5年生存率为93.2%、Ⅱ期为82.5%、Ⅲ期为59.5%、Ⅳ期为8.1%[3]。可见早期大肠癌预后良好,但临床上以中晚期病例为多,很多病例失去了手术机会,而化疗又因多药耐药影响效果。因此,寻找出敏感和特异的分子标志物,建立相对完善的早期诊断、预后评估方案对于提高大肠癌患者5年生存率有非常重要的意义。近年来,与大肠癌关系密切的miRNA的研究已受到广泛关注。
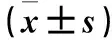
表1 miR-21表达与大肠癌患者临床病理特征的关系
成熟的miRNA通过与mRNA诱导沉默复合物(RISC)结合形成RISC复合体,后者可特异性识别靶mRNA的3′-非编码区,从而引起靶mRNA的降解、翻译抑制,在转录后水平调控一个或多个基因的表达[4]。研究[5]显示,有高达上千个人类miRNA已经证实,且多达92%的人类基因可能受miRNA调控[6]。有研究[7]显示,miRNA能影响细胞的整个发育过程。Calin等[8]发现,超过50%的miRNA基因位于肿瘤基因相关区域或脆性位点。大量研究表明,miRNA通过调控多个mRNA的表达,在细胞的增生、分化、凋亡和发展过程中都有非常重要的作用。多项研究报道,与肿瘤相关的miRNA在相同器官的癌组织和正常组织之间表达存在差异。已经证实,miRNA可通过调控癌基因或抑癌基因表达发挥致癌作用,也可自身作为癌基因或抑癌基因通过不同途径导致肿瘤的形成。其中,miR-21在结肠癌的发生过程中发挥着类似于癌基因的作用[9],其在多种类型的癌症包括大肠癌中表达上调[10,11]。多个实验室采用分子生物技术和细胞技术,在体外实验中对不同细胞系miR-21的致癌特性进行了广泛研究[12~14]。并且多项研究报道,miR-21的表达水平与细胞凋亡、增殖和迁移、不良预后以及化疗耐药都密切相关[15~17]。Kang等[18]研究结果显示,miR-21高表达的T3~T4a大肠癌患者的无瘤生存期较miR-21低表达的患者明显缩短,且肿瘤复发的风险更高,miR-21在大肠癌中高表达与E-钙黏素低表达和转移相关蛋白1(MAP1)高表达相关。总之,miR-21通过负向调控Spry2、张力蛋白同源性磷酸酶(PTEN)、程序性细胞死亡因子4(PDCD4),抑制细胞外信号调节蛋白磷酸化激酶(ERK)、蛋白激酶 (AKT)、c-Jun N端激酶(JNK) 等多个下游靶基因,进而发挥致癌作用[19]。通过检索KEGG Pathway数据库中MicroRNAs In Cancer(map05206)也可得知,miR-21参与大肠癌发生发展过程的多个环节。这些研究表明,miR-21可能作为一个具有高敏感性的分子标志物用于大肠癌多个方面的研究。
一个新的肿瘤标记物的发现和研究通常需要新鲜冰冻组织,但由于伦理道德、保存问题、医疗环境等多种因素的影响,以新鲜组织为实验材料用于研究不是非常方便,因此多数研究目前尚处于细胞和动物水平,这些实验结果常常因在临床上缺乏验证而不能为临床提供可靠的指导。石蜡包埋组织可克服研究中的这些缺点,它是临床手术标本收集和存储最常采用的方法,且常有比较详细和完善的临床随访信息,因此这对于人类疾病基因表达的研究是非常宝贵的资源。过去的实验研究发现,从石蜡组织中分离的核酸通常在一定程度上发生化学结构断裂或化学性质改变,因而经常不能用于分子水平研究。近年来发现,从石蜡组织中提取的RAN长度大约可达80个核苷酸,且仅有约1%的核苷酸发生化学结构和性质的改变。而内源性的具有基因调控功能的miRNA长度为18~25个核苷酸,其化学结构和性质很少受甲醛固定、石蜡包埋等操作过程的影响[20,21]。最近研究[22]发现,乳腺癌石蜡包埋组织和相应新鲜冰冻组织中基因表达谱很大程度上相类似。石蜡组织对于分子标志物的发现和验证是非常重要的资源,而且以临床归档的石蜡组织标本为材料对miRNA表达谱和肿瘤多方面机制进行研究分析,还可能扩大miRNA在肿瘤的临床诊断、预后判断及靶向治疗等方面的应用范围。相信在不久的将来,从石蜡组织中抽提纯化RNA的技术会广泛应用于大规模的临床验证研究中。
本研究从石蜡包埋的大肠癌组织和相应的癌旁正常黏膜组织中抽提纯化RNA,采用RT-qPCR法检测了miR-21的表达水平,发现miR-21在大肠癌组织中表达明显高于相应的癌旁正常组织,与前人研究结果相一致;且miR-21的表达与大肠癌患者的发病年龄及肿瘤分化程度、淋巴结是否转移、浸润深度密切相关,提示其可能参与肿瘤的发生发展、分化及转移等生物学行为的调节。随着实验方法的不断改进,石蜡组织RNA提取技术日趋成熟,结合完善的临床信息,我们可以推测miR-21与大肠癌临床分期、病理分型、预后判断、化疗耐药等多方面也存在联系。
综上所述,鉴于miRNA在石蜡包埋组织中化学结构和性质相对稳定,以及随着miRNA的广泛、深入研究,石蜡组织RNA提取技术日趋成熟,其在肿瘤的发生发展过程中的调节机制将进一步被阐明,特异性强、敏感性高的miRNA陆续被发现并在临床的应用中取得突破性进展。届时,石蜡包埋组织将成为miRNA研究的主要材料之一,miRNA真正应用于临床的时代便正式到来。
[1] Torre LA, Bray F, Siegel RL, et al. Globalcancer statistics 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] 赫捷,陈万青.2012中国肿瘤登记年报[M].北京:军事医学科学出版社,2012:10.
[3] O′Connell JB, Maggard MA, Ko CY. Colon cancer survival rates with the new American Joint Committee on Cancer sixth edition staging[J]. J Natl Cancer Inst, 2004,96(19):1420-1425.
[4] Bartel DP. MicroRNA target recognition and regulatory functions[J]. Cell, 2009,136(2):215-233.
[5] Bentwich I, Avniel A, Karov Y, et al. Identification of hundreds of conserved and nonconserved human microRNAs[J]. Nat Genet, 2005,37(7):766-770.
[6] Miranda KC, Huynh T, Tay Y, et al. A pattern-based method for the identification of MicroRNA binding sites and their corresponding heteroduplexes[J]. Cell, 2006,126(6):1203-1217.
[7] Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell, 2005,120(1):15-20.
[8] Calin GA, Sevignani C, Dumitru CD, et al. Human micoRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J]. Proc Natl Acad Sci USA, 2004,101(9):2999-3004.
[9] Nakajima G, Hayashi K, Xi YG, et al. Non-coding microRNAs hsa-let-7g and hsa-miR-181b are associated with chemore- sponse to S-1 in colon cancer[J]. Cancer Genomics Proteomics, 2006,3(5):317-324.
[10] Kanaan Z, Rai SN, Eichenberger MR, et al. Plasma miR-21: a potential diagnostic marker of colorectal cancer[J]. Ann Surg, 2012,256(3):544-551.
[11] Pan X, Wang ZX, Wang R. MicroRNA-21: a novel therapeutic target in human cancer[J]. Cancer Biol Ther, 10(12):1224-1232.
[12] Asangani I, Rasheed SA, Nikolova DA, et al. MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer[J]. Oncogene, 2008,27(15):2128-2136.
[13] Frezzetti D, De Menna M, Zoppoli P, et al. Upregulation of miR-21 by Ras in vivo and its role in tumor growth[J]. Oncogene, 2010,30(3):275-286.
[14] Si ML, Zhu S, Wu H, et al. miR-21-mediated tumor growth[J]. Oncogene, 2007,26(19):2799-2803.
[15] Meng F, Henson R, Wehbe-Janek H, et al. MicroRNA-21 regulates expression of the PTEN tumor suppressor gene in human hepatocellular cancer[J]. Gastroenterology, 2007,133(2):647-658.
[16] Schetter AJ, Leung SY, Sohn JJ, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma[J]. JAMA, 2008,299(4):425-436.
[17] Yao Q, Cao S, Li C, et al. Micro-RNA-21 regulates TGF-beta-induced myofibroblast differentiation by targeting PDCD4 in tumor-stroma interaction[J]. Int J Cancer, 2011,128(8):1783-1792.
[18] Kang WK, Lee JK, Oh ST, et al. Stromal expression of miR-21 in T3-4acolorectal cancer is an independent predictor of early tumor relapse[J]. BMC Gastroenterology, 2015,15:2.
[19] Ma X, Kumar M, Choudhury SN, et al. Loss of the miR-21 allele elevates the expression of its target genes and reduces tumorigenesis[J]. Proc Natl Acad Sci USA, 2011,108(25):10144-10149.
[20] Xi Y, Nakajima G, Gavin E, et al. Systematic analysis of microRNA expression of RNA extracted from fresh frozen and formalin-fixed paraffin-embedded samples[J]. RNA, 2007,13(10):1668-1674.
[21] Li J, Smyth P, Flavin R, et al. Comparison of miRNA expression patterns using total RNA extracted from matched samples of formalin-fixed paraffin-embedded (FFPE) cells and snap frozen cells[J]. BMC Biotechnology, 2007,7:36.
[22] Mittempergher L, de Ronde JJ, Nieuwland M, et al. gene expression profiles from formalin fixed paraffin embedded breast cancer tissue are largely comparable to fresh frozen matched tissue[J]. PLoS One, 2011,6(2):e17163.
MiR-21 expression changes in paraffin-embedded tissues of colorectal cancer
YANXiaoli,DUMengnan,ZHENGJining
(ChengdeMedicalCollege,Chengde067000,China)
Objective To observe the expression changes of microRNA-21 (miR-21) in paraffin-embedded tissues of colorectal cancer, and to explore its clinical significance. Methods We extracted RNA from 40 cases of colorectal cancer samples and their corresponding cancer-adjacent normal tissues which were fixed by formalin and embedded by paraffin. MiR-21 expression was detected by reverse transcription quantitative real-time PCR, and we analyzed the relationship between the miR-21 expression and clinicopathologic features of colorectal cancer patients. Results The relative expression of miR-21 in the cancer tissues was -4.28±1.67, which was 4.69 times higher than that (-2.05±1.85) in the normal tissues adjacent to carcinoma (P<0.05).There was no significant difference in the expression of miR-21 among patients with different sex, tumor shape and position (allP>0.05). However, the level of miR-21 in patients with median age or higher, lymph node metastasis, low degree of differentiation and high infiltration depth of carcinoma was higher than that in patients with age lower than the median age, no lymph node metastasis, high degree of differentiation and low infiltration depth of carcinoma (allP<0.05).Conclusions MiR-21 expression is increased in paraffin-embedded tissues of colorectal cancer, indicating miR-21 may be involved in the regulation of biological behaviors, such as the occurrence, development, differentiation and metastasis of colorectal cancer. Paraffin-embedded tissue may be an important resource for studying tumor microRNAs.
colorectal carcinoma; microRNA-21; paraffin-embedded tissues; polymerase chain reaction
河北省高校重点学科建设资助项目(031412);河北省教育厅重点课题资助项目(ZD2014013);河北省研究生创新资助项目(2016-275)。
严晓丽(1989-),女,硕士研究生,主要研究方向为大肠癌多药耐药。E-mail: 379024364@qq.com
郑纪宁(1967-),女,教授,研究生导师,主要研究方向为大肠癌多药耐药。E-mail: zhengjining196711@126.com
10.3969/j.issn.1002-266X.2017.10.004
R735.3
A
1002-266X(2017)10-0011-04
2016-09-03)
