Wnt 信号通路阻滞剂DKK-1对人结肠癌细胞HCT116侵袭能力的影响
2017-05-03张延新张印坡赵琰王记红张艳崔东涛
张延新,张印坡,赵琰 ,王记红 ,张艳, 崔东涛
(1漯河医学高等专科学校,河南漯河462002;2漯河医学高等专科学校第一附属医院)
Wnt 信号通路阻滞剂DKK-1对人结肠癌细胞HCT116侵袭能力的影响
张延新1,张印坡1,赵琰2,王记红1,张艳1, 崔东涛1
(1漯河医学高等专科学校,河南漯河462002;2漯河医学高等专科学校第一附属医院)
目的 探讨Wnt 信号通路阻滞剂DKK-1对人结肠癌细胞HCT116侵袭能力的影响及其分子机制。方法 将HCT116细胞随机分为观察组和对照组,分别给予DKK-1 100 ng/mL及等量细胞培养液继续培养48 h。采用Transwell侵袭实验观测肿瘤细胞侵袭能力的变化,分别采用Western blot法、RT-PCR法检测肿瘤细胞中Wnt 信号通路关键基因β-catenin、EMT调控因子Snail及上皮细胞标记物E-cadherin、间质细胞标记物Vimentin的蛋白及mRNA表达,结果 观察组穿膜细胞数为(45.29±6.25)个/HP,低于对照组的(76.36±8.32) 个/HP,差异有统计学意义(P<0.05)。与对照组比较,观察组HCT116细胞中β-catenin、Snail、Vimentin蛋白及mRNA表达水平均降低,E-cadherin蛋白及mRNA表达水平增高(P均<0.05)。结论 Wnt 信号通路阻滞剂DKK-1可能通过抑制肿瘤细胞上皮-间充质转化过程,进而降低人结肠癌细胞HCT116的侵袭能力。
结肠癌;Wnt 信号通路;通路阻滞剂;上皮-间充质转化;细胞侵袭
研究表明,上皮-间质转化(EMT)是许多恶性肿瘤细胞获得侵袭、转移能力的重要机制[1~3],而Wnt信号通路在肿瘤细胞的EMT过程中发挥着重要作用[4]。本实验将外源性Wnt 信号通路阻滞剂DKK-1作用于人结肠癌细胞HCT116,检测细胞中Wnt 信号通路关键基因β-catenin、EMT调控因子Snail及上皮细胞标记物E-cadherin、间质细胞标记物Vimentin的蛋白及mRNA表达;采用Transwell法检测细胞侵袭能力的改变,分析上述基因表达与肿瘤细胞侵袭能力变化间的关系,旨在为临床进一步探讨如何抑制结肠癌侵袭与转移提供理论依据。
1 材料与方法
1.1 材料 人结肠癌细胞HCT116购自中科院上海细胞所,DKK-1购自Pepro Tech公司;兔抗人β-catenin抗体、Snail抗体、Vimentin抗体、E-cadherin抗体均购自Abcam公司,PCR扩增试剂盒购自北京全式金生物技术有限公司,RT-PCR引物由北京博大泰克生物技术有限公司完成设计、合成,Transwell小室购自Costar公司。
1.2 实验方法
1.2.1 HCT116细胞培养与分组处理 将肿瘤细胞培养于DMEM培养基中,于37 ℃、50 mL/L CO2培养箱中培养;以2.5 g/L胰酶消化后继续培养,收集对数生长期细胞用于实验[5]。将细胞随机分为观察组和对照组,分别给予DKK-1 100 ng/mL及等量细胞培养液继续培养48 h。
1.2.2 HCT116细胞侵袭能力观察 采用Transwell 侵袭实验。将Transwell小室放 24 孔板中,上室内加入以0.2% BSA 的无血清培养基 1∶5稀释后的基质胶50 μL/孔,37 ℃温箱过夜使胶凝固。使用前在上室加入 100 μL 含0.2% BSA 的无血清培养基,在下室加入 600 μL小鼠成纤维细胞NIH3T3的条件培养基[5],水化 30 min。将两组肿瘤细胞在0.2%BSA无血清培养基孵育过夜,制成5×105/mL 细胞悬液。吸出小室的上层培养基,取细胞悬液 100 μL 加入上室,5% CO2、37 ℃的细胞培养箱内培养 24 h;常规苏木素染色,400倍镜下观察。在每个滤膜上均随机选取5个视野,计数全部视野穿膜细胞平均数,作为一个滤膜每视野下侵袭细胞数,实验重复3次。
1.2.3 HCT116细胞中β-catenin、Snail、Vimentin、E-cadherin蛋白检测 采用Western blot法。 吸去培养皿中的培养液,PBS漂洗后将肿瘤细胞刮下加到1.5 mL EP管中,以4 000 r/min离心3 min后收集细胞。加入200 μL裂解液冰上裂解60 min,4 ℃下以12 000 r/min离心30 min,取上清并测定蛋白浓度。将蛋白样品变性后按60 μg/道上样于10 % SDS-PAGE 凝胶,加入电泳缓冲液,120 mV电泳2.5 h,按常规电转移步骤将蛋白转至PVDF膜;经5 %的脱脂牛奶封闭1 h后,加入5% BSA/PBST缓冲液1∶1 000稀释的兔抗人β-catenin、Snail抗体、Vimentin抗体、E-cadherin抗体,4 ℃孵育过夜;PBST漂洗3 次,每次5 min;加入5%的脱脂牛奶/PBST缓冲液稀释的二抗(浓度为1∶10 000),室温孵育1 h;PBST漂洗3次,每次5 min;ECL避光孵育2~3 min后,LAS-3000显影曝光。采用凝胶图像分析系统对各目标条带进行扫描后并记录其分子量及灰度值,计算各目标条带与内参蛋白β-actin的灰度值之比,以此作为待测蛋白的相对表达量[6,7]。
1.2.4 HCT116细胞中β-catenin、Snail、Vimentin、E-cadherin mRNA检测 采用RT-PCR法。根据Gene Bank收录的基因序列,根据引物设计原则用Primer 6.0软件设计,经BLAST比对,经过微机检索与人类基因无同源性。由北京博大泰克生物技术有限公司合成,均进行硫代磷酸化修饰。引物序列见表1。
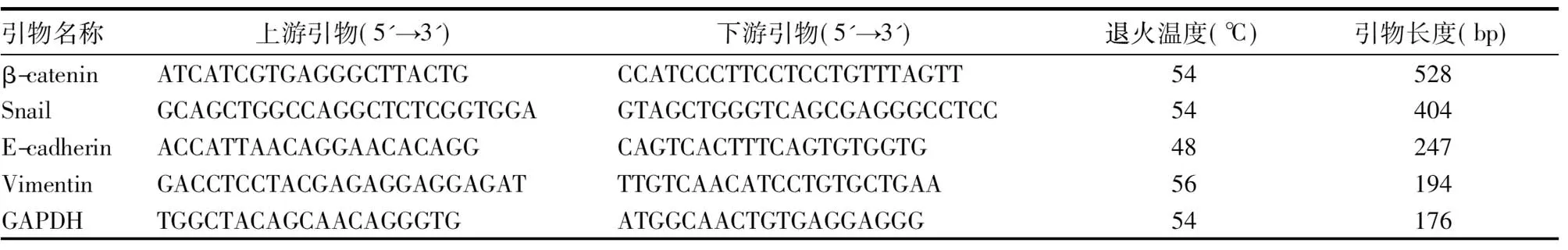
表1 RT-PCR引物序列
取两组细胞,弃去培养板中培养基,PBS液洗涤,用TRIzol提取细胞总RNA,检测总RNA纯度、浓度和完整性,检测合格后将 mRNA 逆转录为 cDNA。逆转录反应体系:总RNA 1.0 μg,Oligo(dT)18 μg(0.5 μg/μL),2×ES Reaction Mix 10 μL,EasyScript RT 1 μL,补DEPC水至30 μL。42 ℃反应30 min,99 ℃灭活5 min,4 ℃ 5 min,置于-20 ℃备用。取2 μL用于PCR扩增反应,反应体系:CDNA 2 μL,上下游引物(10 μmol/L)各1 μL,10×Easy Tag Buffer(Mg2+) 5 μL,2.5 mmol/L dNTPs 4 μL,Easy Tag DNA Polymerase 0.5 μL,补双蒸水至20 μL。反应条件:95 ℃预变性10 min,1个循环;94 ℃变性30 s,55 ℃退火30s(引物不同退火温度不同),72 ℃延伸2 min,共40个循环;72 ℃总延伸6 min。阴性对照用无RNA酶的水代替cDNA进行反应。取5 μL扩增产物与缓冲液混合后,加入含2%琼脂糖凝胶(0.5 μg/mL EB)的加样孔中,电压4~10 V/cm条件下进行电泳。采用D-140图像分析系统进行记录及分析,Quantity One软件分析,目的基因表达量以目的基因的DNA条带和β-actin 的DNA条带灰度值比值表示[8]。

2 结果
2.1 两组HCT116细胞侵袭能力比较 观察组穿膜细胞数为(45.29±6.25)个/HP,明显低于对照组的(76.36±8.32) 个/HP(P<0.05)。
2.2 两组HCT116细胞β-catenin、Snail、Vimentin、E-cadherin蛋白表达比较 见表1。
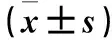
表1 两组HCT116细胞中β-catenin、Snail、Vimentin、E-cadherin蛋白表达比较
注:与对照组比较,*P<0.05。
2.3 两组HCT116细胞β-catenin、Snail、Vimentin、E-cadherin mRNA表达比较 见表2。
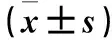
表2 两组HCT116细胞中β-catenin、Snail、Vimentin、E-cadherin mRNA表达比较
注:与对照组比较,*P<0.05。
3 讨论
结肠癌是常见的恶性肿瘤之一,多数患者就诊时已发生肿瘤细胞的侵袭和转移,这也是影响患者临床治疗效果、生存率及生活质量的重要因素,因而研究结肠癌的侵袭和转移有重要的临床应用价值。
EMT被认为是许多恶性肿瘤细胞获得侵袭与转移能力的重要机制[1~3],而β-catenin依赖的经典Wnt信号通路在肿瘤细胞的EMT过程中发挥着重要的作用[4]。Wnt 蛋白分子与胞膜相应受体结合后,β-catenin磷酸化降解受抑,在胞质内逐渐堆积[9,10],并影响相关基因的转录;导致上皮源性细胞逐渐失去上皮样表型,细胞极性消失,细胞间的紧密连接减少,而间质样表型逐渐增强,迁移、游走能力增强,即发生EMT[11]。这对恶性肿瘤细胞而言,侵袭能力增强。研究表明作为EMT调控因子,Snail参与了多种恶性肿瘤的侵袭与转移。
本实验将外源性Wnt 信号通路阻滞剂DKK-1作用于人结肠癌细胞HCT116,采用Transwell侵袭实验观察肿瘤细胞侵袭能力变化。结果显示,观察组肿瘤细胞穿膜细胞数低于对照组,组间比较差异有统计学意义;提示阻断Wnt 信号通路能明显降低人结肠癌细胞的侵袭能力。另外,本研究显示,观察组肿瘤细胞中Wnt信号通路关键基因β-catenin、EMT调控因子Snail、间质细胞标记物Vimentin蛋白及mRNA表达均较对照组降低,上皮细胞标记物E-cadherin蛋白及mRNA表达均较对照组增高,组间比较差异有统计学意义。提示DKK-1可能通过阻断经典 Wnt 信号通路,降低 β-catenin 在胞质内聚积[12,13],进而抑制EMT调控因子Snail表达;Snail表达降低,对上皮细胞标记物E-cadherin的抑制作用减弱,也不能上调间质细胞标记物Vimentin的表达[14],最终导致肿瘤细胞EMT减弱、侵袭能力降低。
综上所述,将外源性Wnt 信号通路阻滞剂DKK-1作用于人结肠癌细胞HCCT116,其可通过抑制肿瘤细胞EMT降低肿瘤细胞的侵袭能力,为进一步探索抑制结肠癌侵袭与转移有效途径提供了一定的理论依据。
[1] Greenburg G, Hay ED. Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells[J]. J Cell Biol, 1982,95(1):333-339.
[2] Clevers H. Wnt/beta-catenin signaling in development and disease[J]. Cell, 2006,127(3):469-80.
[3] Kaufhold S, Bonavida B. Central role of Snail1 in the regulation of EMT and resistance in cancer:a target for therapeutic intervention[J]. J Exp Clin Cancer Res, 2014,33:62.
[4] Jiang YG, Luo Y, He DL, et al. Role of Wnt/beta-eatenin signaling pathway in epithelial-mesenchymal transition of human prostate cancer induced by hypoxia-inducible factor-l alpha[J]. Int J Ural, 2007,14(11):1034-1039.
[5] 张延新,赵红军,宋文刚,等.TWEAK 反义寡核苷酸对人结肠癌细胞系SW480增殖及侵袭能力的影响[J].解剖学报,2014,45 (1):74-79.
[6] 张娜,梁莹,杨兴升,等.GBP1基因沉默对宫颈癌CaSki细胞增殖和迁移的影响[J].现代妇产科进展,2015,24(12):907-910.
[7] 李艳芹,张苗苗,闵鹤鸣,等.ZHX1基因沉默对BMSCS中BMP2/smad通路的影响[J].重庆医科大学学报,2016,40(10):38-43.
[8] 马松林,张姮,廖宇圣,等.Wnt3a 对结肠癌 SW480 细胞增殖的影响及作用机制[J].山东医药,2016,56(37):18-20.
[9] 姜俊,王晓蕾.Wnt信号通路在结肠锯齿状息肉癌变过程中作用的研究进展[J].国际消化病杂志,2015,32(2): 99-101.
[10] 邹慧娟,郑航,李明君,等.Wnt信号通路在结肠癌中的表达及其作用机制[J].中国老年学杂志,2016,36(14):3373-3374.
[11] Lee JM, dedhar S, Kalluri R, et al. The epithelial-mesenchymal transition: new insights in signaling, development, and disease[J]. J Cell Biol, 2006,172(7):973-981.
[12] 边立忠, 高松.DKK1 基因干扰对原发性肝细胞癌细胞增殖的影响及其机制探讨[J].山东医药,2014,54 (28):31-33.
[13] 纪晓花,王玲,高占海,等.β-catenin 与食管鳞癌发生发展的关系[J].山东医药,2016,56(19):103-105.
[14] 郑丽芳,梅元武,张小乔,等.Snail 基因沉默对转化生长因子-β1 促进骨髓间充质干细胞迁移的抑制作用[J]. 解剖学报,2008,39 (5):717-722.
Effects of Wnt signaling pathway antagonist DKK-1 on invasion ability of colon cancer cell line HCT116
ZHANGYanxin1,ZHANGYinpo,ZHAOYan,WANGJihong,ZHANGYan,CUIDongtao
(1LuoheMedicalCollege,Luohe462002,China)
Objective To investigate the effects and molecular mechanism of Wnt signal pathway antagonist DKK-1 on invasion ability of colon cancer cell line HCT116. Methods Conlon cancer HCT116 cells were divided into the experimental group and control group, which were cultured with exogenous DKK-1 (100 ng/mL) and the same amount of cell culture medium for 48 h, respectively. Transwell was used to observe the change of invasion ability. The protein and mRNA expression of β-catenin, Snail, E-cadherin and Vinentin in the HCT116 cells was observed by Western blotting and RT-PCR. Results The number of transmembrane cells in the experimental group was (45.29±6.25)/HP which was obviously lower than that in control group〔(76.36±8.32)/HP〕, and the difference was statistically significant (P<0.05). The protein and mRNA expression of β-catenin, Snail and Vinentin was lower and the expression of E-cadherin protein and mRNA was higher in the experimental group than that of the control group, and the differences were statistically significant (allP<0.05). Conclusion Wnt signal pathway antagonist DKK-1 can decrease the invasion ability of conlon cancer cell line HCT116 by inhibiting the process of epithelial-mesenchymal transition in tumor cells.
colon carcinoma; Wnt signaling pathway; pathway antagonist; epithelial-mesenchymal transition; cell invasion
河南省教育厅青年教师资助项目(2012GGJS-269)。
张延新(1974-),男,副教授,主要研究方向为消化系肿瘤病理。E-mail: zhangyx448@126.com
10.3969/j.issn.1002-266X.2017.10.003
R735.3
A
1002-266X(2017)10-0008-03
2016-11-21)
