自主跑轮运动对阿尔茨海默病模型小鼠学习记忆能力和海马内炎性细胞因子表达的影响
2017-05-03王莉智和荣丽杨桂姣张楠刘成芳
王莉智 和荣丽 杨桂姣 张楠 刘成芳
山西医科大学人体解剖学教研室(山西太原030001)
自主跑轮运动对阿尔茨海默病模型小鼠学习记忆能力和海马内炎性细胞因子表达的影响
王莉智 和荣丽 杨桂姣 张楠 刘成芳
山西医科大学人体解剖学教研室(山西太原030001)
目的:探讨自主跑轮运动对阿尔茨海默病(AD)模型小鼠学习记忆能力和海马内肿瘤坏死因子-α(TNF-α)、白介素10(IL-10)、核转录因子κB(NF-κB)表达的影响。方法:将45只跑轮合格的3月龄雄性昆明小鼠随机分为二甲基亚砜(DMSO)对照组(n=15)和Aβ1-42寡聚体注射组(n=30),分别于侧脑室注射DMSO和Aβ1-42寡聚体,Aβ1-42寡聚体注射1周后两组小鼠进行Morris水迷宫实验,通过比较两组小鼠的逃避潜伏期和穿越平台次数,检测Aβ1-42寡聚体注射组与DMSO对照组小鼠的学习记忆能力,证实侧脑室注射Aβ1-42寡聚体能够有效模拟AD模型。之后将Aβ1-42寡聚体注射组小鼠随机分成AD运动组(n=15)和AD安静组(n=15),AD运动组进行为期6周的自主跑轮运动,AD安静组和DMSO对照组正常饲养6周,不运动。AD运动组跑轮结束后,3组小鼠采用Morris水迷宫实验,通过比较3组小鼠的逃避潜伏期和穿越平台次数,检测3组小鼠的学习记忆能力。运动后的3组小鼠均采用免疫荧光染色方法观察小鼠海马CA1区和CA3区TNF-α、IL-10、NF-κB阳性表达率变化。结果:(1)Morris水迷宫实验结果表明,侧脑室注射药物1周后,Aβ1-42寡聚体注射组小鼠的逃避潜伏期明显高于DMSO对照组(P<0.05),穿越平台所在区域的次数显著低于DMSO对照组(P<0.05);跑轮结束后,AD安静组小鼠的逃避潜伏期明显高于AD运动组和DMSO对照组(P<0.05),穿越平台所在区域的次数明显低于AD运动组和DMSO对照组(P<0.05)。(2)免疫荧光结果显示,NF-κB和促炎细胞因子TNF-α在海马CA1区和CA3区的表达趋势均一致,AD安静组的阳性表达率显著高于AD运动组和DMSO对照组(P<0.05),而IL-10的阳性表达率则显著低于AD运动组和DMSO对照组(P<0.05),各检测指标在AD运动组和DMSO对照组的阳性表达率无显著差异(P>0.05)。结论:(1)自主跑轮运动可有效改善AD模型小鼠的学习记忆能力;(2)自主跑轮运动一方面通过抑制NF-KB的过度活化减少促炎细胞因子TNF-α的表达,另一方面促进抗炎细胞因子IL-10的表达。
阿尔茨海默病;海马;自主跑轮运动;学习记忆;TNF-α;IL-10;NF-κB
阿尔茨海默病(Alzheimer’s disease,AD)是由渐进性记忆障碍、认知功能障碍等神经精神症状为特征的慢性进行性中枢神经系统变性导致的痴呆,严重影响老年群体的生存质量。AD的病因有多种学说,但近些年研究发现AD发病伴随着各种促炎细胞因子的大量分泌[1]。脑内β淀粉样蛋白(amyloid-beta,Aβ)沉积可激活小胶质细胞释放炎性细胞因子和神经毒性物质,导致炎症级联反应,损伤神经元。核转录因子κB(nucle⁃ar factor Kappa B,NF-κB)作为一个对基因转录具有调控作用的重要核转录因子,参与了小胶质细胞的活化和炎症性脑损伤的诱导[2,3]。肿瘤坏死因子-α(tu⁃ mor necrosis factor-α,TNF-α)是促炎细胞因子,促炎细胞因子的释放均受到NF-κB的转录调控。白介素10(interleukin 10,IL-10)作为一个经典的抗炎细胞因子,能够有效抑制促炎细胞因子的过度释放。
适宜的运动可对抗炎症应激的发生[4],并促进脑衰老、AD等认知功能的恢复[5,6]。NF-κB不仅可调控各种炎症细胞因子的表达,同时又是一个运动敏感因子。研究表明,体育锻炼能够抑制NF-κB的过度激活,调控各种炎性细胞因子的表达[7]。本研究通过对Aβ1-42寡聚体注射小鼠进行自主跑轮运动干预,观察其学习记忆能力的改变及海马CA1区和CA3区TNF-α、IL-10和NF-κB表达的变化,探讨有氧运动对AD的干预作用。
1 材料与方法
1.1 动物分组与处理
3月龄雄性昆明小鼠50只,体重30~35g,由山西医科大学实验动物中心提供。将小鼠放入带有跑轮的鼠笼中进行初筛,剔除跑轮不合格小鼠。选定45只跑轮合格的小鼠,随机分为二甲基亚砜(DMSO)对照组(n=15)和Aβ1-42寡聚体注射组(n=30),根据小鼠脑图谱,采用脑立体定位仪,进行侧脑室注射,注射用时8 min,注射完毕留针5 min,促进注射物的吸收。DMSO对照组给予侧脑室(以前囟为0点,前囟后0.5mm,旁开1mm,硬脑膜下2.3mm)一次性注射DMSO 4 μl;Aβ1-42寡聚体注射组在相同部位一次性注射Aβ1-42寡聚体4 μl(2.25 μg/μl,购自abcam公司),模拟AD模型[8-11]。
侧脑室注射药物1周后,通过Morris水迷宫实验比较两组小鼠的逃避潜伏期和穿越平台次数,检测Aβ1-42寡聚体注射组与DMSO对照组小鼠的学习记忆能力,证实侧脑室注射Aβ1-42寡聚体能够有效模拟AD模型。之后将Aβ1-42寡聚体注射组小鼠随机分成AD运动组(n=15)和AD安静组(n=15),AD运动组进行为期6周的自主跑轮运动,AD安静组和DMSO对照组正常饲养6周,不运动。AD运动组跑轮结束后,3组小鼠采用Morris水迷宫实验,通过比较3组小鼠的逃避潜伏期和穿越平台次数,检测3组小鼠的学习记忆能力。
1.2 Morris水迷宫实验
水迷宫实验周期为6天,前5天为定位航行实验,第6天为空间探索实验。定位航行实验:每天特定时间1次,将小鼠依次从4个象限的任意点面朝池壁放入水中,记录小鼠在60 s内找到并爬到平台停留5 s所用的时间;如果小鼠在60 s内未能找到平台,则将小鼠引导至平台停留10 s,并将其用时记录为60 s。小鼠到达平台的时间即为逃避潜伏期,逃避潜伏期越短,说明小鼠的空间学习能力越强,以此评估Aβ1-42寡聚体注射小鼠的空间学习能力。空间探索实验:第6天将平台撤离,将小鼠依次从4个象限的任意点面朝池壁放入水中,记录小鼠在60 s内穿越平台所在区域的次数,穿越平台次数越多,说明小鼠的空间探索能力越强,以此评估Aβ1-42寡聚体注射小鼠的空间记忆能力。
1.3 免疫荧光染色
1.3.1 灌注取材和冰冻切片
经6周自主跑轮运动结束并进行水迷宫实验后第2天,所有实验动物采用3.5%水合氯醛(0.1 ml/10 g)腹腔注射麻醉,开胸,经心-升主动脉依次灌注0.9%生理盐水、4%多聚甲醛溶液,之后开颅取脑,将脑组织放入4%多聚甲醛溶液中再次固定,然后依次经过15%和30%蔗糖充分梯度脱水后,进行脑组织包埋,参照小鼠脑图谱,确定海马位置,于冰冻切片机(徕卡CM1850-1-1)上进行切片,片厚约16 μm,隔五取一,风干后进行免疫荧光染色。
1.3.2 免疫荧光染色步骤
按照常规免疫荧光染色步骤进行染色。所有切片经丙酮固定、漂洗、封闭后,于一抗(大鼠单克隆抗体IL-10、山羊抗兔TNF-α多克隆抗体,均购自Abcam公司;兔单克隆抗体NF-κB,购自Cell Singaling公司)4℃过夜,二抗(FITC标记山羊抗大鼠IgG由北京中杉金桥提供、山羊抗兔IgG,Cy3由康为世纪提供)避光在37℃孵箱孵育2 h,封片剂封片后于荧光显微镜下观察TNF-α、IL-10、NF-κB在海马CA1区和CA3区的表达和分布情况。
1.3.3 图像分析与数据处理
采用Olympus BX51型荧光显微镜观察TNF-α、IL-10和NF-κB在海马CA1区和CA3区的表达和分布情况,每只小鼠选取5张脑片,每张脑片随机选取相应脑区的4~6个视野观察检测指标的表达及分布情况,采用DP71照相系统于镜下40倍进行拍照,通过Meta⁃morph软件计数阳性细胞数,并计算上述指标在所在区域的阳性表达率。
1.4 统计分析
2 结果
2.1 学习记忆能力的检测
2.1.1 定位航行实验
水迷宫检测结果显示,侧脑室注射药物1周后,Aβ 1-42寡聚体注射组与DMSO对照组小鼠的逃避潜伏期在前3天均无显著差异(P>0.05),第4天、第5天出现明显差异(P<0.05),表现为Aβ1-42寡聚体注射组小鼠的逃避潜伏期(33.70±2.31)明显高于DMSO对照组(24.54±2.85),差异具有统计学意义(P<0.05)(图1A)。
6周跑轮运动结束后,AD运动组的逃避潜伏期(12.10±1.26)显著低于AD安静组(27.75±3.88),差异具有统计学意义(P<0.01)(图1B)。

图1 Aβ1-42寡聚体注射1周后(A)、运动6周后(B)各组逃避潜伏期
2.1.2 空间探索实验
撤去平台后,所有小鼠的游动轨迹均具有目标趋向性(图2、图3)。造模1周后,Aβ1-42寡聚体注射组在60 s内穿越平台所在区域的次数(5.13±3.72)明显少于DMSO对照组(8.50±4.17),差异具有统计学意义(P<0.05)。
6周自主跑轮运动结束后,AD安静组在60 s内穿越平台所在区域的次数(6.25±2.63)明显少于AD运动组(10.86±3.94)和DMSO对照组(9.67±3.32),差异均具有统计学意义(P<0.05),而AD运动组和DMSO对照组相比差异无统计学意义(P>0.05)。

图2 Aβ1-42寡聚体注射1周后小鼠游动轨迹

图3 自主跑轮运动6周后各组小鼠游动轨迹
2.2 免疫荧光染色结果
免疫荧光染色结果显示,TNF-α、IL-10和NF-κB在DMSO对照组、AD安静组和AD运动组的海马CA1区和CA3区均有表达,且各自在两区表达趋势一致。在海马CA1区和CA3区,促炎细胞因子TNF-α和NF-κB表达趋势一致,AD安静组的阳性表达率均明显高于其他两组(P<0.05)(见图4、图5,图6、图7);而IL-10在AD安静组的阳性表达率明显低于AD运动组和DMSO对照组(P<0.05)(图8、图9);上述检测指标在AD运动组和DMSO对照组的阳性表达率无明显差异(P>0.05)。
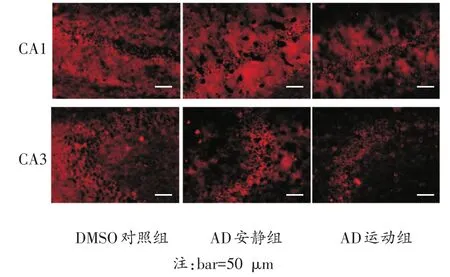
图4 TNF-α在各组小鼠海马CA1、CA3区免疫荧光染色结果

图5 TNF-α在各组小鼠海马CA1、CA3区阳性表达率

图6 NF-κB在各组小鼠海马CA1、CA3区免疫荧光染色结果

图7 NF-κB在各组小鼠海马CA1、CA3区阳性表达率
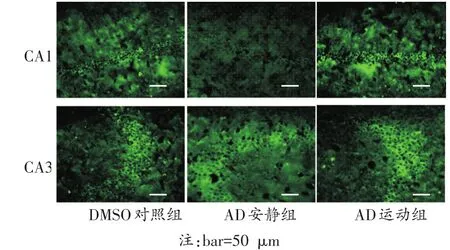
图8 IL-10在各组小鼠海马CA1、CA3区免疫荧光染色结果
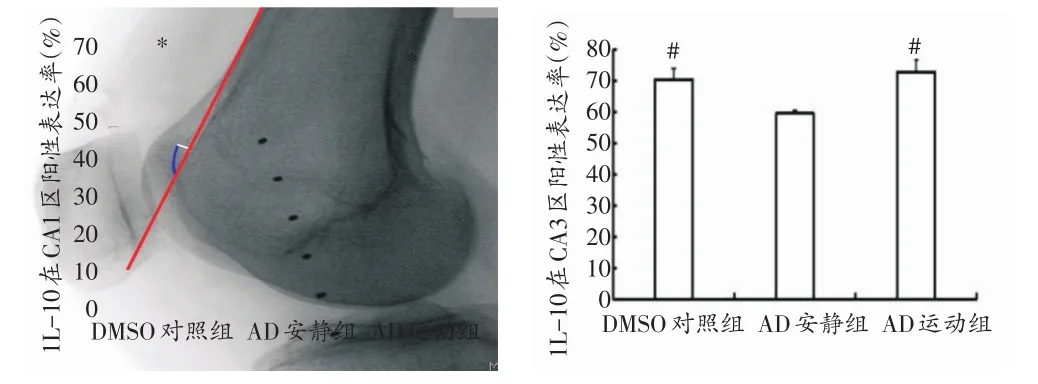
图9 1L-10在各组小鼠海马CA1、CA3区阳性表达率
3 讨论
老年斑的形成是AD患者的主要病理特征之一,Aβ是老年斑的主要成分[12]。Aβ1-42是AD发病过程中最主要的神经毒性物质,目前,侧脑室注射Aβ1-42是国内外较常用的制备AD模型的方法[8-11]。记忆缺失是AD最早期的临床症状,也是其最主要的认知障碍。本实验造模7天后水迷宫实验结果显示,侧脑室注射Aβ 1-42寡聚体小鼠与DMSO对照组相比,逃避潜伏期延长,撤去平台后穿越平台次数明显降低,说明存在显著的学习记忆障碍,证实在本实验中,侧脑室注射Aβ1-42寡聚体有效模拟了AD动物模型。
NSE/htau23[13]和Tg-NSE/hPS2m[14]转基因小鼠均通过6周的跑台运动证实其学习记忆能力的改善。本实验水迷宫结果也证实,经过6周自主跑轮运动的干预,AD运动组与AD安静组相比,逃避潜伏期明显缩短,到达平台所在区域的次数明显多于AD安静组,提示6周的自主跑轮运动能够明显改善AD模型小鼠的学习记忆能力。
“炎症学说”被认为是AD的重要发病机制。NF-κB是小胶质细胞内重要的核转录因子,也是炎症反应的启动因子,在促成AD患者大脑中免疫炎症反应的形成和炎性产物分泌水平持续升高的过程中起到关键性作用。在AD、中风、帕金森病等神经性疾病的致病过程中,NF-κB均呈现过度活化的状态。在AD患者尸检过程中发现,脑组织Aβ斑块沉积的周围,神经元和星形胶质细胞中NF-κB的免疫反应异常活跃[15]。Eslam⁃ izade[16]的研究表明,经Aβ造模的大鼠模型,NF-κB在海马CA1区的表达水平显著升高。TNF-α是促炎细胞因子,是Aβ诱导炎症反应和认知障碍的传递者[17],在AD发病过程中起着调节炎症表达的作用,能削弱AD发病过程中的保护性因素,诱导神经元损伤,增强炎症级联反应。Wu等[18]研究发现,当Aβ在大脑沉积,海马神经元表面的TLP4/NF-κB通路被激活,促炎因子TNF-α、IL-1β的表达水平随之上升,随着炎性因子表达的变化,Aβ1–42表达量也不断增多。IL-10作为一个经典的抗炎细胞因子,能够有效抑制促炎细胞因子的分泌。Mohd等[19]研究显示,与正常人相比,AD患者的外周血清中IL-10、IL-13的表达明显低于正常人,而TNF-α、IL-1β、IL-6、IL-12的表达显著高于正常人。
近几年,为了降低AD的发病率,临床采用了多种药物缓解和延迟AD的发生发展,但是这些药物的疗效都是暂时的。在近期的研究中,体育锻炼得到更多的关注。体育锻炼已成为一种干预神经退行性疾病的有效措施,能达到延缓或限制疾病发展的目的[20]。Sun[21]提到,运动能够减弱脑损伤和延迟各种因素引起的神经退化。本课题组前期研究已证实[22,23],持续有效的有氧游泳运动不仅可以改善衰老模型大鼠的学习记忆能力,而且改善了海马区和下丘脑区炎症反应失衡的现象,延缓了衰老进程。Choi等[24]研究表明,6周的跑台运动使AD大鼠大脑皮质中促炎细胞因子TLR4、TNF-α、IL-1α、NF-κB的表达水平明显降低。Souza[14]研究中发现,8周的游泳运动能够抑制AD小鼠海马和皮质中TNF-α和IL-1β的表达,并提高IL-10的表达。
本研究免疫荧光染色结果显示,给予AD模型小鼠6周自主跑轮运动干预,在海马CA1区和CA3区,NF-κB和促炎细胞因子TNF-α在AD安静组的阳性表达率明显高于AD运动组和DMSO对照组,表明自主跑轮运动有效抑制了NF-κB的过度活化和TNF-α的表达;而IL-10的表达与其相反,在AD安静组的阳性表达率明显低于AD运动组和DMSO对照组,说明自主跑轮运动上调了IL-10的表达。
4 总结
自主跑轮运动可有效改善AD模型小鼠的学习记忆能力;自主跑轮运动一方面通过抑制NF-KB的过度活化减少促炎细胞因子TNF-α的表达,另一方面促进抗炎细胞因子IL-10的表达。
[1] Wyss-Coray T,Rogers J.Inflammation in Alzheimer dis⁃ease-a brief review of the basic science and clinical lit⁃erature[J].Cold Spring Harb Perspect Med,2012,1:a006346.
[2] Lue LF,Kuo YM,Beach T,et al.Microglia activation and anti-inflammatory regulationin Alzheimer's disease[J]. Mol Neurobiol,2010,2-3:115-128.
[3] Cai ZY,Yan Y,Chen R.Minocycline reduces astrocytic reactivation and neuroinflammation in the hippocampus of a vascular cognitive impairment rat model[J].Neurosci Bull,2010,1:28-36.
[4] Teixeira-Lemos E,Nunes S,Teixeira F,et al.Regular physical exercise training assists in preventing type 2 di⁃abetes development:focus on itsantioxidant and anti-in⁃flammatory properties[J].Cardiovasc Diabetol,2011,10:12.
[5] Foster PP,Rosenblatt KP,Kuljiš RO.Exercise-induced cog⁃nitiveplasticity,implicationsformild cognitiveimpair⁃ment and Alzheimer's disease[J].Front Neurol,2011,2:28.
[6] EricksonKI,MillerDL,Roecklein KA.The aging hippocam⁃pus:interactions between exercise,depression,and BDNF [J].Neuroscientist,2012,1:82-97.
[7] Choi DH7,Kwon IS,Koo JH,et al.The effect of tread⁃mill exercise on inflammatory responses in rat model of streptozotocin-induced experimental dementia of Alzheim⁃er's type[J].Exerc Nutrition Biochem,2014,2:225-233.
[8] Canas PM,Simões AP,Rodrigues RJ,et al.Predominant loss of glutamatergic terminal markers in a b-amyloidpep⁃tide model of Alzheimer’s disease[J].Neuropharmacology,2014,76:51-56.
[9] 张玲玲,金英,隋海娟.阿托伐他汀对Aβ1-42诱导的大鼠AD模型保护作用及其机制研究[J].中国药理学通报,2014,2:270-274.
[10]谢云亮,张博,张英杰.雌激素受体β对阿尔茨海默病大鼠海马内炎症反应及淀粉样β蛋白的沉积的影响[J].中风与神经疾病杂志,2015,3:205-208.
[11]Freir D B,Fedriani R,Scully D,et al.Aβ oligomers in⁃hibit synapseremodelling necessary for memory consolida⁃tion[J].Neurobiol Aging,2011,12:2211-2218.
[12]Selkoe DJ.Clearing the brain's amyloid cobwebs[J].Neuron,2001,2:177-180.
[13]Kang EB,Cho JY.Effect of treadmill exercise on PI3K/ AKT/mTOR,autophagy,and Tau hyperphosphorylation in the cerebral cortex of NSE/htau23 transgenic mice[J].Ex⁃erc Nutrition Biochem,2015,3:199-209.
[14]Um HS,Kang EB,Koo JH,et al.Treadmill exercise re⁃presses neuronal cell death in an aged transgenic mouse modelofAlzheimer'sdisease[J].NeurosciRes,2011,2:161-173.
[15]Paris D,Patel N,Quadros A,et al.Inhibition of Abeta pro⁃duction by NF-kappaB inhibitors[J].Neurosci Lett,2007,1:11-16.
[16]EslamizadeMJ,MadjdZ,RasoolijaziH,etal.Impaired memory and evidence of histopathology in CA1 pyrami⁃dal neurons through injection of Aβ1-42 peptides into the frontal cortices of rat[J].Basic Clin Neurosci,2016,1:31-41.
[17]Souza LC,Filho CB,Goes AT,et al.Neuroprotective effect of physical exercise in a mouse model of Alzheimer's disease induced by β-amyloid1-40 peptide[J].Neurotox Res,2013,2:148-163.
[18]Wu D,Zhang X,Zhao M,et al.The role of the TLR4/NF-κB signaling pathway in Aβ accumulation inprimary hip⁃pocampalneurons[J].Acta Physiologica Sinica,2015,3:319-328.
[19]Mohd Hasni DS,Lim SM,Chin AV,et al.Peripheral cyto⁃kines,C-X-C motifligand10 and interleukin-13,are asso⁃ciated with Malaysian Alzheimer's disease[J].Geriatr Gerontol Int,2016,10:12783.
[20]Paillard T,Rolland Y,de Souto Barreto P.Protective ef⁃fects of physical exercise in Alzheimer's disease and Par⁃kinson's disease:anarrative review[J].Clin Neurol.2015,3:212-219.
[21]Sun Shin Yi.Effects of exercise on brain functions in dia⁃betic animal models[J].World J Diabetes,2015,4:583-597.
[22]史卫俊,陆利,曹阳,等.有氧游泳运动对衰老过程大鼠海马IL-6、IL-10及小胶质细胞的影响[J].中国运动医学杂志,2015,34(9):868-874.
[23]魏姣龙,陆利,刘娜,等.衰老大鼠持续游泳运动后学习记忆能力和表达变化[J].中国运动医学杂志,2014,33(10):998-1003.
[24]Choi DH,Kwon IS,Koo JH,et al.The effect of treadmill exercise on inflammatory responses in rat model of strep⁃tozotocin-induced experimental dementia of Alzheimer's type[J].Exerc Nutrition Biochem,2014,2:225-233.
2016.09.13
山西医科大学科技创新基金项目(C01201002);山西医科大学基础医学院331基金项目(201213);山西省高等学校科技项目(21021005);山西医科大学大学生创新项目(2010121)
第1作者:王莉智,Email:790793352@qq.com;
:和荣丽,Email:herl2690@sina.com
