HPLC同时测定盆炎净胶囊中3种有效成分含量
2017-04-28袁志鹰杨岩涛李荣东李哲欧阳吉德
袁志鹰,杨岩涛,李荣东,李哲,欧阳吉德
1.湖南中医药大学,湖南 长沙 410208;2.郴州市食品药品检验所,湖南 郴州 423000
HPLC同时测定盆炎净胶囊中3种有效成分含量
袁志鹰1,杨岩涛1,李荣东1,李哲1,欧阳吉德2
1.湖南中医药大学,湖南 长沙 410208;2.郴州市食品药品检验所,湖南 郴州 423000
目的 建立HPLC同时测定盆炎净胶囊中3种有效成分芍药苷、原儿茶酸和绿原酸的含量分析方法。方法 采用SHIMADZU VP-ODS-C18色谱柱(250 mm×4.6 mm,5µm),流动相为乙腈-0.15%磷酸溶液梯度洗脱,检测波长231、255、326 nm,流速1.0 mL/min,柱温30℃,进样量20µL。结果 在上述色谱条件下,芍药苷、原儿茶酸、绿原酸之间分离度良好。芍药苷Y=1546.412 8X+127.075 6(r=0.999 9),线性范围150.054~1254.50 ng;原儿茶酸Y=2925.846 8X+2204.107 6(r=0.999 8),线性范围162.33~1352.75 ng;绿原酸Y=893.904 5X-261.731 5(r=0.999 4),线性范围11.43~95.25 ng。3种成分的平均回收率分别为97.60%、102.09%、98.52%。结论 该方法操作简单、方便、准确,可为盆炎净胶囊的质量控制提供借鉴。
盆炎净胶囊;芍药苷;原儿茶酸;绿原酸;高效液相色谱法
盆炎净胶囊是在盆炎净颗粒(卫生部药品标准WS3-B-2387-97)的基础上改变剂型而成,由忍冬藤、蒲公英、鸡血藤、益母草、狗脊、车前草、赤芍、川芎共8味药组成,具有清热利湿、和血通络、调经止带之功效,适用于湿热下注、白带过多等妇科带下病,是临床常用中成药之一,疗效确切[1],且未见明显不良反应。但现有质量标准(国家食品药品监督管理局标准YBZ23722005)较为简单,只有部分药材的薄层定性鉴别,难以整体控制药品质量。芍药苷为赤芍的定量指标成分[2];君药忍冬藤和蒲公英具有较强的抗菌作用,其抗菌有效成分以绿原酸为主[3];原儿茶酸是忍冬藤、鸡血藤、狗脊、川芎、车前草等多种药材中的主要活性成分[4-8]。以上3种成分均具有较强的生理活性。采用HPLC单独测定芍药苷[9-10]、原儿茶酸[11]、绿原酸[3]含量的方法均已建立,但尚无同时测定3种成分含量的方法。因此,为全面控制盆炎净胶囊质量,提高分析检测效率,本研究尝试建立同时测定芍药苷、原儿茶酸、绿原酸3种主要药效活性物质含量的HPLC方法。
1 仪器与试药
岛津LC-20A型高效液相色谱仪(日本岛津公司),岛津SPD-M20A二极管阵列DAD检测器,SIL-20A自动进样器,METTLER TOLEDO ML204电子分析天平(瑞士METTLER TOLEDO公司),KQ-300DE超声清洗仪(昆山市超声仪器有限公司)。
芍药苷对照品(批号110736-201539)、原儿茶酸对照品(批号110809-201205)、绿原酸对照品(批号110753-201415),中国食品药品检定研究院。盆炎净胶囊(湖南东润联合制药有限公司,批号分别为20140302、20140415、20151221、20150524、20151213、20141105、20150126);乙腈、甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱为SHIMADZU VP-ODS-C18(250 mm× 4.6 mm,5µm);流动相A为乙腈,B为0.15%磷酸溶液,梯度洗脱(见表1);流速:1.0 mL/min;波长:231、255、326 nm;柱温:30℃;进样量:20µL。
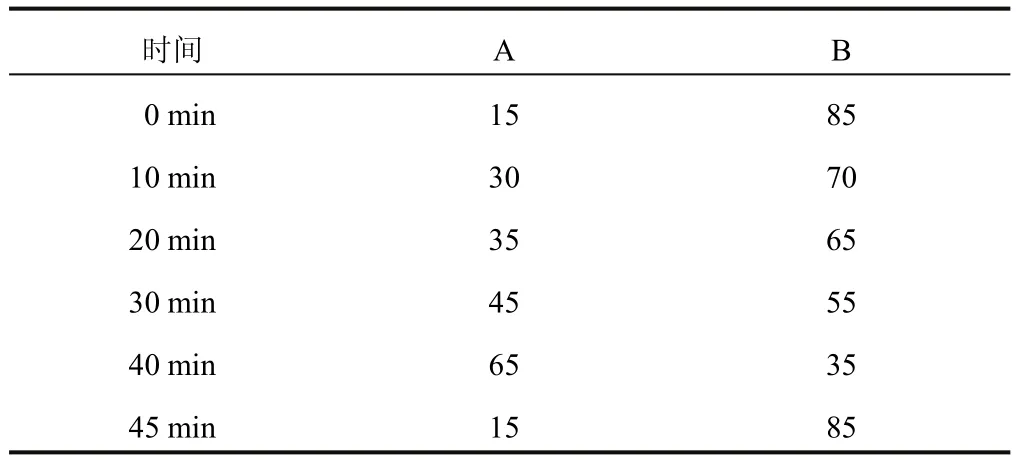
表1 流动相梯度洗脱程序
2.2 对照品溶液制备
精密称定芍药苷、原儿茶酸和绿原酸对照品适量,置于同一量瓶中,加乙腈溶解稀释,制成每1 mL含芍药苷250.90µg、原儿茶酸270.55µg和绿原酸19.05µg的混合对照品溶液。
2.3 供试品溶液制备
取盆炎净胶囊内容物约0.2 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇25 mL,称定质量,超声提取(功率300 W,频率40 kHz)30 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,过滤,滤液过微孔滤膜(0.45µm),取续滤液,即得。
2.4 阴性对照溶液制备
忍冬藤、蒲公英、鸡血藤、狗脊、车前草、赤芍、川芎中均含有芍药苷、原儿茶酸和绿原酸3种有效成分中的1种或多种,故按处方配比制成只有益母草(缺忍冬藤、蒲公英、鸡血藤、狗脊、车前草、赤芍、川芎)的阴性样品,按“2.3”项下方法制备,即得。
2.5 专属性试验及系统适用性试验
在“2.1”项色谱条件下,混合对照品与供试品溶液中3种有效成分达到基线分离,色谱图见图1。芍药苷、原儿茶酸、绿原酸各色谱峰与相邻色谱峰的分离度均>1.5,理论塔板数按芍药苷峰计均>3000。
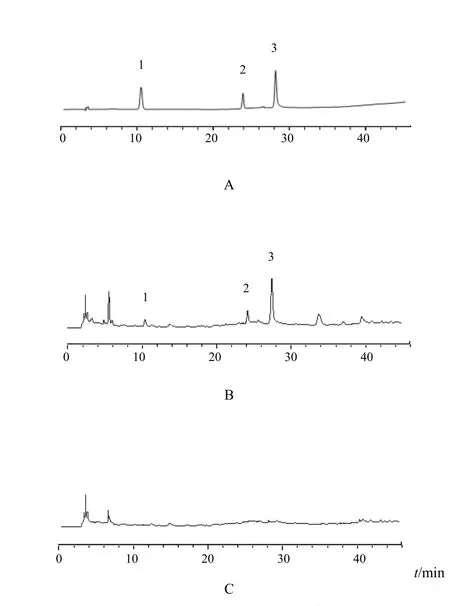
图1 盆炎净胶囊中芍药苷、原儿茶酸、绿原酸HPLC图(λ=231 nm)
2.6 线性关系考察
精密吸取混合对照品溶液300、500、1000、1500、2000、2500µL,分别置于10 mL量瓶中,用乙腈稀释至刻度,摇匀。在上述色谱条件下,吸取各浓度混合对照品溶液20µL注入高效液相色谱仪,记录色谱峰面积。以峰面积为纵坐标,混合对照品进样量(ng)为横坐标,绘制标准曲线,进行线性回归,得回归方程:芍药苷(λ=231 nm)Y=1546.412 8X+127.075 6(r=0.999 9),线性范围150.054~1254.50 ng;原儿茶酸(λ=255 nm)Y=2925.846 8X+2204.107 6(r=0.999 8),线性范围162.33~1352.75 ng;绿原酸(λ=326 nm)Y=893.904 5X-261.731 5(r=0.999 4),线性范围11.43~95.25 ng。
2.7 精密度考察
取同一对照品溶液20µL,连续进样5次,记录色谱峰峰面积,芍药苷、原儿茶酸和绿原酸色谱峰峰面积的RSD分别为0.7%、0.4%、0.5%,表明仪器精密度良好。
2.8 重复性试验
按“2.3”项下方法重复制备5份同一批号的供试品溶液,分别进行测定,记录色谱峰峰面积,芍药苷、原儿茶酸和绿原酸色谱峰峰面积的RSD分别为1.5%、1.3%、1.9%。表明本方法重复性良好。
2.9 稳定性试验
精密吸取同一供试品溶液20µL,在上述色谱条件下,分别在0、2、4、6、12 h进样测定,记录色谱峰峰面积,芍药苷、原儿茶酸和绿原酸色谱峰峰面积的RSD分别为1.3%、1.0%、1.2%。表明3种有效成分在12 h内稳定。
2.10 加样回收试验
精密称取已知含量的盆炎净胶囊样品6份(每份内容物0.1 g),精密加入2.0 mL混合对照品溶液(相当于芍药苷501.80µg、原儿茶酸541.10µg、绿原酸38.10µg),按“2.3”项下方法制备供试品溶液,并按上述色谱条件进行测定,经计算,加样回收率分别为97.60%、102.09%、98.52%,RSD分别为1.39%、1.53%、1.12%,表明回收率良好。结果见表2。

表2 盆炎净胶囊中3种成分加样回收率试验
2.11 样品测定
分别精密称取10份不同批号的盆炎净胶囊,每份约0.2 g,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定,各被测组分与共存组分实现基线分离,采用外标法计算样品中各成分的含量,结果见表3。
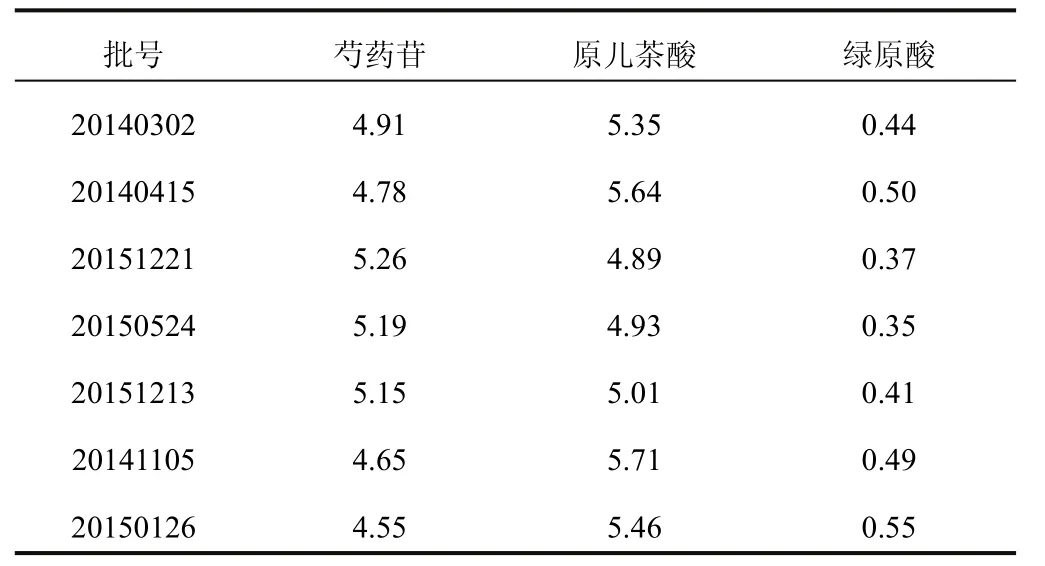
表3 盆炎净胶囊中各成分含量测定(mg/g)
3 讨论
本试验根据芍药苷、原儿茶酸和绿原酸的性质,对供试品溶液的制备方法进行了条件筛选。提取溶剂比较了纯甲醇、75%甲醇、50%甲醇、95%乙醇、75%乙醇、50%乙醇、水等的提取效果,结果表明,甲醇提取效果比乙醇好,而甲醇3个浓度的提取效果相近,考虑到成本,选定50%甲醇作为提取溶剂;提取方式比较了超声和回流对提取效果的影响,结果显示,超声提取效率优于回流提取;提取时间比较了超声15、30、60 min对测定结果的影响,结果显示,超声提取30、60 min的效果相近,均明显优于15 min提取效果,综合能量消耗及生产效率等因素,选定提取时间30 min。因此,最终选择50%甲醇作为提取溶剂,超声提取30 min制备供试品溶液。
本试验对色谱条件进行优选,采用二极管阵列检测器在波长200~400 nm范围内扫描,发现芍药苷在231 nm、原儿茶酸在255 nm、绿原酸在326 nm处有最大吸收,为提高分析方法的灵敏度,减少干扰,本研究采用多波长检测方法;考察不同色谱柱Agilent ZORBAX SB-C18(250 mm×4.6 mm,5µm)、Phenomenex Gemini C18(250 mm×4.6 mm,5µm)和SHIMADZUVP-ODS-C18(4.6 mm×250 mm,5µm)的峰形、柱效和分离度,结果显示,以SHIMADZU VP-ODS-C18为最佳;试验比较了乙腈-水、乙腈-0.15%磷酸、甲醇-水、甲醇-0.15%磷酸等不同比例的流动相系统进行梯度洗脱,结果表明,以乙腈-0.15%磷酸为流动相梯度洗脱,基线平稳,供试品各成分峰保留时间适中,分离度和峰形最佳。最终优选色谱条件为:SHIMADZU VP-ODS-C18色谱柱(4.6 mm× 250 mm,5µm),流动相为乙腈-0.15%磷酸水溶液,梯度洗脱,流速1.0 mL/min,检测波长分别为231、255、326 nm,柱温30℃。在此条件下,基线平稳,分离效果好,因此所建立的方法能同时准确测定芍药苷、原儿茶酸和绿原酸的含量。
对盆炎净胶囊样品的测定结果表明,7个批次中均含有芍药苷、原儿茶酸和绿原酸,其中芍药苷和原儿茶酸含量比绿原酸高,但不同批次样品的3种成分含量有一定的差异,可能与药材及工艺流程有关,需进一步探讨。本研究建立了同时测定盆炎净胶囊中芍药苷、原儿茶酸和绿原酸含量的分析方法,方法简单、方便、准确,可为盆炎净胶囊、盆炎净颗粒及相关药材的质量控制提供借鉴。
[1]章庆.盆炎净胶囊联合抗生素治疗慢性盆腔炎28例临床观察[J].中医药导报,2011,17(6):37-38.
[2]谢晓梅,余长柱,徐衡,等.赤芍饮片质量标准研究——芍药苷的含量测定[J].中国中药杂志,2004,29(8):759-762.
[3]陈叶青.RP-HPLC法测定盆炎净胶囊中绿原酸的含量[J].中国药师, 2010,13(8):1205-1206.
[4]张聪,殷志琦,叶文才,等.忍冬藤的化学成分研究[J].中国中药杂志, 2009,34(23):3051-3053.
[5]翟明,刘军民,安冉,等.HPLC法测定鸡血藤类药材中原儿茶酸的含量[J].中药新药与临床药理,2009,20(5):462-465.
[6]原忠,余江天,苏世文.用薄层扫描法测定中药狗脊和黑狗脊中原儿茶酸及咖啡酸的含量[J].沈阳药科大学学报,2000,17(5):338-340.
[7]王文祥,顾明,蒋小岗,等.川芎化学成分研究[J].中草药,2002,33(1):4-5.
[8]张振秋.车前草的质量及应用研究[D].沈阳:辽宁中医学院,2001.
[9]周海婴,王斯成.HPLC法测定盆炎净胶囊中芍药苷的含量[J].中国医药导报,2007,4(2):159-160.
[10]明全忠,董媛,刘春霞.RP-HPLC测定盆炎净颗粒中芍药苷的含量[J].中成药,2006,28(6):922-923.
[11]朱翔宇,杨莲菊,李春.HPLC测定五灵脂中原儿茶酸含量[J].中国实验方剂学杂志,2010,16(6):71-73.
Simultaneous Contents Determination of Three Active Ingredients in Penyanjing Capsules by HPLC
YUAN Zhi-ying1,YANG Yan-tao1,LI Rong-dong1,LI Zhe1,OUYANG Ji-de2
(1.Hunan University of Chinese Medicine,Changsha 410208,China;2.Chenzhou Institute for Food and Drug Control,Chenzhou 423000, China)
Objective To establish an HPLC method for simultaneous contents determination of paeoniflorin, protocatechuic acid and chlorogenic acid in Penyanjing Capsule.Methods The chromatographic separation was performed on a SHIMADZU VP-ODS-C18 column(4.6 mm×250 mm,5µm);the column temperature was maintained at 30℃;A gradient elution of acetonitrile-0.15%phosphoric acid aqueous solution was adopted at the flow rate of 1.0 mL/min;The UV detection wavelengths were at 231,255,and 326 nm;The injection volume was 20 µL.Results Paeoniflorin,protocatechuic acid and chlorogenic acid could be separated efficiently with this condition. The regression equation was Y=1546.412 8X+127.075 6(r=0.999 9),Y=2925.846 8X+2204.107 6(r=0.999 8), Y=893.904 5X-261.731 5(r=0.999 4),respectively.Paeoniflorin,protocatechuic acid and chlorogenic acid were linear in the range of 150.054–1254.50 ng,162.33–1352.75 ng,11.43–95.25 ng,and the average recoveries were 97.60%,102.09%and 98.52%.Conclusion The method is simple,convenient and accurate,which can be used to the quality control of Penyanjing Capsule.
Penyanjing Capsule;paeoniflorin;protocatechuic acid;chlorogenic acid;HPLC
10.3969/j.issn.1005-5304.2017.05.019
R284.1
:A
:1005-5304(2017)05-0082-04
2016-06-14)
(
2016-07-14;编辑:陈静)
湖南省自然科学基金(13JJ5032);湖南省教育厅优秀青年项目(15B172);湖南省中医药管理局科研项目(201494);湖南中医药大学青年教师科研基金(2015-13);湖南中医药大学中药技能大学生创新实验项目(201603)
杨岩涛,E-mail:xdyyt1@163.com
