伴神经元移行异常脑性瘫痪儿童的临床特征及疗效分析
2017-04-28赵勇金炳旭刘振寰
赵勇,金炳旭,刘振寰
伴神经元移行异常脑性瘫痪儿童的临床特征及疗效分析
赵勇,金炳旭,刘振寰
目的回顾性分析伴神经元移行异常(NMD)脑瘫的临床特点及疗效。方法选取2005年6月至2015年6月在本科进行综合康复治疗的伴NMD脑瘫患儿(NMD组,n=32)和同期康复治疗的运动、智力水平近似的伴有脑室周围白质软化症(PVL)脑瘫患儿(PVL组,n=60)。分析比较两组脑瘫临床分型、癫痫及癫痫样放电共患病以及综合康复治疗对两组患儿粗大运动功能测试(GMFM)评分和Gesell发育诊断量表发育商(DQ)的影响。同时,对治疗6个月后的随访结果进行统计分析。结果两组脑瘫临床分型存在非常高度显著性差异(χ2=24.529,P<0.001)。NMD组癫痫及癫痫样放电共患病发生率均高于PVL组(χ2>4.605,P<0.05)。综合康复治疗后,两组GMFM评分随时间均升高(F时间=6.850,P=0.010),NMD组GMFM评分显著低于PVL组(F组间=29.885,P<0.001);各功能区DQ得分随时间逐渐增高(F时间>25.041,P<0.001),NMD组各功能区DQ得分显著低于PVL组(F组间>32.347,P<0.001)。结论伴NMD脑瘫癫痫伴发率高,临床表现以智力发育障碍和痉挛型偏瘫为主,综合康复治疗疗效差,预后不良。
脑性瘫痪;神经元移行异常;脑室周围白质软化症;临床特征;临床疗效
[本文著录格式]赵勇,金炳旭,刘振寰.伴神经元移行异常脑性瘫痪儿童的临床特征及疗效分析[J].中国康复理论与实践, 2017,23(4):433-437.
CITED AS:Zhao Y,Jin BX,Liu ZH.Clinical characteristics and efficacy analysis of children with cerebral palsy and neuronal migration disorders[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(4):433-437.
脑瘫是一组持续存在的中枢性运动和姿势发育障碍、活动受限症候群[1]。研究资料显示[1],70%的脑瘫患儿有其他伴随症状及共患病,依次为智力发育落后、癫痫、语言障碍、视觉障碍、听力障碍以及吞咽障碍等。脑瘫的病因主要为脑组织的损伤或发育缺陷,其病理改变主要是脑白质损伤、脑部发育异常、颅内出血、脑部缺氧引起的脑损伤等。随着社会生活环境的改变,孕期因物理、化学和生物性损害以及遗传因素导致脑部神经元移行异常(neuronal migration disorders,NMD),主要包括无脑回-巨脑回畸形、多小脑回畸形、脑裂畸形、灰质异位等,脑瘫、智力低下及癫痫为其主要临床特征[2]。随着神经影像技术的发展,对此类疾病的认识逐渐提高[3]。查阅文献显示,关于脑白质损伤、颅内出血、脑部缺氧等产后因素致脑瘫的临床疗效文献较多,鲜有关于伴NMD脑瘫临床疗效分析的文献报道。因此,本文对本科近10年治疗伴NMD脑瘫的临床特点及综合康复疗效进行回顾性分析,并与脑瘫最常见影像学异常脑室周围白质软化症(periventricular leukomalacia,PVL)进行对照。
1 资料与方法
1.1 一般资料
共收集2005年6月至2015年6月在本科进行综合康复治疗的伴有NMD的脑瘫患儿32例,作为NMD组;选同期康复治疗的运动功能及智力水平近似伴有PVL的脑瘫患儿60例作为PVL组。NMD组中,男性21例,女性11例;年龄12~23个月,平均(16.11± 4.06)个月;巨脑回畸形21例,灰质异位5例,脑裂畸形4例,无脑回-巨脑回畸形2例;伴癫痫17例,伴癫痫样放电11例。PVL组中,男性48例,女性12例;年龄13~21个月,平均(16.05±3.28)个月;伴癫痫10例,伴脑癫痫样放电9例。
入组患儿符合2004年全国小儿脑性瘫痪专题研讨会制定的小儿脑性瘫痪诊断标准[4]:①引起脑瘫的脑损伤为非进行性;②引起运动障碍的病变部位在脑部;③症状在婴儿期出现;④有时并发智力障碍、癫痫、感知觉障碍及其他异常;⑤除外进行性疾病所致的中枢性运动障碍及正常小儿暂时性的运动发育迟缓;⑥PVL组头颅MRI诊断为PVL,NMD组头颅MRI诊断为巨脑回畸形、无脑回畸形、脑裂畸形、灰质异位等NMD。
纳入标准:①年龄1~2岁;②坚持综合康复治疗3个月,并于疗程结束后6个月完成随访。
排除标准:①伴有严重心肺疾患;②伴有遗传代谢疾病;③进行性疾病所致的中枢性运动障碍。
两组患儿性别、年龄、粗大运动功能测试(Gross Motor Function Measure,GMFM)评分和发育商(development quotient,DQ)比较无显著性差异(P>0.05)。见表1。
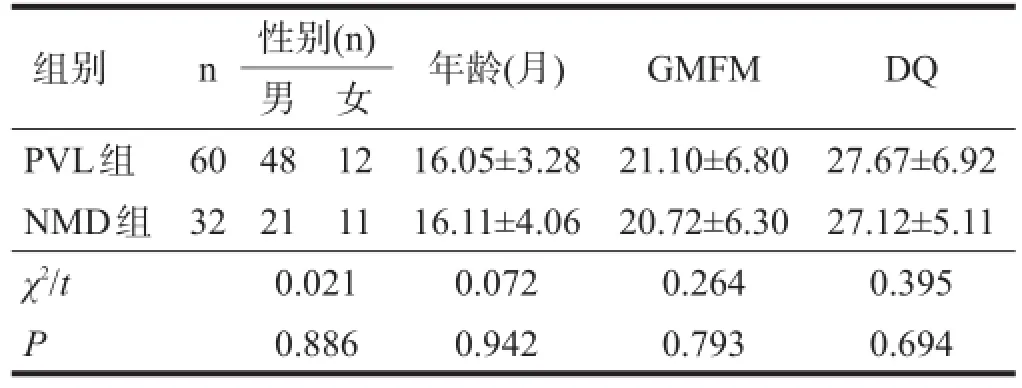
表1 两组一般情况比较
1.2 治疗方法
1.2.1 运动疗法
以Bobath疗法为主,并参考本科编写的《儿童运动发育迟缓康复训练图谱》[5]第3章内容,结合患儿运动发育状况选择针对性的训练方法,每次40 min,每天1次,每周6 d,治疗3个月。
1.2.2 推拿疗法
参照本科编写的《儿童运动发育迟缓康复训练图谱》[5],根据患儿运动、智力发育及伴随障碍,选择该书第6章中针对性的按摩手法,每天1次,每周6次,治疗3个月。
1.2.3 头针疗法
主要选穴包括智七针(四神聪、神庭、本神)、运动区、足运感区、平衡区,神庭穴向前下平刺,本神穴向后平刺,四神聪向后平刺,留针1~2 h,隔天1次,每周3次,10次为1个疗程,治疗3个疗程,每两个疗程中间休息15~20 d[6]。
1.2.4 体针
主要选穴包括督脉十三针、腰段华佗夹脊穴、足三里、阳陵泉、三阴交。常规针刺后留针10~15 min,隔天1次,每周3次,疗程同头针疗法[7]。
1.2.5 穴位注射
主穴取哑门、风池、肾俞、大椎、内关。药物选择复方麝香注射液(安徽金太阳生化药业有限公司,每支10 ml,注意红细胞葡萄糖-6-磷酸脱氢酶缺乏症患儿不宜使用),丹参注射液(四川省宜宾五粮液集团宜宾制药有限责任公司,每支10 ml),每次取4~6穴,常规消毒刺入回抽无血后,每穴注入0.5 ml,隔天1次,每周3次,疗程同头针疗法[8]。
1.2.6 物理因子治疗
肌电生物反馈治疗仪(南京伟思医疗科技股份有限公司),针对患儿运动功能选择靶肌群,各肌群刺激参数自动生成,强度20~35 mA(根据患儿耐受情况),每次20 min,每天1次,每周6次,10~15次为1个疗程。
1.2.7 其他治疗
伴有精细动作障碍者进行作业治疗,每次30 min,每天1次,每周6 d,治疗3个月;伴有言语障碍者予言语训练,每次30 min,每周3次,治疗3个月;伴有社交及行为障碍者进行音乐心理及特殊教育治疗,每次30~40 min,每天1次,每周3次。
1.3 评价标准
1.3.1 Gesell发育诊断量表[9]
适用于0~6岁儿童,对儿童智力发育具有可靠的诊断价值,包括大运动、精细运动、语言、个人社交、社会适应五个能区。

边缘状态:76~85。轻度智力落后:55~75。中度智力落后:40~54。重度智力落后:25~39。极重度智力落后:<25。
1.3.2 GMFM[10]
该量表包括88项,分为卧位与翻身、坐位、爬与跪、站立位、行走与跑跳5个能区,卧位与翻身能区为51分,坐位能区60分,爬与跪能区为42分,立位能区为39分,行走与跑跳能区分为72分。各能区百分比=(能区所得总分/能区原始分)×100%。总百分比= 5个能区得分的平均分×100%。选取治疗前、治疗3个月和6个月随访的数据进行统计分析。
1.4 统计学分析
应用SPSS 21.0软件进行统计分析。计量资料采用(xˉ±s)表示,组内比较用配对样本t检验,组间比较用独立样本t检验,均采用双侧检验;重复测量数据采用重复测量数据的方差分析;计数资料用χ2检验。显著性水平ɑ=0.05。
2 结果
2.1 脑瘫分型
两组脑瘫临床分型比较有非常高度显著性差异(P<0.001)。见表2。
2.2 癫痫及癫痫样放电共患病率
NMD组共患癫痫、癫痫样放电率高于PVL组(P<0.05)。见表3。
2.3 GMFM评分
两组治疗开始前GMFM评分无显著性差异(P>0.05)。两组患儿随着治疗时间的推移,GMFM得分逐渐升高(P<0.05)。治疗3个月和6个月随访时,NMD组GMFM评分显著低于PVL组(P<0.001)。见表4。
2.4 DQ得分
两组随着治疗时间的推移,各功能区DQ得分逐渐增高(P<0.001),NMD组各功能区DQ得分均显著低于PVL组(P<0.001)。见表5。

表2 两组脑瘫患儿临床分型比较[n(%)]
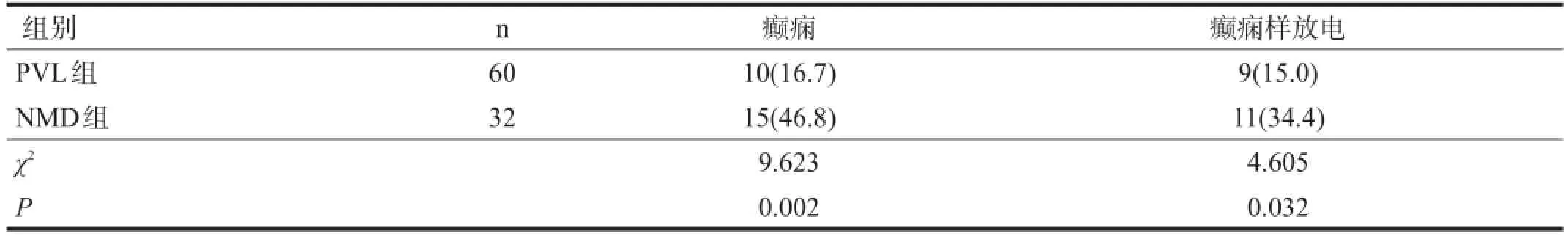
表3 NMD组和PVL组伴癫痫或癫痫样放电共患病比较[n(%)]
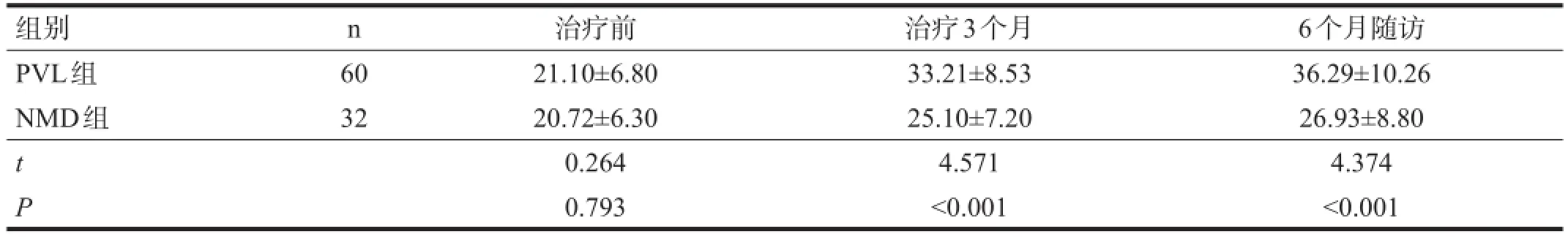
表4 两组不同时间GMFM评分变化
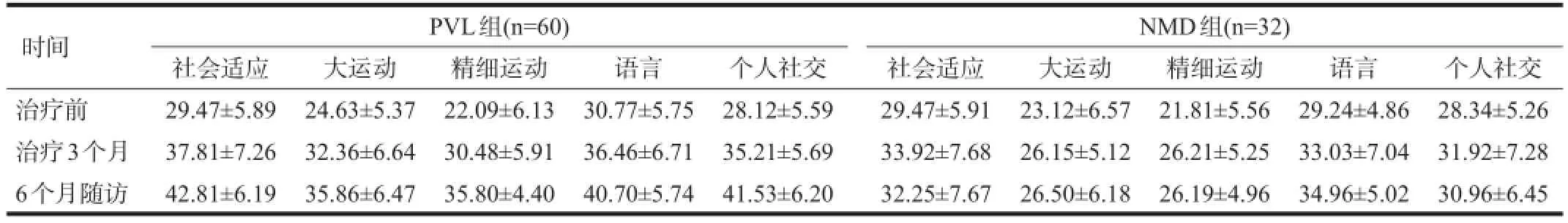
表5 两组不同时间DQ得分比较
3 讨论
随着对脑瘫认识水平的提高以及研究的不断深入,依据中国康复医学会第2届儿童康复学术会议所做的脑瘫定义,“脑瘫是自受孕开始至婴儿期非进行性脑损伤和发育缺陷所导致的综合征”[8],其中发育缺陷即包含孕期各种因素造成的先天性脑发育异常,NMD即是较为常见的先天性脑发育缺陷之一。
3.1 NMD及PVL发病机制
神经元移行是大脑发育过程中一个复杂而有序的过程,发生于胚胎2~6个月,持续3个月左右。这一时期由室周神经母细胞上皮有丝分裂形成的神经元将向外移行,然后在软膜下形成前皮质板;之后产生的神经元移行到前皮质板中间,把前皮质板分为表面的分子层和深部的皮质下板。后续产生的移行神经元都将陆续通过皮质下板和皮质板而停止在Ⅰ层以下,最终形成Ⅵ、Ⅴ、Ⅳ、Ⅲ和Ⅱ皮质层,这即是大脑皮质形成的“内侧外翻”模式[11]。神经元移行过程正常完成后构成神经系统的功能单位。如果在移行过程中受到有害因素,包括物理因素(如射线等[12])、化学因素(如抗癫痫药物[13]、感染、代谢异常以及遗传因素[12]等干扰则造成移行障碍,使神经元聚集在皮层内或皮层外,导致一系列畸形发生,常见的有无脑回-巨脑回畸形、脑裂畸形[14]、灰质异位、多小脑回畸形等[15-17]。
NMD以皮层受累为主,越早发生畸形越重,临床表现主要是智力低下、癫痫及脑瘫[2,18]。NMD不一定出现脑瘫的症状,出现脑瘫症状的患儿可能与神经元的移行异常造成中央前回的锥体细胞发育缺陷及锥体束中出现异常灰质有关。另外胡文瀚等[19]通过动物实验发现,N-甲基-D-天门冬氨酸受体表达的上调可能是NMDs患者致痫的主要原因。
PVL主要是由于早产、缺血缺氧性脑病以及感染等造成的髓鞘形成障碍,其病理改变主要损伤轴索和少突胶质细胞,造成脑白质减少或坏死[20],主要发生在出生至生后18个月,临床表现以痉挛型脑瘫为主,常伴有智力障碍等[21]。两者的发病时间、发病机理不同,但都有可能造成脑瘫。
3.2 NMD的诊断
NMD的表现非特异性,很难仅通过病史及临床表现进行诊断,确诊主要依靠影像学检查。目前产前超声检查可以观察到胎儿皮质发育情况,在孕中期即可发现皮质发育的可疑异常表现,并可于孕22~24周通过胎儿MRI检查加以验证。出生后通过头颅CT或头颅MRI检查,可以比较可靠、准确地诊断NMD[3,22-23]。
3.3 脑瘫儿童的康复治疗
脑瘫的临床康复国外以物理治疗为主,国内以中西医结合康复治疗为主[24-25]。大量的文献资料显示[26-27],由PVL为主因的痉挛型脑瘫经综合康复治疗,其运动功能均有不同程度的提高,使轻、中度脑瘫患儿获得独立行走功能的机会大大提高,伴有的智力障碍亦有一定程度的改善。
本文的研究结果与文献报道相吻合,PVL为主因的脑瘫患儿经3个疗程的综合康复治疗,其GMFM、DQ各能区评分显著提高,治疗后6个月随访结果较治疗结束时亦提高。2岁以前儿童脑发育迅速,可塑性强,自我修复能力好。因此,通过物理治疗、针刺等综合康复治疗,反射性刺激中枢神经系统,改善大脑血液循环,促进大脑连合系、联络系和投射系各种脑白质的重塑,临床表现为肌张力降低,患儿逐步获得坐、站、走的运动功能。
NMD为主因的脑瘫临床疗效鲜有文献报道,这可能与NMD主要以智力低下、癫痫等表现为主,对于该类患儿的运动功能康复尚未引起重视有关。本研究结果显示,此类患儿经综合康复治疗GMFM、DQ各能区评分具有一定程度的提高,但康复疗效显著低于PVL组,治疗后6个月随访结果与治疗结束时基本持平,说明以NMD为主因的脑瘫儿童神经发育缓慢,疗效不理想,预后较差。这可能与NMD的发生机制以及智力低下、癫痫有关。
综上所述,通过回顾性研究,发现伴有NMD的脑瘫患儿发病类型以偏瘫为主,临床中多伴有癫痫或癫痫样脑电图异常,以及较严重的智力发育障碍,其发生机制及伴发的智力低下、癫痫等可能影响该类患儿的康复疗效;与PVL造成的脑瘫相比,综合康复治疗效果不理想,预后较差。今后研究中将进一步跟踪其远期预后,探讨建立更适合该类病因所造成脑瘫的康复方案,以期提高临床康复疗效。
[1]中国康复医学会儿童康复专业委员会,中国残疾人康复协会小儿脑性瘫痪康复专业委员会,《中国脑性瘫痪康复指南》编委会.中国脑性瘫痪康复指南(2015):第一部分[J].中国康复医学杂志,2015,30(7):747-754.
[2]陈春红,金真,吴沪生,等.神经元移行异常的临床特征和诊断[J].中华儿科杂志,2005,43(4):248-251.
[3]陈春红,吴沪生.神经元移行异常研究进展[J].国外医学儿科学分册,2005,32(4):243-246.
[4]中华医学会儿科学分会神经学组(2004年10月昆明2004年全国小儿脑性瘫痪专题研讨会讨论通过).小儿脑性瘫痪的定义、诊断条件及分型[J].中华儿科杂志,2005,43(4):261-262.
[5]刘振寰.儿童运动发育迟缓康复训练图谱[M].北京:北京大学医学出版社,2014:53-165,210-297.
[6]刘振寰.小儿脑瘫的头针治疗[J].中国康复,2000,15(1):36.
[7]刘振寰.针灸治疗脑性瘫痪的效果评估:150例随机分组对照[J].中国组织工程研究,2004,8(6):1091-1093.
[8]张春涛,刘振寰.穴位注射联合针刺治疗痉挛型小儿脑瘫68例临床分析[J].海峡药学,2016,28(3):185-186.
[9]金炳旭,符文杰,钱旭光,等.基于正交设计的不同头针方案的脑性瘫痪临床疗效研究[J].中国康复医学杂志,2014,30(6):591-593.
[10]Lee M,Ko Y,Shin MM,et al.The effects of progressive functional training on lower limb muscle architecture and motor function in children with spastic cerebral palsy[J].J Phys Ther Sci,2015,27(5):1581-1584.
[11]Bielas S,Higginbotham H,Koizumi H,et al.Cortical neuronal migration mutants suggest separate but intersecting pathways[J].Annu Rev Cell Dev Biol,2004,20(20):593-618.
[12]黄华,晏勇.新皮质神经元移行障碍发病机理的研究进展[J].中国临床解剖学杂志,2008,26(4):461-463.
[13]Kaindl AM,Asimiadou S,Manthey D,et al.Antiepileptic drugs and the developing brain[J].Cell Mol Life Sci,2006,63 (4):399-413.
[14]赵亚波,王波,杜森.脑裂畸形CT及磁共振成像诊断一例[J].实用医学影像杂志,2015,16(3):276
[15]刘影,李笃民,石磊,等.神经元移行异常的MRI诊断[J].实用放射学杂志,2005,21(5):471-474.
[16]吴雪峰,陈丽,李洪亮,等.神经元移行异常的CT诊断[J].实用医技杂志,2013,20(2):130-132.
[17]Hamad AP,Caboclo LO,Centeno R,et al.Hemispheric surgery for refractory epilepsy in children and adolescents:outcome regarding seizures,motor skills and adaptive function[J].Seizure,2013,22(9):752-756.
[18]朱丽婕,张波,张承业.神经元移行畸形的CT诊断分析[J].医学影像,2007,4(33):103-104.
[19]胡文瀚,张凯,马羽,等.神经元移行异常的大鼠脑皮层中NMDA的表达[J].立体定向和功能性神经外科杂志,2007, 20(5):276-279.
[20]党连荣.脑室周围白质软化症的CT征象分析[J].中国临床医学影像杂志,2015,26(9):612-615.
[21]朱立乾.儿童脑室周围白质软化症的MRI诊断[J].医学影像学杂志,2013,23(1):155-156.
[22]章辉庆,吴昊,邱晓晖,等.先天性神经元移行异常的CT及MRI诊断价值[J].安徽医药,2014,18(2):292-294.
[23]尹春红,刘凯.神经元移行异常的3D-FSPG评价[J].医学影像学杂志,2016,26(1):116-118.
[24]黄文娟,杨志远,朱毅.小儿脑瘫治疗国内外现状、水平和发展趋势-儿童福利院脑瘫医疗康复模式的组建[J].医学信息, 2010,21(1):289-290.
[25]姜凡,孙忠人,郭玉怀,等.头针为主治疗小儿脑瘫的临床研究进展[J].山东中医杂志,2016,35(7):663-665.
[26]司同,张素洁.针刺治疗痉挛型小儿脑瘫的的临床研究[J].中国康复理论与实践,2011,17(6):576-577.
[27]覃章平.肌力训练对痉挛型脑瘫患儿粗大运动功能的影响[J].中国医学工程,2009,17(4):271-273.
Clinical Characteristics and Efficacy Analysis of Children with Cerebral Palsy and Neuronal Migration Disorders
ZHAO Yong,JIN Bing-xu,LIU Zhen-huan
Department of Children Nerve Rehabilitation of Nanhai Maternity and Kid Hospital,Guangzhou University of TCM,Foshan,Guangdong 528200,China
ZHAO Yong.E-mail:tcmdoctor@163.com
Objective To discuss the clinical characteristics and efficacy analysis of children with cerebral palsy and neuronal migration disorders(NMD)by retrospective analysis.Methods From June,2005 to June,2015,32 children with cerebral palsy and NMD were enrolled as NMD group,while 60 children with cerebral palsy with periventricular leukomalacia(PVL)as PVL group.Both groups received comprehensive rehabilitation for three months.Their clinical classification,complications of epilepsy or epileptiform discharges,the score of Gross Motor Function Measure(GMFM),and development quotient(DQ)were compared,as well as the follow-up results of six months. Results There was significant difference in the clinical classification of cerebral palsy between two groups(χ2=24.529,P<0.001).The incidence of epilepsy and epileptiform discharges was higher in NMD group than in PVL group(χ2>4.605,P<0.05).After treatment,the score of GMFM improved with time in both groups(Ftime=6.850,P=0.010),and was significantly lower in NMD group than in GMFM group(Fgroup= 29.885,P<0.001);the scores of DQ in all the functional areas improved with time in both groups(Ftime>25.041,P<0.001),and were significantly lower in NMD group than in GMFM group(Fgroup>32.347,P<0.001).Conclusion Children with cerebral palsy and NMD are characterized by mental retardation,epilepsy and spastic hemiplegia,and poor outcome.
cerebral palsy;neuronal migration disorders;periventricular leukomalacia;clinical characteristics;efficacy analysis
R742.3
A
1006-9771(2017)04-0433-05
2016-07-26
2017-01-21)
10.3969/j.issn.1006-9771.2017.04.015
广州中医药大学附属南海妇产儿童医院儿童神经康复科,广东佛山市528200。作者简介:赵勇(1975-),男,汉族,山东济南市人,硕士,副主任中医师,主要研究方向:儿童脑神经康复。E-mail:tcmdoctor@163.com。
