海藻酸钠微球制备工艺优化及其对球形及粒径的影响
2017-04-27黄敏刘兴勇李玉宝张利
黄敏, 刘兴勇, 李玉宝, 张利
(1.四川大学a.分析测试中心;b.纳米生物材料研究中心, 成都610064;2.四川理工学院化学与环境工程学院, 四川自贡643000)
海藻酸钠微球制备工艺优化及其对球形及粒径的影响
黄敏1a,1b, 刘兴勇2, 李玉宝1a,1b, 张利1a,1b
(1.四川大学a.分析测试中心;b.纳米生物材料研究中心, 成都610064;2.四川理工学院化学与环境工程学院, 四川自贡643000)
选用相容性好、无毒且可降解的海藻酸钠作为基质材料,采用W/O乳化-离子交联法制备海藻酸钠微球。考察了内外部固化方法、油/水相体积比、乳化剂用量、搅拌速度以及海藻酸钠溶液质量分数等主要工艺参数对微球形貌、粒径大小及分布的影响,从而确定较为理想的微球制备工艺。实验结果显示,当油/水相体积比1∶1、乳化剂用量为6滴司盘-80和2滴吐温-80、搅拌速度500 r/min、海藻酸钠溶液质量分数为2%以及使用外部固化法时,制备得到的海藻酸钠微球球形度较好,粒径分布较窄,主要在7 μm~40 μm范围内,其在水中分散性良好。在所有工艺条件中,水相中海藻酸钠的质量分数对微球粒径和分散性起主要作用。
海藻酸钠;微球;离子交联法
引言
微球作为微存储器可以保护并存储某些物质,并可在特定时间、特定地点,以一定速度释放一定量的某些物质,其最典型的应用就是药物输送系统[1-4]。
药物缓释微球是用特殊材料将药物包埋制成微球制剂,使药物缓慢释放,延长吸收、分布及作用时间,降低血药浓度忽高忽低所致的副作用,并可减少药物投放量和投放次数,从而降低毒副作用。其中海藻酸钠微球因其优良降解性及温和的制备工艺已成为一类极具开发潜力的新型载体,受到广大学者的广泛关注[2]。
海藻酸钠是由β-D-甘露糖醛酸(M)和α-L-古洛糖醛酸(G)两种结构单元组成,并通过α-1,4-糖苷键连接而成的线性嵌段共聚物。由于海藻酸钠分子主链上带有羧基,其在与二价阳离子(Ca2+,Sr2+,Ba2+等)接触瞬间,通过古洛糖酸上的Na+与二价阳离子交换而发生凝胶化,并形成热不可逆凝胶。由于古洛糖酸残基之间的堆叠,形成了特征化的蛋形空间结构,二价阳离子与古洛糖单元就是以这种高协同方式约束在一起。每一条海藻酸链都能够形成二聚体并同其他链形成汇合点,最终形成凝胶网络[5-7]。
海藻酸钠微球正是基于其溶液与二价阳离子之间的离子交换和交联,通过其凝胶化过程而形成的。海藻酸钠微球的制备方法有多种,包括:喷雾干燥法、复乳法、W/O型离子交联法(包括内部固化法和外部固化法)等[8-10]。然而,由于目前大多工作主要放在海藻酸钠微球的应用研究上[3,11-14],忽视了其基础工艺参数的研究和探讨,而基础工艺如搅拌速率、乳化剂含量等因素对微球的形貌、粒径等会造成很大影响。由于喷雾干燥法需要较高的温度,对微球负载的药物或因子有选择性;复乳法制备方法过于复杂,不易工业放大。W/O型离子交联法工艺条件温和,制备方法简单易行,是制备海藻酸钠微球的首选和最常用技术[7]。
本文将重点考察工艺条件对W/O型离子交联法所制备海藻酸钠微球形貌及粒径的影响,从而对其制备条件进行优化筛选,为今后海藻酸钠微球的改性提供初步的实验依据。
1材料与方法
1.1实验材料
海藻酸钠(SA),壳聚糖,液体石蜡,司盘-80,吐温-80,无水氯化钙,戊二醛,碳酸钙,冰乙酸,石油醚,异丙醇,正丁醇。以上试剂均为分析纯。
1.2海藻酸钠微球的制备
1.2.1W/O乳化-离子交联法(外部固化法)
取30 mL液体石蜡置于100 mL锥形瓶中,于40 ℃水浴条件下加入乳化剂司盘-80和吐温-80,搅至均匀后作为油相。以海藻酸钠溶液为水相,并将其加入油相中,一定转速下搅拌30 min,使其分散均匀形成W/O型乳液。加入3 wt%的CaCl2溶液,在较低转速下交联固化30 min,加入一定量石油醚搅拌10 min,离心分离后,再用异丙醇反复洗涤3次,最后于50 ℃下干燥可制得海藻酸钠微球。
根据单因素考察结果,固定CaCl2的浓度、固化时间,以油水相比例、乳化剂中司盘-80与吐温-80的用量、搅拌速度、海藻酸钠质量分数四个因素为变量,研究不同因素水平对微球成球状况的影响。以此设计出五组实验方案(表1)。
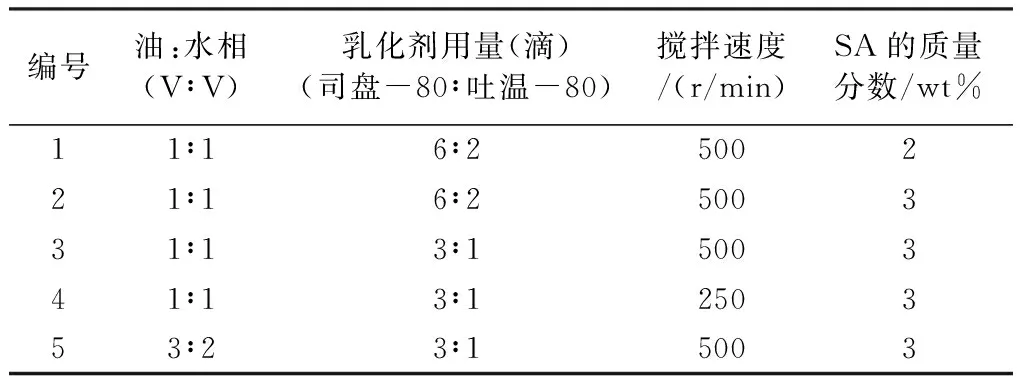
表1实验方案
1.2.2W/O乳化-离子交联法(内部固化法)
在干燥锥形瓶中加入30 mL液体石蜡和6滴司盘-80后搅拌均匀作为油相。配制3 wt%的海藻酸钠溶液30 mL,静置除去气泡后加入0.5 g碳酸钙粉末并充分搅拌使碳酸钙均匀分散于海藻酸钠溶液中作为水相。将水相加入油相中并持续搅拌15 min,然后加入适量冰乙酸,继续搅拌15 min,再加入等体积3 wt%的氯化钙溶液并不断搅拌30 min使其反应完全,用11 wt%的吐温-80洗涤三次,再用蒸馏水充分洗涤,冷冻干燥即得海藻酸钠微球。
1.2.3形貌观察和粒径分析
将海藻酸钠微球分散于去离子水中,取少量分散后的微球样品平铺在载玻片上,用倒置荧光显微镜(TE2000-U)和扫描电子显微镜(JSM-6510LV)观察实验样品形貌和形态,并拍摄照片。然后通过ImageJ 软件用标尺测定每个微球大小,统计后绘制粒径分布图(统计数不少于500个微球)。
2结果与讨论
2.1W/O乳化-离子交联法(内部固化法)制备海藻酸钠微球
2.1.1油/水相体积比对微球形貌及粒径的影响
实验选用油相与水相的比例为1∶1和3∶2,在温度为40 ℃,海藻酸钠溶液质量分数为3%,乳化时间和交联固化时间均为30 min,分别加入乳化剂司盘-80和吐温-80的量为3滴和1滴,在500 r/min的搅拌速度下制备海藻酸钠微球。所得产物的光学显微镜照片和扫描电镜照片分别如图1、图2所示。
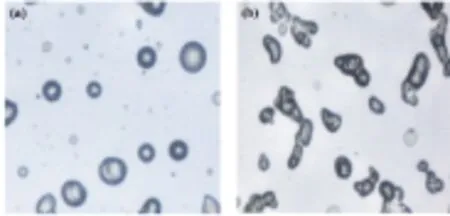
图1不同油水相比例制得的海藻酸钠微球光镜图

图2不同油水相比例制得的海藻酸钠微球扫描电镜图
由图1图2可知,当油相与水相体积比为1∶1时,所得微球大部分呈圆球形,形态完整,粒径分布较均匀,分散性良好,如图1(a)和图2(a)所示。而当油相体积大于水相体积,油/水相体积比为3∶2时,可明显观察到部分微球形态不够圆润,基本不呈球形,且粘连情况非常严重,难以测量和统计球径,故此处未绘制粒径分布图。分析可能的原因是,当水相体积小于油相体积时粘度过大,不利于乳化,且微球之间可能会发生粘连影响微球的形成。而当水相体积增大到与油相体积相等时形成的W/O型乳液体系粘度正好适合乳滴的分散和剪切,从而使形成的初乳液体系较稳定,有利于微球的形成。但是当水相体积继续增大到粘度太低时,则可能无法形成稳定的W/O型初乳体系,难以得到球形度较好的微球。
2.1.2乳化剂用量对微球形貌的影响
乳化剂是形成单个微球的关键,通过外力的搅拌将水相打散成小液滴,由于乳化剂的存在使得小液滴得以均匀分散在油相中形成乳状液(或称乳浊液),防止微球间的凝结。制备海藻酸钠微球时加到油相中的乳化剂一般是司盘-80和吐温-80。由于司盘-80和吐温-80相同的亲油基团,使二者具有较好的相似相容性,能够形成较单一司盘-80膜粘弹性大的致密的复合膜,同时吐温-80的较强的亲水基与司盘-80的较小的亲水基相互作用,使得司盘-80较难从乳化剂膜中游离到油相中,最终使复合膜的稳定性高于单一膜,得到较高稳定性的乳状液[15],防止乳液液滴聚集。实验以加入乳化剂的量为变量(分别为6滴司盘-80和2滴吐温-80、3滴司盘-80和1滴吐温-80),在温度为40 ℃,油相与水相体积比例为1∶1,海藻酸钠溶液质量分数为3%,乳化时间和交联固化时间均为30 min,搅拌速度为500 r/min的条件下制备海藻酸钠微球。所得合成物的光学显微镜照片,扫描电镜以及粒径分布图如图3~图5所示。
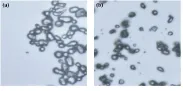
图3不同乳化剂量制得海藻酸钠微球的光镜图

图4不同乳化剂量制得海藻酸钠微球的扫描电镜图
由图3图4可知,用两种方法制得的微球大部分为椭球形或圆球形,球形相对完整,分散性较好,但少量有粘连状况发生。

图5不同乳化剂量制得海藻酸钠微球的粒径分布图
如图5所示,当加入乳化剂的量是6滴司盘-80和2滴吐温-80时,微球的中位粒径D50为20.36 μm,平均粒径为20.80 μm,大部分分布在14.78~27.49 μm(D10~D90)范围内;当加入乳化剂的量是3滴司盘-80和1滴吐温-80时,D50为22.38 μm,平均粒径为23.54 μm,大部分分布在14.47~33.71 μm(D10~D90)范围内。
实验结果表明,当加入司盘-80与吐温-80的比例不变时,加入乳化剂的量越大所制得微球的球径越小,但是这个变化不明显。这样的变化规律可能是因为体系中乳化剂的量影响W/O型乳液的稳定性,进而对微球球径产生很大影响。当系统中乳化含量较低时,体系在动力学上属于不稳定系统,小液滴容易碰撞形成大液滴,从而使制备的微球球径较大。相反,当系统中乳化含量较高时,乳液稳定性较好,容易形成较小的液滴,从而制得球径较小的微球。
2.1.3搅拌速度对微球形貌及粒径的影响
搅拌速度是影响成球特性的重要因素之一,实验以搅拌速度为变量(分别为500 r/min、250 r/min),在油相与水相体积比为1∶1,温度为40 ℃,海藻酸钠溶液质量分数为3%,乳化和交联固化时间均为30 min,分别加入乳化剂司盘-80和吐温-80的量为3滴和1滴的情况下,制备海藻酸钠微球,所得产物的倒置荧光显微镜照片和扫描电镜照片分别如图6、图7所示。可知,以500 r/min的搅拌速度所得微球球形较好,均呈圆球形状,且球形完整,分散性较好,仅有极少量粘连;而250 r/min搅拌速度下制得的微球球形大多呈椭圆形,球形完整性差,且粘连现象严重。表明搅拌速度对微球的分散性有一定影响,在一定范围内搅拌速度越大,微球形态越圆整,分散越均匀。可能是因为当水相粘度较大时,过低的搅拌速度无法使水相均匀分散在油相中,使得所得微球粘连情况严重。

图6不同搅拌速度下制得海藻酸钠微球的光镜图

图7不同搅拌速度下制得海藻酸钠微球的扫描电镜图
如图8所示,当搅拌速度为500 r/min时,微球的中位粒径D50为22.38 μm,平均粒径为23.54 μm,大部分分布在14.47~33.71 μm(D10~D90)范围内;当搅拌速度为250 r/min时,D50为24.34 μm,平均粒径为26.84 μm,大部分分布在15.36~40.87 μm(D10~D90)范围内。表明转速对微球粒径大小有一定影响,但是影响不明显。转速越大制得的微球球径越小;相反,转速越小制得的微球球径越大。这是因为转速越大,剪切力增加,将水相加入到油相之后将水相打得越散,使水相形成的液滴体积越小,从而使交联固化之后形成的微球球径亦越小。

图8不同搅拌速度下制得海藻酸钠微球的粒径分布图
2.1.4海藻酸钠溶液质量分数对微球形貌及粒径的影响
海藻酸钠溶液质量分数是另一个影响成球特性的重要因素,以海藻酸钠溶液质量分数为变量(分别为2%、3%的海藻酸钠溶液),在油相与水相体积比为1∶1,温度为40 ℃,搅拌速度保持在500 r/min,乳化时间和交联固化时间均为30 min,分别加入乳化剂司盘-80和吐温-80的量为3滴和1滴的情况下,制备海藻酸钠微球,所得合成物的光学显微镜照片和扫描电镜照片如图9、图10所示。可知,用2%海藻酸钠溶液制得的微球大多为圆球形,且均很完整,分散性良好;用3%海藻酸钠溶液制得的产物部分呈椭圆形或胶囊状,且粘连现象相对较为严重。
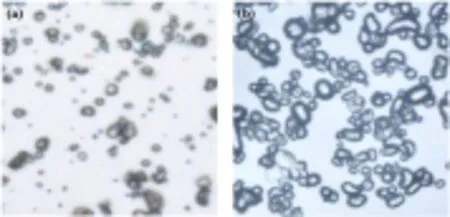
图9不同质量分数海藻酸钠溶液制得海藻酸钠微球的光镜图

图10不同质量分数海藻酸钠溶液制得海藻酸钠微球的扫描电镜图
实验结果表明,海藻酸钠溶液质量分数增大,成球情况反而不太理想,分散性亦较差。可能是因为海藻酸钠溶液质量分数增大,水相黏度也随之升高,故乳化时其分散性就弱于低海藻酸钠溶液浓度的情况。
如图11所示,当海藻酸钠溶液质量分数为2%时,微球的中位粒径D50为10.13 μm,平均粒径为10.52 μm,大部分分布在7.46~13.77 μm(D10~D90)范围内;当海藻酸钠溶液质量分数为3%时,D50为20.36 μm,平均粒径为20.80 μm,大部分在14.78~27.49 μm(D10~D90)范围内。表明用3%海藻酸钠溶液制得的微球粒径明显大于2%海藻酸钠溶液制得的微球粒径。
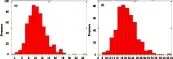
图11不同质量分数海藻酸钠溶液制得海藻酸钠微球的粒径分布图
实验结果表明,水相中海藻酸钠质量分数对所制备的微球粒径大小与分布情况影响非常显著。增大海藻酸钠溶液浓度可明显提高所得微粒粒径;相反,低海藻酸钠溶液浓度所得微球粒径则明显减小。这是因为海藻酸钠溶液质量分数越大,其粘度越大,相同搅拌速度下越不易搅散,故易形成较大液滴。但高海藻酸钠溶液浓度伴随的溶液高粘度问题,导致生成的海藻酸钠微球更倾向于椭圆形,且微球易粘连。
2.2W/O乳化-离子交联法(内部固化法)制备海藻酸钠微球
外部固化法的原理是将海藻酸钠水溶液通过喷射头、滴管或注射器等滴加到含有氯化钙的水溶液中,海藻酸钠与Ca2+接触时在海藻酸钠液滴表面发生交联,待Ca2+逐渐渗透进入液滴内部,交联固化也逐渐从外部扩散到内部,最终形成海藻酸钠微球。而内部固化法是将碳酸钙粉末分散于海藻酸钠水溶液中,然后将混合液通过喷射头、滴管或注射器等滴加到酸性水溶液中,氢离子会逐渐扩散到滴入液滴的内部。扩散进入的氢离子与碳酸钙反应得到Ca2+,Ca2+与海藻酸钠接触交联固化成球。
为考察外部固化法和内部固化法对所制备海藻酸钠微球形貌的影响,本文采用内部固化法,在油/水相体积比为1∶1,温度为40 ℃,海藻酸钠溶液质量分数为2%,乳化和交联固化时间均为30 min,搅拌速度为500 r/min,分别加入6滴司盘-80和2滴吐温-80作为乳化剂的情况下制备海藻酸钠微球,并通过倒置荧光显微镜和扫描电镜观察其大致形貌及分散性。对比分别用外部固化法和内部固化法制得海藻酸钠微球,如图12、图13所示。

图12外部固化法和内部固化法制得海藻酸钠微球的光镜图

图13外部固化法和内部固化法制得海藻酸钠微球的扫描电镜图
由图12和图13可知,两种方法所制得的海藻酸钠微球相比,外部固化法所得微球球径小,球体分布较均匀,球与球之间轮廓分明,成球状况良好。内部固化法制得的海藻酸钠微球粘连状况严重,但克服了外部固化法中氯化钙溶液加入引起的微球成簇凝聚现象,成球状况较好,球形完整,球径较大。值得一提的是,内部固化法所制得的微球固化状况不理想,容易破裂,在经过数次洗涤和干燥后,几乎所有球都破裂。出现此状况的原因一方面可能是交联固化时间不够长,使得交联固化形成的膜太薄,容易破碎;另一方面可能是加入冰乙酸后,H+先与液滴外部的CaCO3反应生成Ca2+,生成的Ca2+与海藻酸钠接触交联固化形成一层薄膜,此薄膜结构致密,限制了H+继续向内部渗入,导致液滴内部固化困难,所制备的微球不稳定,容易破碎。
3结束语
本文考察了工艺条件对W/O型离子交联法所制备海藻酸钠微球形貌及粒径的影响,并对其工艺条件和技术参数进行优化筛选,制备了具有较好球形度、粒径分布较窄、且分散性良好的海藻酸钠微球,有望为其将来用于药物缓释、重金属离子处理等多方面的研究提供基本的数据支撑。
[1] 高春凤,赵秀丽,李新刚,等.雷公藤多苷提取物壳聚糖-海藻酸钠缓释微球的制备及体外释放研究[J].中国药剂学杂志,2009(5):382-390.
[2] JAIN D,BAR-SHALOM D.Alginate drug delivery systems:application in context of pharmaceutical and biomedical research[J].Drug development and industrial pharmacy,2014,40(12):1576-1584.
[3] 贾利娜,何俊男,赵敬东,等.壳聚糖-海藻酸钠载药微球的缓释性能研究[J].广州化工,2016,44(2):65-68.
[4] 周玉洁,程龙,陶文沂,等.美丽镰刀菌与固定化东北红豆杉的共生培养[J].中国生物工程杂志,2008,28(8):84-90.
[5] LIPATOVA I M,MAKAROVA L I.Effect of hydroacoustic treatment on chitosan dissolution in aqueous acetic acid solutions[J].Russian Journal of Applied Chemistry,2008,81(12):2112-2117.
[6] VESELOVA I A,KIREIKO A V,SHEKHOVTSOVA T N.Catalytic activity and the stability of horseradish peroxidase increase as a result of its incorporation into a polyelectrolyte complex with chitosan[J].Applied biochemistry and microbiology,2009,45(2):125-129.
[7] 张莉华,李科,卜方方.海藻酸钠在药物制剂中的应用进展[J].中南药学,2016(1):52-56.
[8] 王婷婷,曹光群,董伟.海藻酸钠微球研究进展[A].第十届中国化妆品学术研讨会论文集[C].2014.
[9] 单连海,郭海霞,张志斌.海藻酸钠微球的制备及对BSA控制释放的实验[J].重庆理工大学学报:自然科学,2010(9):34-37.
[10] ZHANG F J,CHENG G X,YING X G.Emulsion and macromolecules templated alginate based polymer microspheres[J].Reactive and Functional Polymers,2006,66(7):712-719.
[11] 何帅,刘兴利,高宇航,等.双子表面活性剂杂化海藻酸钠微球的制备及其在环保领域中的应用[J].环境工程学报,2015,9(12):5874-5880.
[12] 余平,艾永林,张祥文.海藻酸钠微球支气管动脉栓塞材料治疗肺结核大咯血的有效性[J].中国组织工程研究,2015,19(47):7693-7697.
[13] 赛佳明,陈东亮,江晓路.BMP_2-海藻酸钠-壳聚糖微球对骨折愈合影响[J].青岛大学医学院学报,2016(1):68-70.
[14] 李培培,李小芳,向志芸,等.维海藻酸钠-魔芋葡甘聚糖结肠靶向凝胶微球制备及体外释药研究[J].亚太传统医药,2016,12(4):21-25.
[15] 许晓鹏,魏慧贤,麻建国,等.乳化剂的复配对w/o/w型复乳稳定性影响的研究[J].哈尔滨商业大学学报:自然科学版,2007,25(3):256-258.
Optimization of Processing Parameters to Prepare Sodium Alginate Microspheres and their Effects on the Morphology and Diameters of Microspheres
HUANGMin1a,1b,LIUXingyong2,LIYubao1a,1b,ZHANGLi1a,1b
(1a.Research Center for Nano-biomaterials; 1b.Analytical & Testing Center, Sichuan University, Chengdu 610064, China; 2.School of Chemistry and Environment, Sichuan University of Science & Engineering, Zigong 643000, China)
Sodium alginate with excellent biocompability, nontoxiciy and biodegradation was selected to prepare microspheres by means of W/O emulsifying-ionic crosslinking. The influences of processing parameters, such as outer/inner solidification, the O/W volume ratio, the content of emulsifers, stirring speed as well as the concentration of sodium alginate solution on the morphology, particle diameter and distribution of sodium alginate microspheres were investigated in order to optimize the preparation processing parameters. The results showed that, 1∶1 of O/W volume ratio, 6 drops of span-80 and 2 drops of tween-80, 500 r/min of stirring speed, 2 wt% sodium alginate solution and outer solidification were the optimum parameters for the preparation of sodium alginate microsphere, and such obtained microspheres had better sphericity, the diameter distribution was narrow and in the range of 7 μm~40 μm, and these microspheres could be well dispersed. Among the above parameters, the concentration of sodium alginate in water phase acted as the main factor to influence the microsphere diameter and distribution.
sodium alginate; microsphere; ionic crosslinking method
2017-01-17
四川省科技厅科技支撑项目(2015KJT0061-2015GZ20177)
黄 敏(1991-),女,四川眉山人,硕士生,主要从事生物医用材料方面的研究,(E-mail)hm2015229@163.com; 张 利(1976-),女,河南洛阳人,教授,博士,主要从事生物医用材料方面的研究,(E-mail)zhangli9111@126.com
1673-1549(2017)02-0001-06
10.11863/j.suse.2017.02.01
Q819
A
