多体素磁共振波谱在早产儿脑组织代谢产物分析中的应用
2017-04-27王宏秦明明汤文琳钱伟亮杨祖铭颜博秋许建铭
王宏,秦明明,汤文琳,钱伟亮,杨祖铭,颜博秋,许建铭*
我国早产儿、极低出生体重儿出生率在逐年增加,早产儿脑损伤及随后可能出现的神经发育迟滞受到普遍关注。研究发现,近年来典型的脑室周围白质软化(periventricular leukomalacia,PVL)在逐渐减少,而弥漫性脑白质信号异常及局灶性脑白质损伤(punctuate white matter lesions,PWML)却有上升趋势,也由此导致早产儿神经发育过程中,严重的运动功能损伤如脑瘫等发病率呈下降趋势,但早产儿后期神经发育过程中认知和行为异常却普遍存在[1]。早产儿脑损伤的影响因素主要分内外两大因素,内因主要是早产儿脑组织及脑血流循环系统尚未发育成熟,如果这种情况下同时伴有围产期外源性高危因素的出现,如围产期窒息、胎儿宫内窘迫、宫内感染等,有可能导致早产儿脑损伤的发生[2]。目前早产儿脑损伤的影像学检查还是以头颅磁共振为主,然而,在围产期外源性高危因素影响下,大部分早产儿行头颅常规磁共振检查未能发现异常信号的存在,但其脑内局部区域已经出现了组织代谢的紊乱。
磁共振波谱(magnetic resonance spectroscopy,MRS)是目前影像学上进行活体组织化学物质检测的唯一方法,可提供组织的代谢信息。本研究旨在通过1H-MRS了解围产期缺氧窘迫、感染以及两因素叠加作用对早产儿脑内各特定区域脑组织代谢的影响,从而进一步了解其在早产儿脑损伤早期发现及预后评估中的价值。
1 材料与方法
1.1 一般资料
本研究已通过本院伦理委员会审查,所有患儿家属均签署知情同意书,本研究共分4组,分别为围产期正常组、围产期缺氧窘迫组、围产期感染组、围产期缺氧窘迫伴感染组。围产期缺氧窘迫入组标准:临床有明显围产期窒息病史并且入院血气分析PH≤7.2或BEecf≤-8 mmol/L;围产期感染入组标准:住院期间血常规白细胞计数(white blood cell,WBC)≥25×109/L或WBC≤5×109/L,或者C-反应蛋白(C-reactive protein,CRP)>10 mg/L,同时符合上述两组入组标准的患儿纳入围产期缺氧窘迫伴感染组。本研究排除标准:⑴有先天性疾病或遗传代谢性疾病的早产儿;⑵胎龄<28 w的超未成熟儿。2016年1月至2016年12月共有60例早产儿在36 w<矫正胎龄≤37 w进行头颅磁共振检查,按上述标准,共有48例早产儿最终纳入本项研究,4组患儿性别构成、出生胎龄、出生体重比较差异均无统计学意义(P>0.05),见表1。

表1 4组早产儿一般资料比较Tab.1 Comparisons of general materials in four groups of preterm neonates
1.2 磁共振检查方法
所有患儿在磁共振检查前30 min给予10%水合氯醛灌肠(0.2~0.4 ml/kg),均行头颅常规序列检查(T1WI、T2WI、FLAIR、扩散加权成像)及1H-MRS检查,使用设备为SIEMENS MAGNETOM Skyra 3.0 T磁共振,20通道头颈部联合线圈,并在患儿头部两侧用海绵垫加以固定,本研究中1H-MRS采用化学位移成像(chemical shift imaging,CSI)技术行三维多体素采集,带宽=1200 Hz,反转角=180º,回波时间(TE)=135 ms,重复时间(TR)=1700 ms,体素=8.8 mm×8.8 mm×15.0 mm,采集时间=853 ms。
1.3 目标体素选择及图像后处理
所有1H-MRS原始数据载入西门子工作站spectroscopy后处理软件包,进行相位、基线校正、频移校准和曲线拟合等后处理获得波谱图像,目标体素选择:(1)基底节及丘脑区(basal ganglia and thalami,BGT)左右各选择2个体素;(2)两侧脑室前角、后角周围白质区分别各选择1个体素,共8个体素,然后由后处理软件识别目标体素中的以下代谢物:N-乙酰基天门冬氨酸(N-acetyl aspartate,NAA)、胆碱化合物(choline,Cho)、肌酸(creatine,Cr)、乳酸(lactate,Lac),并由软件计算出各代谢物波峰下面积,以Cr为对照得出NAA/Cr、Cho/Cr、Lac/Cr的比值,以BGT区域4个体素内各代谢物相对比值的均值作为最后统计数据,以两侧脑室前角、后角旁白质区4个体素内各代谢物相对比值的均值作为最后统计数据。
1.4 统计学方法
全部代谢物相对比值数据用均数±标准差(x±s)表示,使用SPSS 21.0统计学软件包对数据进行分析处理,围产期正常组早产儿组内数据行配对设计计量资料t检验,4组早产儿组间数据先行单因素方差分析,以α=0.05作为检验标准,当单因素方差分析P<0.05时,再行样本均数两两比较的q检验(SNK法),α=0.05作为检验标准,P<0.05为差异有统计学意义。
2 结果
2.1 围产期正常组早产儿两侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr测量及对比
围产期正常组早产儿在两侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr比值呈正态分布,对两侧脑室前角、后角周围白质区的NAA/Cr、Cho/Cr比值进行配对设计计量资料t检验,侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr比值差异有统计学意义(P<0.001),见表2。
2.2 4组早产儿BGT区域和白质区域各代谢产物的相对比值测量及对比(图1~4)
4组早产儿在BGT、白质(white matter,WM)两个区域的NAA/Cr、Cho/Cr、Lac/Cr数据均呈正态分布,方差齐性检验显示方差均齐,4组早产儿在BGT、WM两个区域的NAA/Cr、Cho/Cr、Lac/Cr数据分别先行单因素方差分析,在BGT、WM区域各组间差异均有统计学意义(P<0.01),见表3;然后进行组间各代谢产物样本均数两两对比,在BGT区域,围产期正常组分别与缺氧窘迫组、缺氧窘迫伴感染组比较,缺氧窘迫组与感染组比较,感染组与缺氧窘迫伴感染组比较,NAA/Cr、Cho/Cr、Lac/Cr的差异均有统计学意义(P<0.05);围产期正常组与感染组比较,缺氧窘迫组与缺氧窘迫伴感染组比较,NAA/Cr、Cho/Cr、Lac/Cr的差异无统计学意义(P>0.05),见表4;在WM区域,围产期正常组分别与缺氧窘迫组、缺氧窘迫伴感染组比较,感染组与缺氧窘迫伴感染组比较,NAA/Cr、Cho/Cr、Lac/Cr的差异均有统计学意义(P<0.01),围产期正常组与感染组比较,缺氧窘迫组与缺氧窘迫伴感染组比较,Cho/Cr的差异有统计学意义(P<0.05),缺氧窘迫组与感染组比较,NAA/Cr、Lac/Cr的差异有统计学意义(P<0.05),见表5。
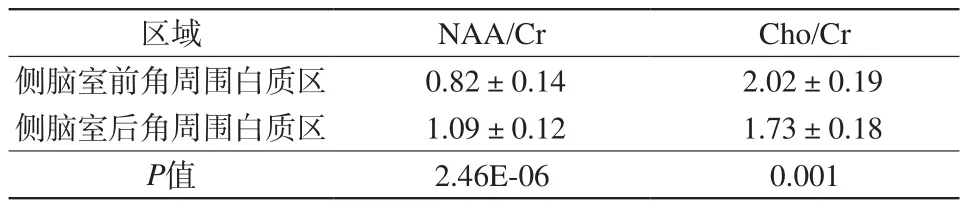
表2 围产期正常组早产儿两侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr测量及对比Tab.2 Measurements and comparisons of both NAA/Cr and Cho/Cr ratios between bilateral anterior periventricular white matter and posterior periventricular white matter in perinatal normal group

表3 4组早产儿BGT区域和WM区域各代谢产物的相对比值Tab.3 Relative ratios of metabolites in both BGT and WM region in four groups of preterm neonates

图1 围产期正常早产儿,MRS见Cho为最高峰,NAA/Cr≈1.0,BGT区域见少许乳酸峰(A:BGT区域,B:侧脑室周围白质区) 图2 围产期缺氧窘迫早产儿,BGT和WM区域MRS均见Cho波峰增高,NAA波峰减低,且均有明显增高的乳酸峰(A:BGT区域,B:侧脑室周围白质区) 图3围产期感染早产儿,WM区域Cho波峰增高,同时出现少许乳酸峰,BGT区域未见明显异常改变(A:BGT区域,B:侧脑室周围白质区) 图4围产期缺氧窘迫伴感染早产儿,BGT和WM区域MRS均见Cho波峰明显增高,NAA波峰明显减低,且均有明显增高的乳酸峰(A:BGT区域,B:侧脑室周围白质区)Fig.1 Preterm neonate with perinatal normal, Cho peak was the highest in MRS, NAA/Cr≈1.0, and a small Lac peak was showed in BGT region (A:BGT region, B: periventricular white matter region). Fig.2 Preterm neonate with perinatal asphyxia, MRS showed that Cho peak increased and NAA peak decreased in both BGT and WM region, and Lac peak increased signi fi cantly in both two regions (A: BGT region, B: periventricular white matter region).Fig.3 Preterm neonate with perinatal infection, MRS showed that Cho peak increased only in WM region and a small Lac peak was appeared, none abnormal change was found in BGT region (A: BGT region, B: periventricular white matter region). Fig.4 Preterm neonate with perinatal asphyxia and infection, MRS showed that Cho peak increased and NAA peak decreased signi fi cantly in both BGT and WM region, and Lac peak increased signi fi cantly in both two regions (A: BGT region, B: periventricular white matter region).

表4 BGT区域4组间各代谢产物样本均数两两对比Tab.4 Multiple comparisons for metabolic ratios between four groups in BGT region

表5 WM区域4组间代谢产物样本均数两两对比Tab.5 Multiple comparisons for metabolic ratios between four groups in WM region
3 讨论
3.1 早产儿脑发育过程中脑组织代谢特点
围产期各种影响因素导致的早产儿脑损伤以及这种损伤对早产儿后期神经发育的阻碍作用越来越受到大家的重视,随着磁共振功能成像技术的不断发展,可以从组织形态、细胞代谢、血液动力学多角度研究早产儿脑损伤。早产儿出生时所处的时期正是脑内神经纤维快速髓鞘化的时期,反映在脑组织代谢方面表现为,NAA在胎龄16 w左右就已经可以在白质和灰质中测到,出生后呈逐渐上升趋势,6个月左右在MRS中达到最高峰,而Cho含量在出生后1年时间内随着神经纤维髓鞘化的完善而不断降低[1],因而一般认为,NAA是神经元和轴突完整性的表现,而Cho是神经纤维髓鞘化进程的生物学标志[3]。在本研究中,笔者首先单独对围产期正常组早产儿两侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr进行了测量及对比,侧脑室前角、后角周围白质区NAA/Cr、Cho/Cr的比值差异有统计学意义,后角周围白质区NAA/Cr较前角周围白质区明显增高,而Cho/Cr明显降低,提示早产儿侧脑室后角周围白质区髓鞘化出现较前角周围白质区更早且发展更为完善。研究也发现,侧脑室后角周围白质区少突胶质细胞含量较前角周围白质区更高,也正是因为易受损的少突胶质细胞含量更高,在早产儿脑发育过程中该区域更容易出现脑白质损伤[1]。
围产期外源性高危因素主要以围产期缺氧窘迫及感染为主,早产儿如处在这些高危因素下,最终会在脑内引发一系列复杂的级联生化反应,从而使少突胶质细胞前体(premyelinating oligodendrocytes,pre-OLs)细胞应答受到干扰而无法分化,最终导致神经纤维髓鞘化受阻,而且很多时候这两种因素是综合作用叠加影响新生儿的,前期较多研究主要是测定基底节和丘脑区域的Lac/NAA比值以了解其对早产儿神经发育的预测价值,同时也是因为该区域在磁共振上多出现异常信号[4-6],而这些外源性高危因素单独或叠加作用后,早产儿脑深部灰质核团以及脑白质分别发生了哪些代谢改变报道较少,基于这些考虑,笔者设计了该研究。
3.2 围产期外源性因素对脑组织代谢的影响
3.2.1 缺氧对早产儿脑代谢的影响
前期研究认为,围产期窒息对白质及灰质中的NAA、Cho、Lac都产生影响,但深部灰质核团中的Cho及Lac最具有预测价值[4]。本研究中,围产期正常组和缺氧窘迫组比较,感染组和缺氧窘迫伴感染组比较无论是在BGT区域还是WM区域,NAA/Cr、Cho/Cr、Lac/Cr比值的差异都有统计学意义,缺氧这一因素无论单独作用还是叠加了感染因素,均导致NAA/Cr明显降低,Cho/Cr、Lac/Cr明显升高,这也提示不管是深部灰质核团还是脑白质区,缺氧都直接影响了髓鞘化的进程和轴突、神经纤维的完整性;Lac是在发生缺血缺氧损伤时,无氧糖酵解的标记物,但在围产期正常组中,无论BGT区域还是WM区域都发现了少量Lac的存在,这说明在早产儿颅内Lac的出现并不一定代表着脑损伤,早产儿脑组织中Lac的含量较之是否出现意义更大。
3.2.2 感染对早产儿脑代谢的影响
在成人中,Cho/Cr的升高一般见于髓鞘形成障碍或炎症,也见于星形胶质细胞增生[1,7-8],而在大量早产儿脑白质损伤的病理研究中,都发现过度的星形胶质细胞增生以及在病灶内及周围广泛的星形胶质细胞反应[1,9],因而研究认为Cho/Cr的升高不仅代表髓鞘化的进程受阻,同时也反映了星形胶质细胞增生的程度及范围[1]。本研究中,在BGT区域,围产期正常组和围产期感染组比较各代谢产物比值差异无统计学意义,而在WM区域,Cho/Cr的差异却有统计学意义,围产期感染组Cho/Cr的比值明显增高,这可能反映了感染这一单一因素对于深部灰质核团的代谢没有明显影响,而却影响了脑白质区域神经纤维的髓鞘化进程。在BGT区域,围产期缺氧窘迫组与缺氧窘迫伴感染组各代谢物差异无统计学意义,也间接证明了叠加感染因素并没有对深部灰质核团的代谢产生明显影响;而在WM区域,围产期缺氧窘迫组与缺氧窘迫伴感染组Cho/Cr的差异有统计学意义,这也间接证明了叠加感染因素后,脑白质区域Cho/Cr的比值明显上升。
3.3 本研究的不足之处
本研究在时间轴上缺乏一个持续的动态观察,笔者只是在早产儿36 w<矫正胎龄≤37 w进行头颅磁共振检查,了解缺氧、感染以及两因素叠加在该时间段对早产儿脑组织代谢的影响,而这些围产期高危因素是否会对早产儿脑代谢产生持续作用及与预后的相关性还有待进一步研究。有文献报道,婴儿期大脑中肌酸的含量是在逐渐升高的,随后才会出现一个相对稳定水平[10]。同时也有研究显示,围产期窒息可以导致肌酸减少[11],虽然本研究中各组早产儿磁共振检查时间均在矫正胎龄36~37 w,且1 w的时间段内各组早产儿脑内肌酸水平基本维持一个相同水平,但围产期早产儿脑组织内肌酸的相对不稳定是否会对比值产生影响值得进一步研究证实。
总之,通过MRS在临床工作中的不断应用和分析研究,有助于对围产期外源性高危因素对早产儿脑内代谢结果影响的了解,提示可能出现早产儿脑损伤的风险同时辅助临床进行早期的干预和治疗,并为以后的神经发育预后提供生物学标记物。
参考文献 [References]
[1] Kendall GS, Melbourne A, Johnson S, et al. White matter NAA/Cho and Cho/Cr ratios at MR spectroscopy are predictive of motor outcome in preterm infants. Radiology, 2014, 271(1): 230-238.
[2] Duerden EG, Taylor MJ, Miller SP. Brain development in infants born preterm: looking beyond injury. Semin Pediatr Neurol, 2013,20(2): 65-74.
[3] Tocchio S, Kline-Fath B, Kanal E, et al. MRI evaluation and safety in the developing brain. Semin Perinatol, 2015, 39(2): 73-104.
[4] Van Doormaal PJ, Meiners LC, ter Horst HJ, et al. The prognostic value of multivoxel magnetic resonance spectroscopy determined metabolite levels in white and grey matter brain tissue for adverse outcome in term newborns following perinatal asphyxia. Eur Radiol,2012, 22(4): 772-778.
[5] Alderliesten T, De Vries LS, Benders MJ, et al. MR imaging and outcome of term neonates with perinatal asphyxia: value of diffusionweighted MR imaging and1H MR spectroscopy. Radiology, 2011,261(1): 235-242.
[6] Guo L, Wang D, Bo G, et al. Early identi fi cation of hypoxic-ischemic encephalopathy by combination of magnetic resonance (MR)imaging and proton MR spectroscopy. Exp Ther Med, 2016, 12(5):2835-2842.
[7] Narayana PA. Magnetic resonance spectroscopy in the monitoring of multiple sclerosis. J Neuroimaging, 2005, 15(4 Suppl): 46-57.
[8] Kim JP, Lentz MR, Westmoreland SV, et al. Relationships between astrogliosis and 1H MR spectroscopic measures of brain choline/creatine and myo-inositol/creatine in a primate model. AJNR Am J Neuroradiol, 2005, 26(4): 752-759.
[9] Buser JR Jr, Maire J, Riddle A, et al. Arrested preoligodendrocyte maturation contributes to myelination failure in premature infants.Ann Neurol, 2012, 71(1): 93-109.
[10] Akasaka M, Kamei A, Araya N, et al. Assessing temporal brain metabolite changes in preterm infants using multivoxel magnetic resonance spectroscopy. Magn Reson Med Sci, 2016, 15(2): 187-192.
[11] Boichot C, Walker PM, Durand C, et al. Term neonate prognosis afte
r perinatal asphyxia: contributions of MR imaging, MR spectroscopy,relaxation times, and apparent diffusion coefficients. Radiology,2006, 239(3): 839-848.
