SWI与DKI对帕金森病患者脑灰质核团铁沉积及微观结构变化的联合研究
2017-04-27高冰冰苗延巍田诗云尚劲刘杨颖秋韩亮
高冰冰,苗延巍,田诗云,尚劲,刘杨颖秋,韩亮
特发性帕金森病(Parkinson's disease,PD)患者的主要病理表现是中脑的黑质致密部多巴胺能神经元变性、凋亡,部分残存神经元胞体内可见路易斯小体形成。病理研究证实,帕金森病患者脑内一些结构中存在铁代谢的异常,即存在铁的过度沉积,其中以黑质最为明显[1-2]。在病理生理水平上,铁在脑内有一定的生理性分布,当脑组织内出现过量的铁沉积时,可以激发、促进自由基的产生,从而导致脂质过氧化,进一步导致神经细胞的损伤、死亡。同时,铁的过量沉积,还可以改变细胞周围的微环境,使其对毒素或致病因子更加敏感[1]。因此,黑质的铁沉积是导致多巴胺能神经元凋亡的主要原因,同时影响了多巴胺向纹状体、尾状核头的释放,而纹状体、尾状核头位于基底节区。磁敏感加权成像(susceptibility weighted imaging,SWI)的Phase图像能够敏感而准确地检测脑组织内微量铁的存在[3-5]。
另一方面,Peran等[6]、Geng等[7]研究发现,PD患者在皮层、基底节区(壳核、苍白球)和中脑(黑质、红核)3个水平上存在不同程度的萎缩。传统的磁共振成像(magnetic resonance imaging,MRI)方法检测出的PD患者多属于病程较长的晚期患者,其相应的脑结构变化较宏观、明显。因此,随着MR技术的不断革新,研究者致力于发现PD早期患者脑内微结构的改变,目前,国内外已有学者致力于利用扩散张量成像(diffusion tensor image,DTI)、磁共振波谱(magnetic resonance spectroscopy,MRS)等MRI序列来分析脑微结构的早期变化[8-10]。但DTI技术在灰质结构的应用上存在一定不足[8],随着扩散峰度成像(diffusion kurtosis image,DKI)的研发与应用,有学者从微结构变化、铁沉积等不同角度分别采用DKI、SWI进行了前期研究[11-12]。但目前为止,尚不清楚帕金森病患者脑灰质核团内铁的过度沉积是否与其相应微结构的变化存在关联性。本研究拟应用SWI及DKI对PD患者及健康对照组的锥体外系部分脑灰质核团进行对比及相关分析,探讨PD患者基底节与中脑水平上组织内铁沉积与微结构变化的关系。
1 材料与方法
1.1 研究对象
本研究为前瞻性研究,所有受试者均对本研究知情同意,并自愿签署知情同意书。(1)帕金森病组(PD组)。选取1年内在我院神经内科住院治疗且经临床确诊为PD的患者共35例(女:17例,男:18例),年龄51~82岁,平均年龄(67.00±8.76)岁,病程3~10年。所有患者均为右利手。本研究中PD患者的入组标准采用的是中华医学会神经病学分会运动障碍及帕金森病学组的PD诊断标准。同时,排除继发性帕金森综合征;排除颅脑炎症、肿瘤、外伤史、手术史者等;排除接受过外科治疗的原发性PD患者。所有受试者均行脑部CT检查,排除双侧苍白球有生理性和(或)病理性钙化者。(2)健康对照组(HC组)。对照组为23名健康志愿者(女:11例,男:12例),年龄54~72岁,平均年龄(66.48±5.20)岁,均为右利手。确定为健康志愿者的标准包括:①既往体健者,一般检查及神经功能检查无异常;②临床简易精神状态评价量表(mini-mental state examination,MMSE)评分≥27分;③T2WI及T2 FLAIR信号正常,或者轻度异常者(T2 FLAIR有轻度白质疏松改变,Fazekas量表1级);④没有遗传病史,没有脑部炎症、肿瘤、外伤史、手术史。
1.2 影像检查方案及参数
1.2.1 CT平扫
所有受试者在16排Philips CT机上进行扫描,检测脑实质内有无生理或病理性钙化。
1.2.2 MRI扫描
所有受试者在GE Signa HDXT 3.0 T MRI机上进行扫描,采用8通道头线圈,扫描序列见表1。扫描基线选择前-后联合水平线,扫描范围从枕骨大孔至颅顶。其中DKI序列采用双自旋平面回波(spin echo-echo planar imaging,SE-EPI),b值包含0、1000、2000 s/mm2等,共15个方向。
1.2.3 MRI数据处理及测量
(1) DKI图像处理:将获得的DKI原始图像在ADW 4.4后处理工作站上应用Functool 2软件进行重建后,获得平均弥散率(mean diffusivity,MD)图、横向弥散率(axial diffusivity,Da)图、径向弥散率(radial diffusivity,Dr)图、平均弥散峰度(mean kurtosis,MK)图、横向峰度(axial kurtosis,Ka)图、径向峰度(radial kurtosis,Kr)图及各向异性分数(fractional anisotropy,FA)图。结合T2WI图像,选定感兴趣区(region of interest,ROI)范围,在尾状核头、苍白球、壳核、丘脑、黑质、红核显示最大最清晰的层面,双侧对称测量各核团,在核团上放置大小约10~15个像素的类圆形ROI,ROI要小于核团,并且避开脑脊液、血管等伪影。记录每个ROI的各DKI参数值(MK值、Ka值、Kr值、MD值、Da值、Dr值及FA值),同一核团在相同层面测量3次,取其均值为最终参数值(部分核团测量图见图1)。(2) SWI图像处理:将获得的SWI原始图像在神经影像信号处理软件(Signal Process in Neuroimaging,SPIN)上进行重建,结合最小密度重建图,在滤过后的相位图( fi ltered phase image,FPI)上于双侧尾状核头、苍白球、壳核、丘脑、黑质、红核显示最大最清晰且与DKI测量层面最接近的层面上手动勾画核团的完整轮廓来获得核团的Phase值,测量连续的3个层面,取其均值作为最终统计值。测量时要避开气颅接触面、血管等伪影。所有测量工作由一个人独立完成,测量方法如图2、3。

表1 MRI扫描参数Tab.1 MRI protocols
1.3 统计学方法
对获得的所有数据用社会科学统计软件包SPSS 17.0进行分析。首先对PD组、HC组的年龄(t检验)、性别(检验)的差异性进行分析。应用配对t检验法检验PD组、HC组组内各核团Phase值的侧别差异;应用两独立样本t检验法检验PD组、HC组组间的各核团Phase值的差异性;采用Spearman相关分析分析PD组各部位DKI参数值与SWI参数值之间的关联性。
2 结果
2.1 PD组、HC组的临床资料比较
PD组与HC组的年龄比较,差异无统计学意义(t=0.284,P=0.777);PD组与HC组的性别比较,差异亦无统计学意义(χ2=0.069,P=0.793)。
2.2 PD组、HC组各核团Phase值的侧别差异
仅PD组的双侧壳核的Phase值存在侧别差异(t=2.696,P=0.010),左侧壳核较右侧略高,两侧差值的平均值为0.010;余PD组、HC组各部位的Phase值均无侧别差异。
2.3 PD组各核团Phase值的变化
与HC组相比,苍白球、黑质、红核、尾状核头的Phase值下降,PD组右侧壳核Phase值升高,且差异均具有统计学意义(P<0.05);左侧壳核的Phase值虽然有升高,但这种改变差异没有统计学意义(P>0.05),见表2。
2.4 PD组各核团Phase值与DKI参数的相关性分析
将PD组各灰质核团Phase值与其相应的DKI参数进行相关分析,发现左壳核的Phase值与FA值之间存在负相关性(r=-0.437,P=0.009);红核的Phase值与Da值、黑质的Phase值与Kr值之间存在正相关性(r=0.349,P=0.030;r=0.414,P=0.009);其他核团的Phase值与相应DKI参数值未见明显相关性,具体结果见表3。左壳核、黑质的Phase值与其相关DKI参数值的散点图见图4、5。
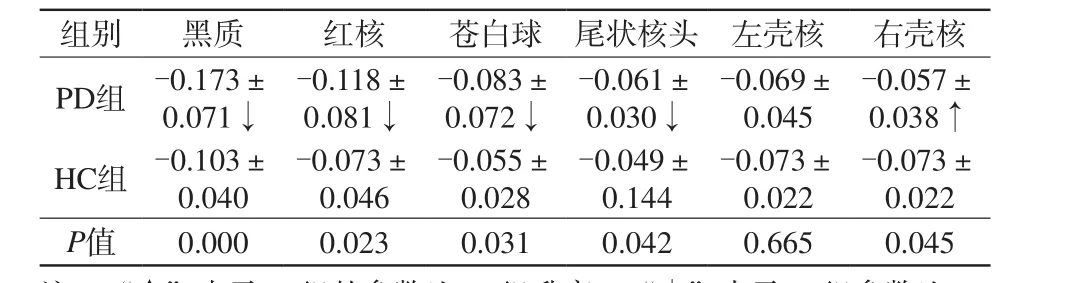
表2 PD组与HC组的Phase值对比Tab.2 Comparison of phase value between PD and HC groups

图1 PD患者,男,56岁,病程7年。A、B:双侧尾状核头、壳核、苍白球及红核、黑质测量层面的T2 FLAIR图;双侧尾状核头(弯箭)、双侧苍白球(直箭)的MK测量图(C)、MD测量图(D)、FA测量图(E) 图2 双侧苍白球、壳核、尾状核头测量层面的FPI图 图3 双侧黑质、红核测量层面的FPI图Fig.1 A typical PD patient, male, 56 years old, has been diagnosed Parkinson's disease for 7 years. A, B: T2 FLAIR image; MK maps (C), MD maps (D) and FA maps (E) of bilateral globus pallidus (straight arrow) and head of caudate nucleus (curved arrow). Fig.2 Filtered phase image of globus pallidus, putamen and head of caudate nucleus. Fig.3 Filtered phase image of red nucleus and substantia nigra.

表3 各部位Phase值与相应各DKI参数的相关性分析Tab.3 The correlation between phase value and DKI parameters of each nucleus in PD group
3 讨论
本研究发现,PD组多个核团的Phase值与扩散参数较HC组均有明显差异;同时,部分核团的Phase值与DKI参数间具有一定的相关性。也就是说,帕金森病患者脑灰质核团内有微结构的变化以及铁的过量沉积,且二者之间具有一定的相关性。
PD患者的病理过程改变包括黑质多巴胺能神经元的变性、缺失,残存神经元内嗜酸性包涵体形成,变性神经元周围小胶质细胞激活、聚集及损伤神经元的修复等[2,13-15]。病理研究已证实PD患者存在灰质核团(黑质、红核)内铁的过度沉积,另有研究发现PD患者存在皮层、基底节和中脑3个水平上的脑萎缩;病理改变的发生最先出现在脑干,经过边缘系统,最终出现在大脑皮层。
本研究所有受试者中,PD组中壳核Phase值存在侧别差异,表现为左侧壳核较右侧略高,两组其余各个核团的Phase值均没有侧别差异。苗延巍等[16]对正常人脑的SWI研究中发现,壳核右侧铁沉积量略高于左侧,左侧尾状核头的铁沉积量明显高于右侧;左侧苍白球、丘脑和黑质的铁沉积量略高于右侧,但这些改变差异均无统计学意义;双侧额、顶、枕叶白质内的铁分布无差异。本组研究中,在HC组中未发现此差异,而PD组中双侧壳核Phase值的差异却存在统计学意义,这一差异与病例数较少有一定的关系,不能由此推测帕金森病患者的双侧壳核存在铁沉积的差异。
本研究发现,PD患者尾状核头、苍白球、红核及黑质的Phase值均较HC组低,即PD患者多个灰质核团内出现铁的过量沉积。利用SWI测量脑组织结构的Phase值来推算脑铁含量已经被众多研究者所认可。近期,有学者采用7.0 T磁共振应用3D-SWI成像技术对黑质亚结构的铁沉积研究显示,黑质的铁沉积能够准确鉴别帕金森病患者与健康人[17]。然而,近年来有研究发现SWI在定量测量方面存在不足,由于有“双极性磁场”的作用,Phase值的测量准确性和可重复性都不够理想。为了改善SWI定量测量的不足,国外学者设计并改进了新的序列:定量磁敏感成像(quantitative susceptibility mapping,QSM)。Liu等[18]采用QSM技术对正常人脑深部灰质核团的铁沉积随年龄的变化进行定量研究,得到了磁化率与铁浓度之间的定比关系,认为应用QSM能更好地对脑铁进行定量分析。
DKI是DTI的扩展技术,基于水分子运动的非高斯分布(非高斯扩散)的前提,可以量化真实水分子扩散与理想的高斯分布扩散的位移偏离大小,更利于显示神经细胞数量、组织结构分布的显微改变,对灰质结构的细微改变也更加敏感。Wang等[19]应用DKI测量帕金森病患者的黑质、壳核、苍白球、尾状核,发现PD患者壳核的MK值高于对照组,同侧黑质的MK值最具诊断价值(平均界值为1.10,敏感度为0.92,特异度为0.87);而FA值在黑质有改变,但其他核团则无改变,说明DKI对灰质核团复杂性的检测明显优于DTI。本研究利用DKI定量分析阿尔茨海默病脑灰质核团,认为DKI可以定量评估灰质核团微结构状况,苍白球的Dr值是鉴别AD与健康者的最佳指标[20]。
本研究中红核的Phase值与Da值、黑质的Phase值与Kr值之间存在不同程度的正相关性,其中黑质的Phase值与Kr值相关性最大。推测其原因可能是由于黑质内铁过量沉积引起多巴胺能神经元变性、丢失,造成组织结构相对松散;同时,小胶质细胞聚集、增生,损伤神经元的修复,又使局部组织结构相对复杂化。左壳核的Phase值与FA值之间存在负相关性,壳核的损伤有铁沉积增加的直接原因,也有黑质损伤后经神经传导通路所致的间接损伤所致,由于铁沉积对脑的易损区主要在黑质,壳核的损伤则是以间接损伤为主。
本研究中病例数相对较少,以后需进一步增加样本量进行研究分析;本研究中未考虑药物治疗对脑微结构的影响,对测试结果有造成一定程度的干扰的可能性。
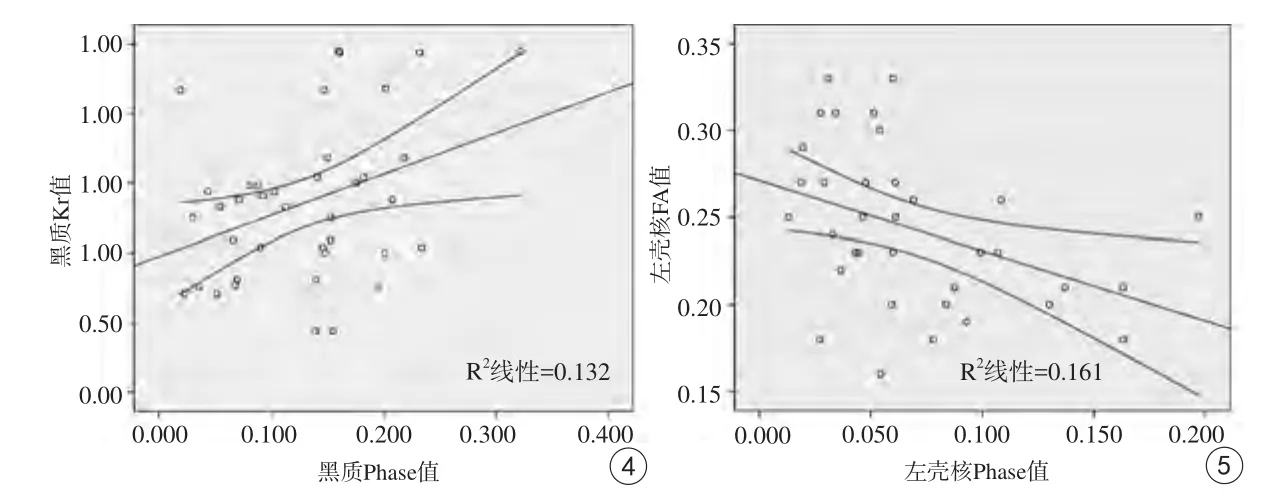
图4 黑质Phase值与Kr值的散点图 图5 左壳核Phase值与FA值的散点图Fig.4 The correlation between phase and Kr value of substantia nigra. Fig.5 The correlation between phase and FA value of left putamen
参考文献 [References]
[1] Hughes AJ, Ben-Shlomo Y, Daniel SE, et al. What features improve the accuracy of clinical diagnosis in Parkinson's disease: a clinicopathological study. Neurology, 1992, 42(6): 1142-1146.
[2] Michel G, Maria GS, Kelly DT, et al. 100 years of Lewy pathology.Nat Rev Neurol, 2013, 9(1): 13-24.
[3] Wallis LI, Paley MN, Graham JM, et al. MRI assessment of basal ganglia iron deposition in Parkinson's disease. Magn Reson Imaging,2008, 28(5): 1061-1067.
[4] Stankiewicz J, Panter SS, Neema M, et al. Iron in chronic brain disorders: imaging and neurotherapeutic implications.Neurotherapeutics, 2007, 4(3): 371-386.
[5] Haddar D, Haacke E, Sehqal V, et al. Susceptibility weighted imaging, Theory and applications. J Radiol, 2004, 85(11): 1901-1908.
[6] Peran P, Luccichenti G, Cherubini A, et al. High- fi eld neuroimaging in Parkinson's disease. High Field Brain MRI, 2006, 4(3): 194-200.
[7] Geng DY, Li YX, Zee CS. Magnetic resonance imaging-based volumetric analysis of basal ganglia nuclei and substantia nigra in patients with Parkinson's disease. Neurosurgery, 2006, 58(2): 256-262.
[8] Kamagata K, Tomiyama H, Hatano T, et al. A preliminary diffusional kurtosis imaging study of Parkinson's disease: comparison with conventional diffusion tensor imaging. Neuroradiology, 2014, 56(3):251-258.
[9] Abosch A, Yacoub E, Ugurbil K, et al. An assessment of current brain targets for deep brain stimulation surgery with susceptibilityweighted imaging at 7 tesla. Neurosurgery, 2010, 67(4): 1745-1756.
[10] Gloria C, Nie SD. Diffusion kurtosis imaging for diagnosis of Parkinson's disease: A novel software tool proposal. J X-ray Sci and Technol, 2017, 25(4): 561-571.
[11] Coutu JP, Chen JJ, Rosas HD, et al. Non-gaussian water diffusion in aging white matter. Neurobiol Aging, 2014, 35(6): 1412-1421.
[12] Billiet T, Vandenbulcke M, Mädler B, et al. Age-related microstructural differences quantified using myelin water imaging and advanced diffusion MRI. Neurobiol Aging, 2015, 36(6): 2107-2121.
[13] Guo H, Song JP. Latest research progress at home and abroad of pathogenesis of Parkinson's disease. Occupation and Health, 2012,28(4): 112-114.国华, 宋军平. 帕金森病发病机制最新国内外研究进展. 职业与健康, 2012, 28(4): 112-114.
[14] Fan Z, Aman Y, Ahmed I, et al. In fl uence of microglial activation on neuronal function in Alzheimer's and Parkinson's disease dementia.Alzheimers Dement, 2015, 11(6): 608-629.
[15] Koshimori Y, Ko JH, Mizrahi R, et al. Imaging striatal microglial activation in patients with Parkinson's disease. PLoS One, 2015,10(9): e0138721.
[16] Miao YW, Liu T, Wu JL, et al. Susceptibility weighted imaging evaluation of brain iron content of gray nucleus in healthy people.Chin J Med Imaging Technol, 2009, 25(3): 93-95.苗延巍, 刘婷, 伍建林, 等. 磁敏感加权成像评价正常人大脑灰质核团铁代谢. 中国医学影像技术, 2009, 25(3): 93-95.
[17] Cosottini M, Frosini D, Pesaresi I, et al. MR imaging of the substantia nigra at 7.0 T enables diagnosis of Parkinson's disease.Radiology, 2014, 271(3): 831-838.
[18] Liu M, Liu S, Ghassaban K, et al. Assessing global and regional iron content in deep gray matter as a function of age using susceptibility mapping. J Magn Reson Imaging, 2016, 44(1): 59-71.
[19] Wang JJ, Lin WY, Lu CS, et al. Parkinson disease: diagnostic utility of diffusion kurtosis imaging. Radiology, 2011, 261(1): 210-207.
[20] Hu R, Xu L, Gao BB, et al. Diffusion kurtosis imaging study of gray nucleus microstructure in Alzheimer's disease. J Clin Radiol, 2017,36(7): 938-942.胡瑞, 徐霖, 高冰冰, 等. 阿尔茨海默病脑灰质核团微观结构的弥散峰度成像研究. 临床放射学杂志, 2017, 36(7): 938-942.
