冰糖橙叶肉和愈伤组织原生质体分离期间氧化胁迫的比较分析
2017-04-27蔡小东曹文娟
蔡小东,曹文娟
(长江大学园艺园林学院,湖北 荆州 434025)
冰糖橙叶肉和愈伤组织原生质体分离期间氧化胁迫的比较分析
蔡小东,曹文娟
(长江大学园艺园林学院,湖北 荆州 434025)
通过测定原生质体分离过程中超氧阴离子自由基()产生速率、丙二醛含量、超氧物歧化酶活性、过氧化氢酶活性、过氧化物酶活性、还原型谷胱甘肽含量以及抗坏血酸含量的变化,以探讨柑橘不同来源原生质体再生能力差异的机制。结果表明,在原生质体分离过程中,不能再生的冰糖橙叶片原生质体产生速率和MDA积累量在同一酶解时间均较愈伤组织高;愈伤组织原生质体酶解过程中SOD活性的变化趋势与产生速率趋势基本一致,即逐渐增加,而叶片原生质体在酶解12 h后SOD活性显著下降;在酶解后的同一时间点,愈伤组织原生质体CAT活性总是显著高于叶片原生质体,愈伤组织原生质体GSH 和AsA含量也总是高于叶片。柑橘不同来源原生质体再生能力存在差异,其原因可能与原生质体分离过程中活性氧(AOS)、保护酶和抗氧化物质的代谢平衡有关,即与AOS产生与清除之间的平衡有关。
柑橘;原生质体;氧化胁迫;保护酶;抗氧化物质
植物原生质体是指去除细胞壁后由质膜所包围的裸露细胞,在适宜培养体系下具有再生完整植株的潜能。目前,随着原生质体培养体系的不断完善和改进,原生质体再生成株的植物种类越来越多[1-2]。然而,某些植物种类原生质体再生困难,即使同一基因型植物的细胞、组织或器官分离的原生质体再生能力也存在差异[3]。在柑橘中,多年来原生质体融合和培养研究中普遍存在这种现象,即胚性愈伤组织和叶肉来源原生质体具有不同的再生能力。柑橘胚性愈伤组织原生质体培养已在多个种、属上获得成功,然而叶肉原生质体无论单独培养还是共培养均没有持续分裂能力[4-6]。因此柑橘不同来源原生质体再生能力差异的机制有待深入研究。
细胞壁降解酶是一种逆境诱导剂。研究表明,植物原生质体在分离或培养过程中会遭遇复杂的代谢变化,产生较高水平的活性氧(Active oxygen species,AOS),从而引起氧化胁迫[7-12]。高水平的AOS能直接或间接启动膜脂的过氧化作用,从而导致细胞膜的损伤和破坏。细胞膜是细胞与环境进行物质交换的主要场所,细胞膜的损伤和破坏会引起细胞代谢紊乱,氧化胁迫可能降低原生质体的再生能力,甚至引起原生质体顽拗现象的发生[8-9]。在原生质体分离过程中,王丽莉等[7]发现小麦叶肉原生质体膜受到的伤害对随后的培养过程产生不良影响,膜损伤的发生可能与原生质体能否进入正常分裂状态有关。同时,植物细胞本身具有防止氧化胁迫早期形成的胞内酶促防御系统(即保护酶系统)和抗氧化物质防御系统,细胞中AOS水平主要由产生和清除之间的平衡所决定。烟草原生质体培养成功率通常较甘蔗高,其原因可能是由于烟草原生质体总的清除自由基的能力比甘蔗强[12]。
研究柑橘等植物不同来源原生质体再生能力差异的机制,对利用原生质体再生体系进行种质创新和遗传改良具有重要意义。本研究以冰糖橙试管苗和愈伤组织为材料,对叶肉和愈伤组织原生质体分离期间的氧化胁迫进行分析,以期在原生质体分离阶段揭示不同来源柑橘原生质体再生能力差异的生理机制。
1 材料与方法
1.1 试验材料
冰糖橙(Citrus Sinensis L. Osbeck cv. Bingtang)胚性愈伤组织从成熟果实未发育胚珠诱导[13],现保存于长江大学园艺植物逆境生理实验室光照培养室中。胚性愈伤组织液体悬浮培养3代后用于原生质体分离。冰糖橙成熟种子先用1% NaOH浸泡5~10 min,期间用玻璃棒搅拌以除去种子表面果胶;洗净NaOH后,经0.1% HgCl表面消毒10 min,无菌水清洗5次,去种皮,接种于MT基本培养基(含30 g/L蔗糖和7.5 g琼脂,pH 5.8),接种后20~30 d左右取充分展开的叶片分离原生质体。
1.2 试验方法
1.2.1 原生质体的分离 原生质体的分离参照Grosser等[14]的方法进行,略有改进。(1)愈伤组织原生质体的分离:用吸管吸取1 g左右继代6~10 d的冰糖橙悬浮愈伤组织于高温高压灭菌的15 mm×60 mm培养皿中,吸干培养基后加入1.8 mL 0.7 EME(MT+0.7 mol/L蔗糖+1 500 mg/L ME)、1.8 mL 酶混合液(0.6%纤维素酶R-10+0.6% 离析酶R-10+12.8%甘露醇+0.011% NaH2PO4+0.12% MES+0.36% CaCl2·2H2O,调节pH为 5.8,酶液通过0.22 μm醋酸纤维微孔滤膜过滤灭菌),轻轻摇匀后用封口膜封口,在生化培养箱中25℃暗条件下静置酶解。
(2)叶肉原生质体的分离:用镊子取出冰糖橙无菌苗放置在高温高压灭菌的滤纸上,剪下叶片,将叶片切成条状,宽度为0.5~1.0 mm。再放入预先加入1.5 mL 0.6 EME(MT+0.6 mol/L蔗糖+1 500 mg/L ME)15 mm×60 mm培养皿中,之后加入1.8 mL上述酶混合液,摇匀后用封口膜封口,在生化培养箱中25℃暗条件下静置酶解。
1.2.2 酶解过程中样品制备 柑橘原生质体一般酶解时间为15~18 h。本研究中样品分别在酶解6、12、18 h取样。样品先经过孔径为45 μm不锈钢滤网过滤,以除去未酶解完全的材料及大细胞团,并用CPW13洗涤过滤,滤液在700 r/min离心10 min,使原生质体(含未去壁细胞)沉于管底。之后加入1 mL 0.1 M磷酸缓冲液磷酸缓冲液(pH7.8),在4℃、4 000 r/min条件下离心15 min,取沉淀物液氮冻存,-70℃保存备用。
1.2.4 MDA含量、保护酶活性、抗氧化物质含量的测定 MDA含量、SOD活性、CAT活性、POD活性、GSH含量以及AsA含量的测定分别参照南京建成生物工程公司提供的测试盒说明书进行。
试验数据采用SPSS13.0软件处理,LSD法作多重比较分析。
2 结果与分析
2.1 叶肉和愈伤组织原生质体分离期间产生速率的变化
从图1可以看出,冰糖橙愈伤组织和叶片在酶解过程中,随着酶解时间的延长,产生速率均呈上升趋势。其中叶片酶解过程中产生速率急剧增加,酶解18 h原生质体样品产生速率达到1.19 nmol/min·g(FW),显著高于酶解12 h和6 h的产生速率(0.72、0.63 nmol/min·g,FW)。而愈伤组织原生质体在酶解过程中产生速率也一直在增加,但酶解12 h后增加不显著。此外,在酶解后的3个时间点分别比较叶片和愈伤组织生质体产生速率,结果显示叶片原生质体产生速率均显著高于同时期愈伤组织原生质体。

图1 冰糖橙愈伤组织和叶肉原生质体分离期间产生速率的变化
2.2 叶肉和愈伤组织原生质体分离期间MDA含量的变化
冰糖橙叶片和愈伤组织酶解分离期间,作为膜脂过氧化程度的指标之一的MDA含量变化如图2所示。由图2可知,愈伤组织酶解过程中,MDA含量呈先升高后下降的趋势,其中酶解6~12 h MDA含量显著升高,酶解12~18 h MDA含量显著下降,但酶解处理18 h与6 h的样品MDA含量差异不显著;而叶片MDA含量酶解6~12 h有所下降,但下降幅度并不显著,之后MDA含量显著上升,酶解18 h达到最大值。与愈伤组织相比,叶片在酶解过程中MDA积累量更大,叶片原生质体的MDA含量酶解18 h为愈伤组织的2.13倍。这说明在原生质体分离后期,叶片原生质体膜脂过氧化程度更高。

图2 冰糖橙愈伤组织和叶肉原生质体分离期间MDA含量的变化
2.3 叶肉和愈伤组织原生质体分离期间保护酶活性的变化
从图3A可以看出,冰糖橙叶片和愈伤组织原生质体酶解初期,即酶解6~12 h,原生质体样品中SOD的活性均逐渐增强,但增加均不显著;酶解12 h后,愈伤组织原生质体样品中SOD活性显著上升,酶解18 h SOD活性达到734.28 U/g(FW)。然而,在此阶段叶片原生质体样品中SOD的活性却出现显著下降,酶解18 h,叶片原生质体样品中SOD的活性降至413.06 U/g,FW,约为同时期愈伤组织原生质体样品的56.3%。愈伤组织和叶片酶解过程中POD活性的变化趋势如图3B所示。在原生质体分离期间,冰糖橙愈伤组织和叶片原生质体样品中POD活性的变化趋势基本一致,即POD活性在酶解初期上升,而在酶解12 h后表现下降趋势;在酶解后的同一时间点,愈伤组织原生质体样品中CAT活性与叶片原生质体样品没有显著差异。由图3C可知,冰糖橙叶片和愈伤组织原生质体酶解过程中,CAT活性虽然都有一定程度的波动,但变化均不显著。但是,在酶解后的同一时间点,愈伤组织原生质体样品中CAT活性总是显著高于叶片原生质体样品。
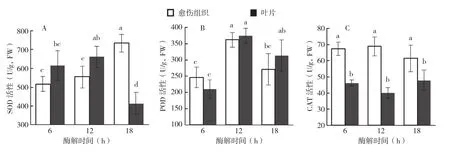
图3 冰糖橙和愈伤组织叶肉原生质体分离期SOD(A)、POD(B)、CAT(C)活性的变化
2.4 叶肉和愈伤组织原生质体分离期间抗氧化物质含量的变化
GSH含量的变化如图4A所示,2种材料中GSH含量在原生质体分离过程中变化趋势不同。其中愈伤组织原生质体样品中GSH的含量随酶解时间延长表现一直缓慢降低的趋势,而叶片原生质体样品中GSH的含量在酶解初期显著升高,之后又显著下降。尽管如此,在酶解后的同一时间点,愈伤组织原生质体样品中GSH的含量总是高于叶片,尤其是在酶解6 h和18 h,LSD分析结果表明愈伤组织原生质体样品中GSH的含量显著高于叶片。
愈伤组织和叶片酶解过程中AsA含量的变化如图4B所示,在酶解6~12 h,二者AsA含量呈现增加趋势,其中愈伤组织原生质体样品AsA含量显著上升,酶解12 h时AsA含量最高。酶解12 h后,愈伤组织原生质体样品AsA含量显著下降,而叶片原生质体样品AsA含量缓慢增加。在酶解后的同一时间点,愈伤组织原生质体样品中AsA的含量同GSH含量一样,总是高于叶片。

图4 冰糖橙愈伤组织和叶肉原生质体分离期间抗氧化物质GSH(A)、AsA(B)含量的变化
3 结论与讨论
已有研究表明,在高浓度的AOS如超氧化自由基、羟基自由基、过氧化氢会氧化损伤脂质蛋白质和核酸等生物分子,破坏细胞的新陈代谢,导致原生质体再生能力下降[8-10,12]。研究原生质体酶解过程中AOS、保护酶和抗氧化物质的动态变化,可以进一步探讨原生质体分离过程中伤害的发生原理,从而为研究原生质体再生能力差异的机制提供理论依据。
细胞中AOS水平主要由产生和清除之间的平衡所决定,SOD、POD和CAT是植物细胞内清除活性氧和维持植物体内活性氧平衡的重要抗氧化酶,并且一些抗氧化物质(如GSH、AsA等)在植物体清除活性氧中也发挥了重要作用[8,10]。SOD是生物体内清除自由基的首要抗氧化酶,对清除活性氧有重要作用。本研究结果表明,冰糖橙愈伤组织原生质体分离过程中中SOD活性的变化趋势与产生速率趋势较一致,而叶片原生质体样品中SOD的活性的变化趋势与产生速率趋势不一致。叶片酶解12 h后SOD活性持续下降清除能力减弱,这可以解释为什么叶片原生质体样品中产生速率在酶解后期急剧上升。POD和CAT可以清除H2O2,减轻细胞氧化损伤。在酶解后的同一时间点,虽然愈伤组织原生质体中POD活性与叶片原生质体没有显著差异,但前者CAT活性总是显著高于后者,并且愈伤组织原生质体样品中GSH和AsA含量总是高于叶片。这说明冰糖橙愈伤组织和叶片原生质体再生能力的差异可能与分离过程中的保护酶活性和抗氧化物质含量有关,低活性的保护酶活性可能引起了膜脂损伤,影响了原生质体的再生能力。
细胞内外AOS水平受许多内源因素和外源因素的控制。植物细胞拥有复杂的抗氧化系统,包括各种保护酶以及大量的非酶清除剂[16]。研究表明,原生质体分离过程中的氧化胁迫对随后的培养过程会产生不良影响,影响原生质体的再生能力[8-10,12]。柑橘胚性愈伤组织原生质体能够再生,而叶肉原生质体没有持续分裂能力,其原因可能与原生质体分离过程中的原生质体酶解过程中AOS含量、保护酶活性和抗氧化物质含量的动态变化有关,即与AOS产生与清除之间的平衡有关。高水平的AOS对细胞膜的损伤以及如何抑制冰糖橙叶肉原生质体分裂等问题还有待进一步研究。
[1]Eeckhaut T,Lakshmanan P S,Deryckere D,et al. Progress in plant protoplast research[J]. Planta,2013,7(2):403-410.
[2]彭邵锋,陆佳,陈永忠,等. 木本植物原生质体培养体系研究进展[J]. 中国农学通报,2013,29(1):1-6.
[3]曹文娟,蔡小东. 植物原生质体顽拗现象及其生理和遗传基础研究进展[J].湖北农业科学,2012,51 (10):1954-1955.
[4]Guo W W,Xiao S X,Deng X X. Somatic cybrid production via protoplast fusion for citrus improvement[J]. Sci Hortic,2013,163 (2):20-26.
[5]Edriss M H. Studies on leaf mesophyll protoplast of Citrus[J]. Acta Hort,1992,19:215-220.
[6]Xiao S X,Biswas M K,Li M Y,et al. Production and molecular characterization of diploid and tetraploid somatic cybrid plants between male sterile Satsuma mandarin and seedy sweet orange cultivars[J]. Plant Cell Tissue Organ Culture,2014,116:81-88.
[7]王丽莉,贾敬芬. 小麦原生质体分离过程中生理状态的变化[J]. 植物生理学报,1994,20 (4):393-398.
[8]Papadakis A K,Roubelakis-Angelakis K A. Oxidative stress could be responsible for the recalcitrance of plant protoplasts[J]. Plant Physiol Biochem,2002,40:549-559.
[9]Kapur R,Saleem M,Harvey B L,et al. Oxidative metabolism and protoplast culture[J]. In Vitro Cell Dev Biol,1993,29:200-206.
[10]Xu X Y,Xie G S,He L,et al. Differences in oxidative stress,antioxidant systems,and microscopic analysis between regenerating callus-derived protoplasts and recalcitrant leaf mesophyll-derived protoplasts of Citrus reticulata Blanco[J]. Plant Cell Tiss Org,2013,114 (2):161–169.
[11]徐小勇,许晓玲,刘玉玲,等. 蒰柑原生质体培养过程中羟自由基和总活性氧水平的分析[J].江苏农业科学,2016,45(5):196-198.
[12]何若天,覃伟,李任强. 甘蔗和烟草叶原生质体分离期间的膜损伤及有关酶活性变化[J]. 植物生理学报,1994,20(1):100-104.
[13]蔡小东,廖伟.冰糖橙胚状体、胚性愈伤组织的诱导及植株再生[J]. 长江大学学报自然科学版:农学卷,2010,7(1):56-59.
[14]Grosser J W,Gmitter F G Jr. Protoplast fusion and citrus improvements[J]. Plant Breed Rev,1990,8:339-374.
[15]王爱国,罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学报,1990(6):55-57.
[16]薛鑫,张芊,吴金霞. 植物体内活性氧的研究及其在植物抗逆方面的应用[J]. 生物技术通报,2013(10):6-11.
(责任编辑 邹移光)
Comparative analysis of oxidative stress between leaf and callus of Citrus Sinensis L.Osbeck cv. Bingtang during protoplasts isolation
CAI Xiao-dong,CAO Wen-juan
(College of Horticulture and Gardening,Yangtze University,Jingzhou 434025,China)
To identify the mechanisms that citrus protoplasts from different origins hold different regeneration capacity,production rate,content of malonaldehyde( MDA),glutathione( GSH) ,ascorbic acid( AsA),and activity of superoxide dismutase( SOD),catalase( CAT) and peroxidase( POD) were analyzed during the maceration period. Results showed that both theproduction rate and MDA content of recalcitrant leaf mesophyllderived protoplasts were higher than those of callus protoplast at the same time of protoplast isolation. The change trend of SOD activity of callus protoplasts was similar to that ofproduction rate,i.e.,an increasing trend during the maceration period. However,the SOD activity of leaf protoplasts decreased significantly after 12 h of protoplast isolation. At the same time after protoplast isolation,the CAT activity of callus protoplasts was significantly higher than that of leaf protoplasts,and the contents of GSH and AsA of callus protoplasts was also higher than those of leaf protoplasts. Therefore,citrus protoplasts derived from different tissues had different regeneration capacity,could be due to the metabolic balance of active oxygen species( AOS),protective enzyme and antioxidants,i.e.,AOS-generation and defense systems in cells.
Citrus;protoplast;oxidative stress;protective enzyme;antioxidants
S666.4
A
1004-874X(2017)02-0049-06
2016-12-11
长江大学引进人才启动项目(801190010101)
蔡小东(1978-), 男,博士,副教授,E-mail:caixiao.dong@163.com
蔡小东,曹文娟.冰糖橙叶肉和愈伤组织原生质体分离期间氧化胁迫的比较分析[J].广东农业科学,2017,44(2):49-54.
