应用CRISPR/Cas9编辑广东小耳花猪MSTN基因
2017-04-27刘小凤曾检华刘小红陈瑶生何祖勇
王 敏,黄 翔,石 翾,刘小凤,曾检华,刘小红,陈瑶生,何祖勇
(1.中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广东 广州 510006;2.广东壹号食品股份有限公司,广东 广州 510620)
应用CRISPR/Cas9编辑广东小耳花猪MSTN基因
王 敏1,黄 翔1,石 翾1,刘小凤1,曾检华2,刘小红1,陈瑶生1,何祖勇1
(1.中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广东 广州 510006;2.广东壹号食品股份有限公司,广东 广州 510620)
MSTN基因是肌肉生长抑制基因,破坏MSTN基因的表达成为提高畜禽肌肉产量的有效途径。通过应用CRISRP/Cas9编辑技术对广东小耳花猪MSTN基因的外显子区域进行编辑,破坏MSTN基因的读码框来抑制其表达,从而提高广东小耳花猪的肌肉产量。共设计了6条靶向MSTN基因3个不同外显子的gRNA,经过T7E1酶切检测和TA克隆分析,发现其中3条gRNA能够发生有效切割,其中切割效率最高的达28.3%,最低为17.0%。gRNA1-1和gRNA3-3突变的广东小耳花猪PEF细胞系,突变效率均在50%以上,其中三号外显子上突变位点的突变率达到61.5%。试验结果为后续进行体细胞核移植,生产MSTN基因编辑的广东小耳花猪奠定了基础。
MSTN;CIRSPR/Cas9;广东小耳花猪;基因编辑
MSTN (Myostatin)基因是肌肉生成抑制基因,在机体中主要发挥肌肉生长的负调节作用。因此,破坏MSTN基因的表达成为提高畜禽肌肉产量的有效途径。MSTN基因是Mcpherron在研究转化生长因子(TGF-β)时发现的,并在随后试验中指出,MSTN在脊椎动物的骨骼肌中特异表达,MSTN基因功能的缺失能够有效增加小鼠的肌肉产量,靶向破坏MSTN基因的小鼠体重是野生小鼠体重的两倍[1]。MSTN作为肌肉生长调节抑制因子,自被发现以来就受到广泛重视,研究也越发深入。Hanset等[2]发现表现双肌性状的比利时蓝牛和皮埃蒙特牛比普通牛的肌纤维数量更多,而在胎牛中的肌纤维数量是普通牛的两倍[3]。进一步研究表明,比利时蓝牛中表现双肌性状是由其MSTN基因编码区一段11 bp的碱基缺失引起的,而皮埃蒙特牛则是由相同MSTN基因区域单碱基G>A突变所致[4]。2000年,Thomas等[5]研究发现,MSTN导致P21(一种细胞周期依赖性蛋白激酶抑制因子)表达上调,使得 cdk2蛋白活性下降,导致低磷酸化Rb蛋白累积,最终成肌细胞在G1期阻滞。2001年,Taylor等[6]检测了重组MSTN在小鼠成肌细胞C2C12中的作用,结果显示重组MSTN蛋白能够抑制细胞增殖,抑制DNA和蛋白合成,推测MSTN能够通过抑制肌肉的生长和再生从而影响肌肉重量。2002年,Rios等[7]为探究MSTN在成肌分化过程中扮演的角色,用小鼠MSTN cDNA稳定转染C2C12细胞,发现MSTN cDNA的过表达会下调肌肉调控因子MyoD和myogenin mRNA的表达水平,起到可逆的抑制成肌过程的作用。2003年,Joulia等[8]同样阐明了MSTN能够抑制细胞的增殖和分化,过表达非内生性MSTN能够降低MyoD蛋白的表达水平,并且导致磷酸化模式的改变。由此可见,机体内MSTN基因能够通过调控成肌相关因子的表达来抑制成肌分化,从而减少机体的肌肉量。
CRISPR/Cas9(clustered regularly interspaced short palindromic repeats/CRISPR-associated protein 9)系统是细菌在进化过程中逐渐演化形成的一种针对外源DNA的适应性免疫防御系统,存在于约40%的细菌和几乎所有的古细菌中[9]。该系统能够将入侵的外源DNA剪切成丧失生物活性的小片段,并整合到自身序列中,形成规律间隔短回文重复序列。CRISPR/Cas9系统由DNA小片段转录而成crRNA和带有Cas9蛋白结合位点的tracrRNA,以及具有分子剪刀作用的Cas9蛋白组成。作用时crRNA和tracrRNA相结合,引导Cas9蛋白识别靶标DNA序列的PAM(NGG)位点进行切割[10]。目前,应用CRISPR/Cas9系统进行基因编辑的技术已发展成熟。2013年,Mali等[11]利用CRISPR/Cas9系统编辑人类细胞AAVS1基因,在293T细胞中编辑效率达到10%~25%,在K562细胞中编辑效率达到8%~13%,在诱导的多能干细胞中编辑效率为2%~4%。同年,Friedland等[12]利用CRISPR/Cas9编辑了新杆状线虫生殖细胞系,实现了靶标位点可遗传的编辑。2014年,Platt等[13]成功获得CRISPR/Cas9介导的基因敲入小鼠,并构建了能同时研究KRAS、p53和LKB1(肺癌细胞中3种最重要的突变基因)的动力学模型,使CRISPR/Cas9系统在构建疾病模型的研究和应用中又前进了一步。同样,CRISPR/ Cas9系统在提高猪的生长性和抗病性过程中也发挥着重要作用。2015年,Wang等[14]在PEF细胞中编辑MSTN基因,通过体细胞核移植,得到了表现明显“双肌”性状的小猪。2016年,Whitworth等[15]利用CRISPR/Cas9突变了猪繁殖与呼吸综合征病毒PRRSV进入细胞的受体CD163基因,从而阻滞了PRRSV的作用,得到了抗蓝耳病的猪。上述试验思路,结合MSTN基因对肌肉生长的关键作用,启发了我们利用CRISPR/Cas9技术编辑猪功能基因来改善中国地方猪种的肌肉生长性能普遍较低的弱点,以期获得高生长性能和高肌肉产量的广东小耳花猪新品种。
广东小耳花猪属于我国华南型地方猪种,具有肉质鲜美、肉色鲜红、系水力强、肌内脂肪含量高和肌纤维直径小[16]等优点,但是生长缓慢,产肉量低。目前,国内育种工作者利用传统的选育技术以及现代分子育种技术对其遗传改良和利用的效果不太理想,还处于较为简单的杂交利用阶段。基于MSTN基因的研究进展以及CRISPR/Cas9系统技术日趋成熟,本研究拟通过CRISPR/Cas9系统编辑广东小耳花猪MSTN基因,解除其对肌肉生长的抑制作用,从而进一步尝试培育产生具备高产肉量、肉质优良的广东小耳花猪新品种。试验共设计gRNA 6条,将它们分别克隆进带有U6启动子、CRISPR系统发挥作用所必需的骨架RNA(crRNA和tracrRNA)以及绿色荧光标记蛋白的PX458载体中,得到6种靶向广东小耳花猪MSTN基因不同位置的CRISPR/Cas9敲除载体。通过细胞转染,24 h后可根据绿色荧光的表达情况估计CRISPR/Cas9敲除载体转染进入细胞的比例,若敲除载体进入细胞,则U6启动子发挥作用,敲除载体各部分得以表达,绿色荧光蛋白的标记作用显现,此时细胞发绿光;若敲除载体没有进入细胞,则载体不能得以表达,细胞不发光。转染48 h后进行流式分选。流式细胞术也是根据绿色荧光将敲除质粒成功转染和未转染的细胞分开,并且精确统计各部分的细胞数量,因此,我们可以准确计算出转染效率,并对成功转染的细胞群进行T7E1酶切分析以及TA克隆系列实验,从而得到成功转染的细胞群中有多少被CRISPR/Cas9系统切割的细胞比例,了解切割后机体通过同源重组(Homology-directed repair,HDR)和非同源末端连接(Non-homologous ending-joining,NHEJ)方式修复所产生的插入或缺失类型。本试验筛选出了3条能够发生有效切割的gRNA,可用于后续体细胞核移植实验。
1 材料与方法
1.1 试验材料
广东小耳花猪胎儿来源于广东壹号食品股份有限公司核心育种场,成纤维细胞由实验室分离建立,pX458质粒购自Addgene(北京中原公司代理,货号为#48138)。
1.2 试验方法
1.2.1 gRNA设计与oligo合成 试验所用的骨架载体为pX458,利用张锋团队开发的CRISPR设计网站(crispr.mit.edu)[10]设计gRNA,分别选取MSTN基因的3个外显子区域序列输入,依据间隔相邻基序(proto-spacer adjacent motif,PAM),共筛选6条gRNA,其中一号外显子3条、二号外显子2条、三号外显子1条。具体序列见图1。
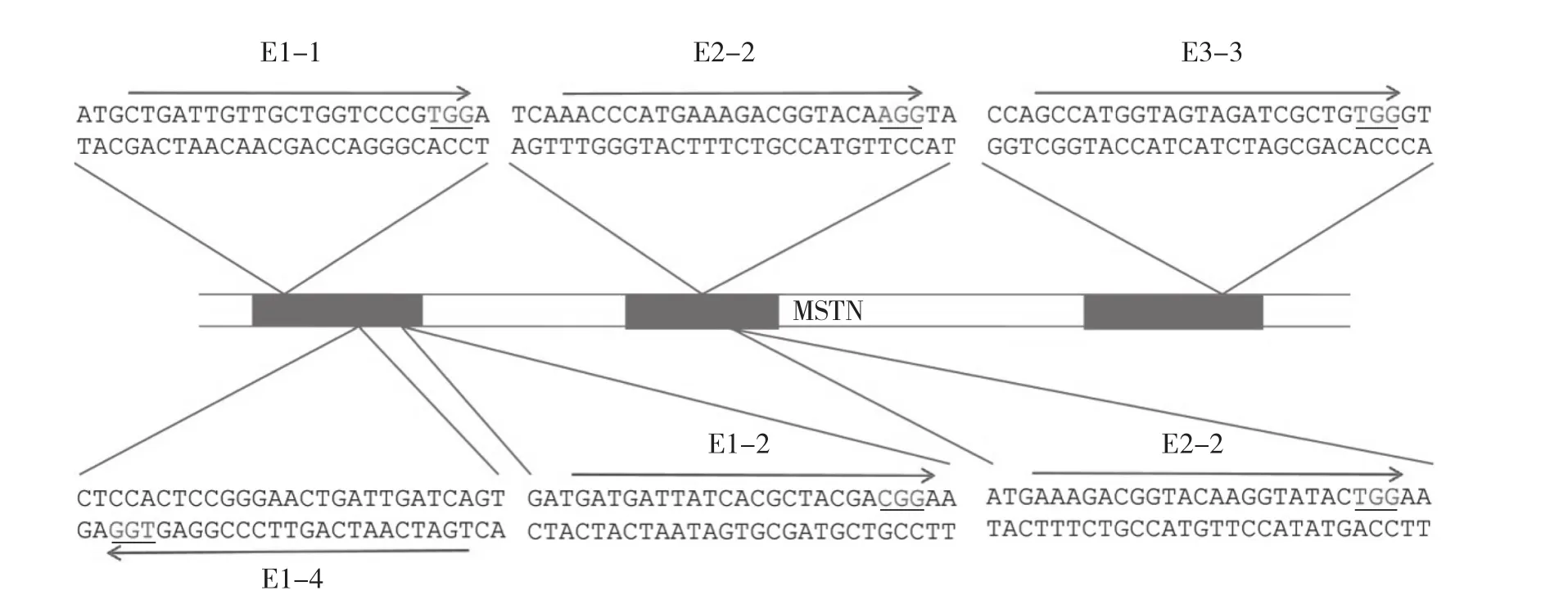
图1 gRNA序列
由于设计好的gRNA序列要插入到骨架载体pX458的相应位置,因此gRNA序列两侧需要添加BbsⅠ酶酶切骨架载体pX458后的末端碱基互补序列,之后送至生工生物工程有限公司合成。具体序列见表1。

表1 oligo序列
1.2.2 CRISPR敲除载体构建 合成的oligo加水稀释到100μmol/L,取正义链、反义链各1 μL,另添加10×T4 连接酶缓冲液、T4 PNK,补充双蒸水到10 μL,进行退火磷酸化反应,反应条件为:37℃ 30 min,95℃ 5 min,缓慢降温至25℃(5℃/min)。得到双链片段,再用BbsⅠ酶酶切pX458质粒,得到线性化载体;之后用T4连接酶将双链目的片段与线性化载体Px458质粒连接,反应条件为:37℃ 5 min,21℃ 5 min,共6个循环。得到含有能够结合广东小耳花猪基因组中靶标位点片段的CRISPR/Cas9载体;将载体转化至DH5α感受态细胞中,涂板,37℃恒温倒置培养14 h;挑取生长良好的单克隆送至生工生物工程有限公司测序。根据测序结果,选取载体构建成功的单克隆扩大摇菌,提取质粒备用。
1.2.3 广东小耳花猪PEF原代细胞获取与培养 广东小耳花猪PEF原代细胞从35日龄胚胎组织中分离获得。首先,将羊膜包裹的胎儿分别用碘酒、PBS浸泡清洗;之后用消毒的镊子撕破羊膜流出羊水,将胎儿暴露出来放在加有少量PBS的培养皿中;去除胎儿的头、尾、四肢以及内脏,剩余背部组织块;用剪刀将组织块剪碎,后转移至培养瓶中,加入适量培养基(含20%血清)混匀,置于CO2培养箱。3 d后可见PEF细胞从组织块中渗出。之后观察细胞,适时换液传代。
1.2.4 PEF细胞转染 选取生长良好、密度在80%左右的细胞进行电转。首先消化细胞,PEF细胞用PBS清洗两遍,加入适量胰酶,置于CO2培养箱1 min,显微镜下观察,细胞呈圆形且漂浮时即可加入含20%血清的培养基终止消化。之后将细胞转移至离心管中,1 600 r/min离心 5 min,弃上清,加入适量PBS重悬细胞,进行细胞计数。原则上电转100 μL体系每个样需要的细胞数量为1×106~5×106,需要载体质粒5~10 μg。细胞计数后根据样品数量计算需要的重悬液体积,在细胞中加入适量的细胞重悬液R,再分装至1.5 mL离心管中;随后在每份细胞中加入等质量的含有不同gRNA的CRISPR/ Cas9载体质粒,静置3 min;另外,在电转杯中加入3~5 mL电转缓冲液E2。最后,使用电转仪,按照1 650 V、10 ms、3 次脉冲的程序电转细胞,电转完的细胞加入预先准备好的六孔板中,置于CO2培养箱培养。24 h后换液,用荧光显微镜观察转染情况;48 h后过流式细胞仪,根据CRISPR/Cas9载体上携带的绿色荧光标记,筛选中靶细胞。
1.2.5 流式细胞仪分选 电转培养的细胞用PBS清洗2遍,胰酶消化,经滤网过滤到流式管中。上机,根据CRISPR/Cas9载体携带的绿色荧光蛋白标记筛选中靶细胞,继续培养。
1.2.6 T7E1试验 经过分选的细胞培养至足够数量,提取细胞基因组(QIAGEN试剂盒),用T7E1上下游引物(具体序列见表2)进行PCR,扩增出CRISPR/Cas9载体切割位点上下游共500 bp左右的片段,将目的片段切胶回收(OMEGA试剂盒),之后进行退火,400 ng胶回收产物,另添加2 μL buffer2、补充双蒸水至20 μL,反应条件为:95℃ 10 min;95~85℃(-2.0℃/min);85℃ 1 min;85~75℃(-0.3℃/min);75℃ 1 min;75~65℃(-0.3℃/min);65℃ 1 min;65~55℃(-0.3℃/min);55℃ 1 min;55~45℃(-0.3℃/min);45℃ 1 min;45~35℃(-0.3℃/min);35℃ 1 min;35~25℃(-0.3℃/min);25℃ 1 min;25~4℃(-0.3℃/min)。在退火完成后的20 μL体系中加入0.5 μL T7E1酶,按照37℃ 40 min的反应条件进行酶切。最后恒压跑胶(120 V,90 min),在EB中浸泡10 min显色后,用曝光仪曝光条带。通过软件IMAGE J对条带进行灰度扫描,用以下公式:切割率=1-(1-切除片段所占百分比)0.5计算切割效率。

表2 MSTN敲除位点扩增引物
1.2.7 测序分析 将上一步切胶回收的产物连接到PMD18载体中,反应体系为:胶回收产物1μL、SolutionⅠ 5 μL、PMD18载体1 μL,补充双蒸水至10 μL。反应条件为:16℃水浴30 min。随即进行转化,30 μL感受态DH5α与5 μL连接产物混合,依次进行如下步骤:冰上放置25 min,42℃ 45 s,冰上放置2 min,加入1 mL无抗液体LB,37℃ 220 r/min摇菌1 h;8 000 r/min离心2 min,弃上清800 μL,其余混匀,涂板。12~16 h后挑取单克隆送生工生物工程有限公司进行测序。测序结果与野生型广东小耳花猪MSTN基因组进行比对,明确CRISPR/Cas9载体在MSTN基因中的突变位置和突变类型。
2 结果与分析
2.1 CRISPR敲除质粒转染广东小耳花猪PEF细胞
电转PEF细胞后24 h,利用荧光显微镜观察荧光表达情况,可见绿色荧光表达率较高(图2A);48 h通过流式细胞术分选细胞,根据表达的绿色荧光可将CRISPR/Cas9切割质粒转染成功的细胞分选出来,分析可见荧光率,即转染成功的效率均在30%以上(图2B)。
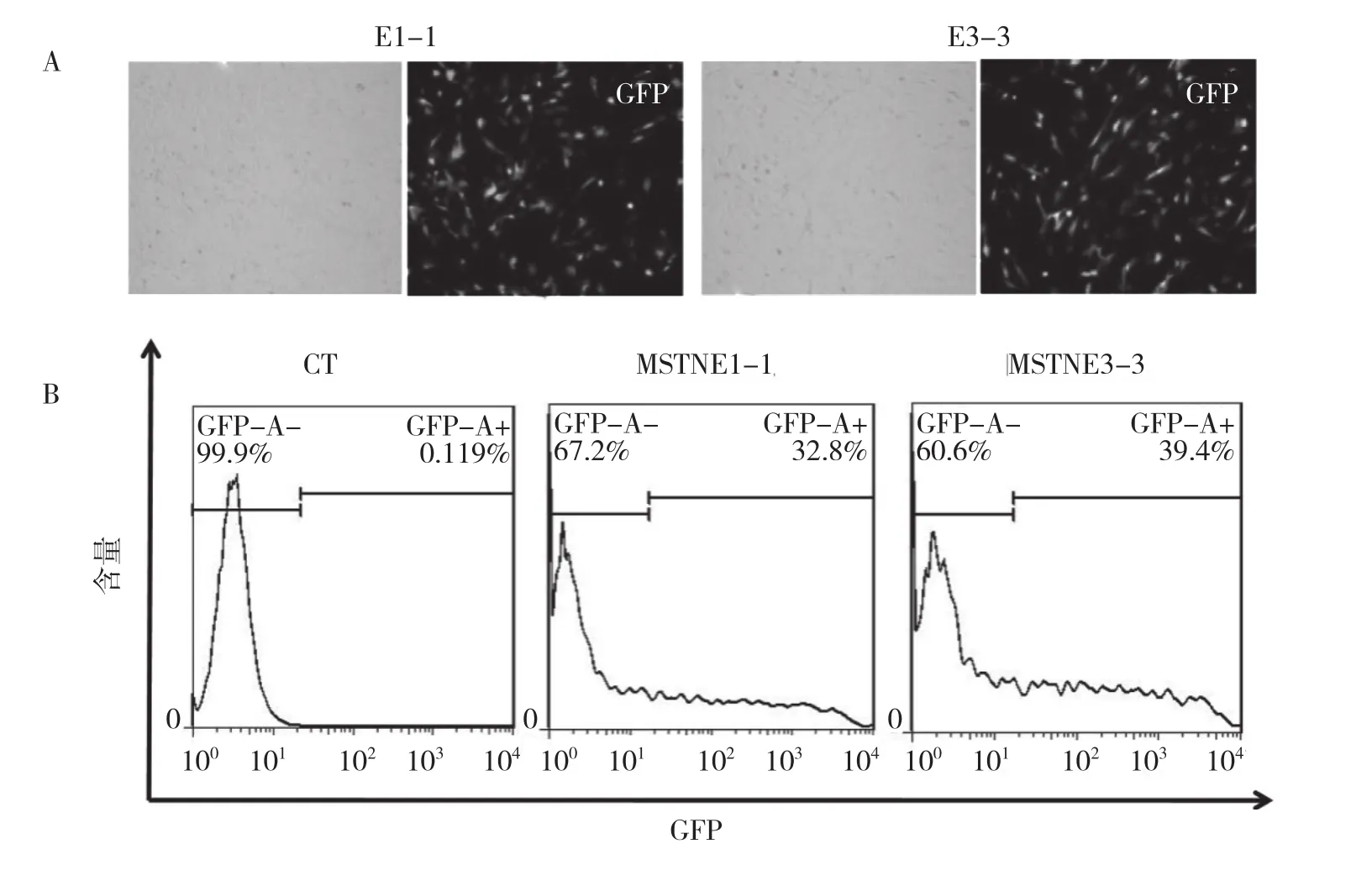
图2 CRISPR敲除质粒转染广东小耳花猪PEF细胞
2.2 T7E1酶切鉴定
从图3可以看出,试验设计的6条gRNA 中5条发生了切割,其中3条发生了有效切割。由于gRNA2-1和gRNA2-2与阴性对照相比有部分条带重叠,且后续测序结果显示在发生的所有突变中有一部分是本身就存在于基因组中的突变,因此gRNA2-1和gRNA2-2的切割效率不能准确计算,从而认为它们发生无效切割。综合3次重复试验结果,切割效率如下:gRNA1-1为26.0%,gRNA1-2为17.0%,gRNA3-3为28.3%。

图3 T7E1酶切鉴定结果
2.3 TA克隆测序分析
后续选取切割效率较高的gRNA1-1和gRNA3-3做TA克隆,并送测序。测序结果(图4)表明,gRNA1-1发生突变的类型有4种,全部为切割位点附近碱基的缺失,差别在于缺失的碱基数目差异;gRNA3-3发生突变的类型有1种,即切割位点单碱基的缺失。经计算,两条gRNA的突变效率分别如下:gRNA1-1为50%,gRNA3-3为61.5%。

图4 TA克隆测序结果
3 结论与讨论
本试验旨在获得广东小耳花猪MSTN基因失活的细胞系,以期解除MSTN对中国地方猪种广东小耳花猪肌肉生长的抑制,使其在保证优良肉质性状和口感的前提下,能够适当增加肌肉产量。CRISPR/Cas9技术的出现与日益成熟的应用,为本试验的开展提供了较好的技术保障。本试验设计了6条靶向广东小耳花猪MSTN基因的gRNA,最终筛选出2条突变率较高的gRNA,后续将进一步进行体细胞核移植,为生产MSTN基因编辑猪奠定了基础。
本试验最终获得了gRNA1-1和gRNA3-3突变的广东小耳花猪PEF细胞系,突变效率均在50%以上,其中三号外显子上突变位点的突变率达到61.5%。张冬杰等[17]用CRISPR/Cas9定点突变猪MSTN基因获得38%的突变率;Han等[18]利用CRISPR/Cas9敲除绵羊MSTN基因,所设计的3条gRNA得到的平均突变率为19.3%;胡曼等[19]验证了CRISPR/Cas9在鸡MSTN基因上的突变效率,编码了一号外显子和二号外显子上的两个靶点,突变率分别为64.3%和23.3%。与已有相关数据相比,本试验结果比较乐观。较高的突变率表示在一群细胞中,CRISPR/Cas9系统编辑过的细胞数量较多,细胞群移植到猪体内得到基因编辑猪的可能性较大。我们在之前的试验中证明了转染进细胞的质粒会在转染21 d后就检测不到,即该载体不会整合进细胞基因组,降低了生物安全问题[20]。本试验证明了CRISPR/Cas9技术在中国地方猪种基因编辑改造上的可能性,目前该技术也已成为畜禽育种的新方法之一,试验结果中取得的较高的突变效率也为进一步开展体细胞核移植试验奠定了坚实基础。
[1]McPherron A C,Lee S J. Suppression of body fat accumulation in myostatin-deficient mice[J]. The Journal of Clinical Investigation,109(5):595-601.
[2]Hanset R,Michaux C,Dessy-Doize C,et al. Studies on the 7th Rib Cut in Double Muscled and Conventional Cattle. Anatomical,histological and biochemical aspects[M].//Muscle hypertrophy of genetic origin and its use to improve beef production. Springer Netherlands,1982:341-349.
[3]Swatland H J,Kieffer N M. Fetal development of the double muscled condition in cattle1[J]. Journal of Animal Science,1974,38(4):752-757.
[4]Jinqing W,Gui M,Zhiguo L,et al. Improving gene targeting efficiency on pig IGF2 mediated by ZFNs and CRISPR/Cas9 by using SSA reporter system[J]. Yi Chuan,2015,37(1):55-62.
[5]Thomas M,Langley B,Berry C,et al. Myostatin,a Negative Regulator of Muscle Growth,Functions by Inhibiting Myoblast Proliferation[J]. Journal of Biological Chemistry,2000,275(51):40235-40243.
[6] Taylor W E,Bhasin S,Artaza J,et al. Myostatin inhibits cell proliferation and protein synthesis in C2C12 muscle cells[J]. American Journal of Physiology - Endocrinology And Metabolism,2001,280(2):e221.
[7]Rýìos R,Carneiro I,Arce V M,et al. Myostatin is an inhibitor of myogenic differentiation [J]. American Journal of Physiology - Cell Physiology,2002,282(5):C993-C999.
[8]Joulia D,Bernardi H,Garandel V,et al. Mechanisms involved in the inhibition of myoblast proliferation and differentiation by myostatin[J]. Experimental Cell Research,2003,286(2):263-275.
[9]Horvath P,Barrangou R. CRISPR/Cas,the immune system of bacteria and archaea[J]. Science,2010,327(5962):167-170.
[10]Ran F A,Hsu P D,Wright J,et al. Genome engineering using the CRISPR-Cas9 system[J]. Nat. Protocols,2013,8(11):2281-2308.
[11]Mali P,Yang L,Esvelt K M,et al. RNA-Guided Human Genome Engineering via Cas9[J]. Science,2013,339(6121):823-826.
[12]Friedland A E,Tzur Y B,Esvelt K M,et al. Heritable genome editing in C. elegans via a CRISPR-Cas9 system[J]. Nat Meth,2013,10 (8):741-743.
[13]Platt Randall J,Chen S,Zhou Y,et al. CRISPRCas9 Knockin Mice for Genome Editing and Cancer Modeling[J]. Cell,2014,159(2):440-455.
[14]Wang K,Ouyang H,Xie Z,et al. Efficient Generation of Myostatin Mutations in Pigs Using the CRISPR/Cas9 System[J]. Sci Rep,2015,5:16623.
[15]Whitworth K M,Rowland R R,Ewen C L,et al. Gene-edited pigs are protected from porcine reproductive and respiratory syndrome virus[J]. Nat Biotechnol,2016,34(1):20-22.
[16]张仲葛,张晓岚,李锦钰. 中国猪的优良种性及其对世界养猪业的贡献[J]. 自然资源学报,1994,9(1):1-8.
[17]张冬杰,刘娣,张旭,等. 利用CRISPR_Cas9系统定点突变猪MSTN基因的研究[J]. 畜牧兽医学报,2016,47(1):207-212.
[18]Hongbing HAN,Yonghe MA,Tao WANG,et al. One-step generation of myostatin gene knockout sheep via the CRISPR/Cas9 system[J]. Front. Agr. Sci. Eng,2014,1(1):2-5.
[19]胡曼,康倩倩,胡晓湘,等. CRISPR/Cas9系统在鸡MSTN上的效率验证[J]. 中国家禽,2016,38 (7):5-9.
[20]He Z,Shi X,Du B,et al. Highly efficient enrichment of porcine cells with deletions induced by CRISPR/Cas9 using dual fluorescence selection[J]. J Biotechnology,2015,214:67-74.
(责任编辑 崔建勋)
Editing MSTN gene of Guangdong Xiaoerhua pig by using CRISPR/Cas9
WANG Min1,HUANG Xiang1,SHI Xuan1,LIU Xiao-feng1,ZENG Jian-hua2,LIU Xiao-hong1,CHEN Yao-sheng1,HE Zu-yong1
(1.State Key Laboratory of Biocontrol,School of Life Sciences,Sun Yat-sen University,Guangzhou 510006,China;2.Guangdong YIHAO Food Co.,Ltd.,Guangzhou 510620,China)
MSTN (Myostatin) gene functions as a negative regulator of muscle growth. Therefore,disrupting the expression of MSTN has been proved as an efficient strategy to improve the muscle mass in livestock and poultry. In this study,we edited the exons of MSTN gene to disrupt its expression in order to increase muscle production of Guangdong Xiaoerhua pig by using the cutting-edge genome editing technology—CRISPR/Cas9. We designed six guide RNAs targeting on loci across three exons of MSTN gene. Through T7E1 assay and TA cloning analysis,we found that three guide RNAs were capable of targeted cutting on MSTN gene efficiently, with the targeting efficiency ranging from 17.0% to 28.3%. The editing efficiency of gRNA1-1 and gRNA3-3 in PEF cells of Guangdong Xiaoerhua pig,were both up to 50%. Particularly,editing efficiency in the third exon was as high as 61.5%. This study provides basis to generate MSTN-edited Xiaoerhua pigs by somatic cell nuclease transfer(SCNT) in future.
MSTN; CRISPR/Cas9; Guangdong Xiaoerhua pig; gene editing
Q789;S813.3
A
1004-874X(2017)02-0141-08
2016-11-15
国家转基因生物新品种培育重大专项(2016ZX08006003-006);广东省自然科学基金(2016A0 30313310);广东省扬帆计划项目(2014YT02H042)
王敏(1992-),女,在读硕士生,E-mail:907825503@qq.com
何祖勇(1981-),男,博士,副教授, E-mail:zuyonghe@foxmail.com
王敏,黄翔,石翾,等.应用CRISPR/Cas9编辑广东小耳花猪MSTN基因[J].广东农业科学,2017,44(2):141-148.
