西洋菜锌铁转运蛋白NoZIP1基因的克隆及表达研究
2017-04-27张秋玲卢晓丹钟燕珊傅明辉
张秋玲,卢晓丹,钟燕珊,傅明辉
(广东工业大学轻工化工学院,广东 广州 510000)
西洋菜锌铁转运蛋白NoZIP1基因的克隆及表达研究
张秋玲,卢晓丹,钟燕珊,傅明辉
(广东工业大学轻工化工学院,广东 广州 510000)
对西洋菜锌铁转运蛋白基因NoZIP1进行克隆及表达分析,为研究其在西洋菜生长发育过程中的生物学功能奠定基础。利用RACE技术克隆西洋菜NoZIP1基因,用生物信息学方法分析获得的基因序列结构,利用实时荧光定量PCR研究NoZIP1基因在不同组织及不同培养条件下的表达特性。结果表明,西洋菜NoZIP1基因cDNA全长1 239 bp,包含完整的阅读框,编码356个氨基酸。实时荧光定量PCR分析显示,NoZIP1基因的表达在锌或者铁胁迫条件下根、叶中均有诱导上调趋势。
西洋菜;锌铁转运蛋白;RACE;实时荧光定量PCR
锌和铁是植物生长所必需的微量元素,在植物体内的许多生化反应中起着重要作用[1]。锌是生物体300多种酶的辅助因子,同时是生物体内重要蛋白质的结构辅助因子[2],不仅参与生物体的各种代谢,在生物膜的稳定及基因表达等生理机能中也具有重要作用[3]。铁在细胞呼吸、光合作用和金属蛋白的催化反应过程中发挥重要作用,是重要的电子传递体。铁元素在原核和真核生物的生命活动中具有不可替代的功能[4]。缺锌或者缺铁都会影响植物的生长发育,但积累过量的锌和铁都会对植株造成一定的毒害作用[5-6]。植物在长期进化过程中为适应不良环境胁迫形成了一系列应答机制,这些应答反应往往通过植物细胞内基因表达的变化来实现,已发现一些与锌铁吸收和运输有关的基因在应对锌铁胁迫中起重要作用。其中研究较多的是ZIP家族[7]。ZIP家族即锌调控转运体(Zinc-regulated transporter,ZRT)和铁调控转运体(Iron-regulated transporter,IRT),多数存在于真核细胞中,植物体内的ZIP家族基因可转运Cd2+、Fe2+、Mn2+、Zn2+等多种金属离子,但不同的ZIP家族成员对金属离子作用的特异性不同,对金属离子作用的浓度范围也不同[8-10]。
目前已在拟南芥、水稻、大豆、玉米、苜蓿和番茄等多种植物中发现了ZIP家族基因[11-15]。研究ZIP基因功能时发现,在拟南芥中,AtZIP1-4均能转运锌,AtZIP1和AtZIP2还能转运铜;而AtIRT1能转运锌、铁、锰、镉,其对Zn2+的转运在pH<4.5时才具备,AtIRT2能转运锌和铁,不转运锰和镉[16]。水稻中OsZIP1、OsZIP3、OsZIP4和OsZIP8均具有转运锌的功能,OsZIP1、OsZIP3不能转运铁和锰,OsZIP4不能转运铁[3,12]。苜蓿中MtZIP1、MtZIP5和MtZIP6能转运锌,MtZIP4和MtZIP7能转运锰,MtZIP3、MtZIP5和MtZIP6能转运铁[17]。这些都表明ZIP蛋白虽能转运多种金属离子,但很多ZIP蛋白转运离子具有专一性,而目前对西洋菜中的ZIP家族基因研究较为罕见。西洋菜(Nasturtium officinale R.Br.)又名豆瓣菜,是一种从国外引进的水生蔬菜,在广东、广西等省栽培较多,口感嫩脆,深受人们喜爱,具有一定的食用与药用价值[18]。研究表明,西洋菜是一种重要的防癌蔬菜,对心血管疾病、糖尿病、神经性疾病等慢性疾病也有一定的防御作用[19-20]。我们以西洋菜为材料,利用RACE技术成功地克隆了完整的锌铁转运蛋白基因全长,对其同源性及相应蛋白的结构和功能进行了预测分析,并运用实时荧光定量PCR分析方法对不同环境条件下该基因的表达情况进行研究,了解NoZIP1基因的分子特征,为下一步研究其在西洋菜生长发育过程中的生物学功能奠定基础。
1 材料与方法
1.1 试验材料
西洋菜购于广州大学城南亭市场。RNA提取试剂、3′RACE试剂盒以及克隆步骤中PCR、反转录反应所使用的相关试剂及大肠杆菌感受态均购自TaKaRa公司,smarter Race试剂盒购自Clontech公司,引物合成及基因测序由上海Introvigen公司完成。
1.2 植物培养与取样
将西洋菜于砂石基质中培养,培养液为1/2 浓度的Hoagland营养液,环境温度为25 (± 2)℃,相对湿度为70(±5 ) %,培养时间为2~3 d。待西洋菜根系长出后,进行缺锌处理(原营养液去掉Zn源培养)。培养3~4 d后对根部进行取样,液氮迅速研磨后放入-80℃冰箱保存备用。
1.3 西洋菜根系总RNA的提取
采取Trizol提取法提取西洋菜根系总RNA。取西洋菜根系0.1 g,液氮研磨后,装入已加1 mL RNAiso Plus裂解液的离心管中,剧烈振荡30~60 s;加0.2 mL氯仿,剧烈振荡15 s,室温静置5 min;4℃下12 000 g离心15 min;取上清加等体积异丙醇,颠倒混匀,室温静置10 min;4℃下12 000 g离心10 min;小心弃去上清,加1 mL 75%乙醇(DEPC水配制)上下颠倒混匀,4℃下12 000 g离心5 min;弃上清,干燥RNA,溶于15 μL DEPC水中,于-80℃冰箱中保存备用。
1.4 西洋菜NoZIP1基因的克隆
1.4.1 RT-PCR获得西洋菜ZIP基因的保守片段 以西洋菜总RNA为模板,Oligo dT为引物合成第一链cDNA。在NCBI中找出水稻、玉米、小麦等20多种单子叶被子植物锌铁转运蛋白基因序列,利用iCODEHOP在线设计软件设计1对简并引物ZIP1F/ ZIP1R(表1)。以第一链cDNA为模板,ZIP1F/ZIP1R为引物进行PCR扩增获得ZIP基因的保守片段。PCR反应程序为94℃ 5 min;94℃ 30 s、52℃ 30 s、72℃ 60 s,30个循环;72℃ 10 min。

表1 引物序列
1.4.2 西洋菜NoZIP1基因3′端克隆 根据已获得的中间片段设计1对特异性引物ZIP2F/ ZIP2R(表1),参照Takara公司3′RACE试剂盒的说明书进行反转录和两轮巢式PCR扩增得到西洋菜NoZIP1基因的3’端。第一轮PCR反应程序为:94℃ 3 min;94℃ 30 s、64.3℃ 30 s、72℃ 60 s,循环30次;72℃ 10 min。第二轮PCR反应程序为:94℃ 3 min;94℃ 30 s、57.7℃ 30 s、72℃ 60 s,循环30次;72℃ 10 min。
1.4.3 西洋菜NoZIP1基因5′端克隆 根据已获得的保守片段及3′端片段设计1对特异性引物ZIP3F/ZIP3R(表1),参照Clontech公司smarter Race试剂盒说明书进行反转录和巢式PCR扩增得到西洋菜NoZIP1基因的5′端。第一轮PCR反应条件为:94℃ 3 min;94℃ 30 s、64℃ 30 s、72℃ 2 min,循环5次;94℃ 30 s、62℃ 30 s、72℃ 2 min,循环5次;94℃ 30 s、58℃ 30 s、72℃ 2 min,循环25次。第二轮PCR反应条件为:94℃ 3 min;94℃ 30 s、64℃ 30 s、72℃ 2 min,循环5次;94℃ 30 s、62℃ 30 s、72℃ 2 min,循环5次;94℃ 30 s、58℃ 30 s、72℃ 2 min,循环20次。
1.4.4 西洋菜NoZIP1基因cDNA全长克隆 将克隆得到的中间片段、3′端及5′端用DNAMAN软件进行拼接,获得西洋菜NoZIP1基因的cDNA全长序列。用NCBI在线ORF Finder找到该序列的开放阅读框ORF,在ORF两端设计1对全长引物ZIP4F/ZIP4R(表1),以cDNA为模板进行普通PCR,扩增全长序列。PCR反应程序为:94℃ 3 min;94℃ 30 s、50.5℃30 s、72℃ 60 s,循环30次;72℃ 10 min。
1.5 西洋菜NoZIP1基因编码蛋白的生物信息学分析
蛋白质的基本理化性质用PortParam (http://web.expasy.org/protparam)进行分析,蛋白质亲疏水性用PortScale (http://www.expasy.org/cgibin/protscale.pl)分析,用TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/)对蛋白质进行跨膜区分析,信号肽预测用SignalP (http://www.cbs.dtu.dk/services/SignalP/),亚细胞定位用TargetP(http://cbs.dtu.dk/services/ TargetP/),NoZIP1蛋白的保守结构区域用SMART数据库(http://smart.Embl-heidelberg. De/)分析,利用BLASTX进行NCBI蛋白质全库的相似性搜索(http://blast.ncbi.nlm.nih.gov/ Blast.cgi)。ClustalW2多序列比对后用Mega7.0构建分子进化树(邻接法)。
1.6 西洋菜NoZIP1基因的实时荧光定量表达分析
对用1/2 浓度的Hoagland营养液培养已长出根系的西洋菜设置5种处理:缺锌处理(原营养液去掉Zn源培养)、50%锌处理(去掉原营养液一半的Zn源)、缺铁处理(原营养液去掉Fe源)、50%铁处理(去掉原营养液一半的Fe源)、缺Zn & Fe处理(去掉原营养液的Zn源和Fe源)。培养4 d并在每天的固定时间对根部和叶部进行取样,液氮迅速研磨后放入-80℃冰箱中保存备用。
利用RNA提取试剂盒分别提取根部和叶部不同盐处理1、2、3、4 d的总RNA,全营养处理的西洋菜作为对照,西洋菜肌动蛋白基因作为内参 (登录号为:KX863723)。引物序列为Act-F/Act-R,根据上述获得的NoZIP1基因全长序列设计定量引物G-F/G-R(表1)。按照SYBR Premix Ex Taq II试剂盒(Takara)操作,两步法进行PCR扩增:95℃ 30 s 进行1个循环,95℃ 5 s,51℃ 30 s进行40个循环反应,添加熔解曲线程序(从65℃到95℃,每5 s 增加0.5℃并读取荧光值1次)。反应混合液在 Light Cycle 96 荧光定量仪中进行反应,每个样品都设置3个重复。反应结束后获得NoZIP1基因和内参基因Actin在各个样品的Ct值 (threshold cycle),按照2-ΔΔCt方法对数据进行处理,计算基因在各个样品中的相对表达量。
2 结果与分析
2.1 西洋菜NoZIP1基因的克隆
克隆西洋菜NoZIP1基因的保守序列、3′端序列及5′端序列,均能扩增出750 bp左右的特异片段(图1),回收特异片段进行测序,分别得到长度为662、521、475 bp的序列。
用DNAMAN软件将得到的保守片段、3′端序列及5′端序列去掉重复片段后进行拼接,获得西洋菜NoZIP1基因的cDNA全长序列。同时在该序列开放阅读框的两端设计引物(ZIP-2F/ZIP-2R),扩增出一条1 087 bp的特异片段(图1)。将该片段进行测序,发现测序结果与拼接结果完全相同。序列提交NCBI获得序列登陆号为KX858826。
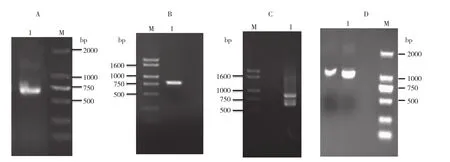
图1 电泳结果
2.2 西洋菜NoZIP1蛋白的生物信息学分析
对西洋菜NoZIP1基因的全长cDNA序列进行分析,结果表明,该序列全长1 239 bp,包括一个完整的阅读框,含有1 071 bp核苷酸,共编码356个氨基酸;5′和3′端非编码序列长度分别为53 bp和115 bp。使用Portparam分析西洋菜NoZIP1基因编码的氨基酸序列的理化性质,结果显示,该序列的分子量为38.116 ku,理论等电点为6.45,总负电荷残基数目为27,总正电荷残基数目为23,分子式为C1705H2701N449O483S28,不稳定指数为37.49,属于稳定蛋白,脂肪指数为102.25。利用在线工具对NoZIP1基因亚细胞定位进行预测,结果显示,该蛋白的分泌途径为S型,即定位在分泌通路,预测剪切位点序列为27个氨基酸。用在线工具PortScale对西洋菜NoZIP1基因编码的氨基酸序列进行疏水性分析,窗口大小选择9,结果表明(图 2),该蛋白在N端、C端、跨膜区都存在明显的疏水区。用ProtParam tool 分析该蛋白氨基酸的平均疏水系数为 0.477,说明该蛋白为疏水蛋白。

图2 NoZIP1蛋白的亲水性/疏水性分析
用TMHMM Server对蛋白进行跨膜区分析,预测结果(图3,封二)显示,该蛋白含有9个跨膜区(5~27、53~72、85~107、127~149、200~222、232~254、261~283、298~320、332~354),跨膜区的长度均为22个氨基酸残基。表明该蛋白可能是一种跨膜运输蛋白。用在线工具SignalP对蛋白进行信号肽预测,结果表明NoZIP1蛋白含有信号肽,可能在跨膜运输中起信号识别作用,剪切位点位于第27~28位氨基酸之间。用在线工具SMART和InterProScan对蛋白质的结构域进行分析,结果显示,NoZIP1蛋白第49~353位之间是个高度保守的结构功能域,即ZIP家族成员共有的典型结构域。同时利用Portfun 2.2 server对NoZIP1蛋白的功能进行预测,结果表明,NoZIP1蛋白参与金属离子运输和调控过程的功能概率最高为 0.773,说明NoZIP1蛋白在机体内可能有转运Zn2+、Fe2+的功能。
2.3 西洋菜NoZIP1蛋白与其他ZIP类蛋白的系统进化树及相似性分析
根据NoZIP1序列推导出的氨基酸序列在NCBI中Blast P的比对结果,选取蛋白序列同源性相对较高的荠蓝(Camelina sativa L.,XP_010499439.1)、拟南芥(Arabidopsis thaliana Thal.,NP_187881.1)、木豆(Cajanus cajan L.,KYP36079.1)、鹰嘴豆(Cicer arietinum L.,XP_004488546.1)、野生大豆(Glycine soja Sieb.et Zucc.,KHN21378.1)、中棉(Gossypium raimondii UIbr.,XP_ 012463602.1)、陆地棉(Gossypium hirsutum L.,XP_016706618.1)、川桑(Morus notabilis Schneid.,XP_010109875.1)、梅花(Prunus mume Sieb.,XP_008226052.2)、蓖麻(Ricinus communis L.,XP_002532140.1)、可可树(Theobroma cacao L.,XP_007022739.1)、醉蝶花(Tarenaya hassleriana Chod.,XP_010544345.1)、油菜(Brassica napus L.,XP_013586854.1)、绿豆(Vigna radiate L.,XP_014501490.1)、苹果(Malus domestica Mill.,XP_008371921.1)、大豆(Glycine max L.,XP_003531480.1)等16种植物ZIP基因的氨基酸序列与西洋菜NoZIP1氨基酸序列构建系统发育树。其中西洋菜与荠蓝、拟南芥、油菜、醉蝶花的氨基酸序列相似性高达66%~90%。系统进化树分析结果(图4A)表明,西洋菜NoZIP1基因编码蛋白与拟南芥、荠蓝、醉蝶花的亲缘关系较近,与川桑、蓖麻、梅花等的亲缘关系较远,且该蛋白分子进化历程与物种进化历程一致。同时下载具有代表性的拟南芥ZIP家族蛋白氨基酸序列AtZIP1~12及AtIRT1~3,使用MEGA7软件邻接法构建系统进化树,结果(图4B)显示,NoZIP1蛋白与AtZIP1聚成一个分支,表明两者亲缘关系较近。

图4 NoZIP1基因与其他植物ZIP基因氨基酸进化树分析
2.4 西洋菜NoZIP1基因在不同组织中的表达情况
西洋菜NoZIP1基因在不同组织、不同培养条件下的表达情况见图5和图6。对图5、图6中的数据进行单因素方差分析发现,同一种处理下不同天数的相对表达量数值间P值均小于0.001,说明各处理条件下不同天数的表达量具有显著性差异。从图5、图6可看出,NoZIP1基因在西洋菜根部和叶部的表达量总体均为先下降后上升,但根部表达量下降更快,第1天即较对照有较大幅度的下降,说明根部对缺营养素的响应比较迅速。根部中,表达量下降持续的时间为1~2 d,一般是从第2天开始表达量出现诱导上升并达到最大值。而双缺和缺铁条件下表达量最大值出现在第3天,较其他条件稍晚,但缺铁条件下的表达量上升非常显著。叶部中,表达量下降持续时间为2~3 d,比根部稍长,一般从第4天开始上升。综上说明,NoZIP1基因在根部和叶部均能受缺营养素的影响而诱导表达,只是在不同组织中出现诱导的时间存在差异。
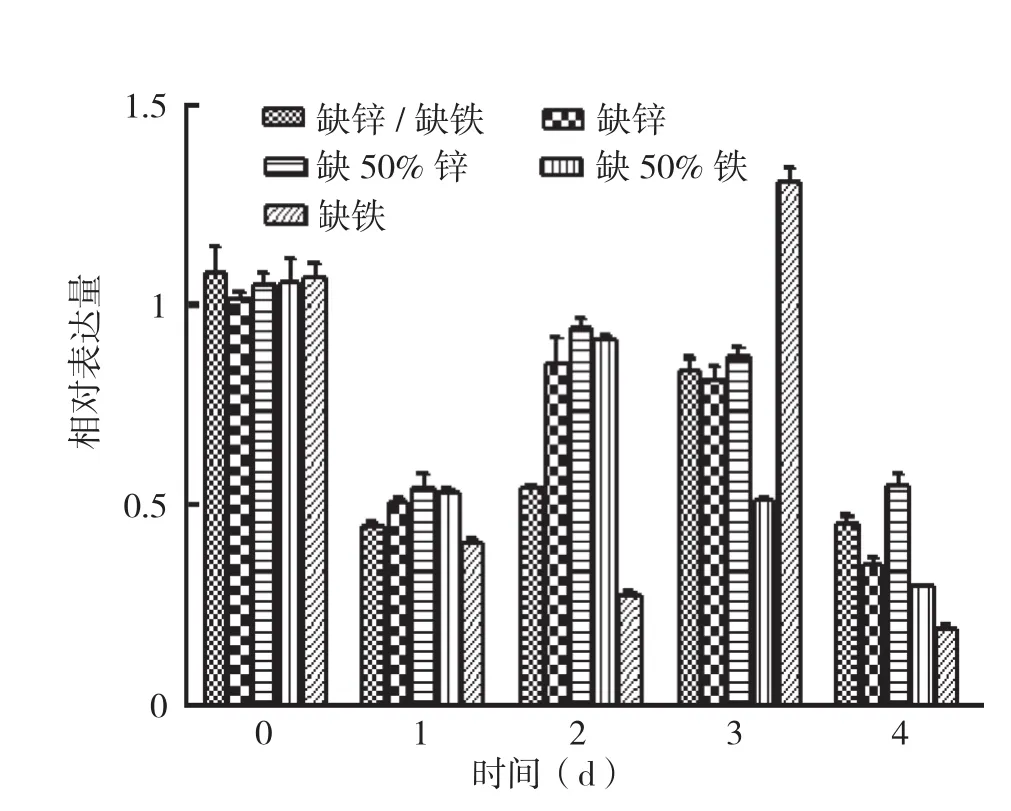
图5 NoZIP1在根部不同条件下的相对表达量分析
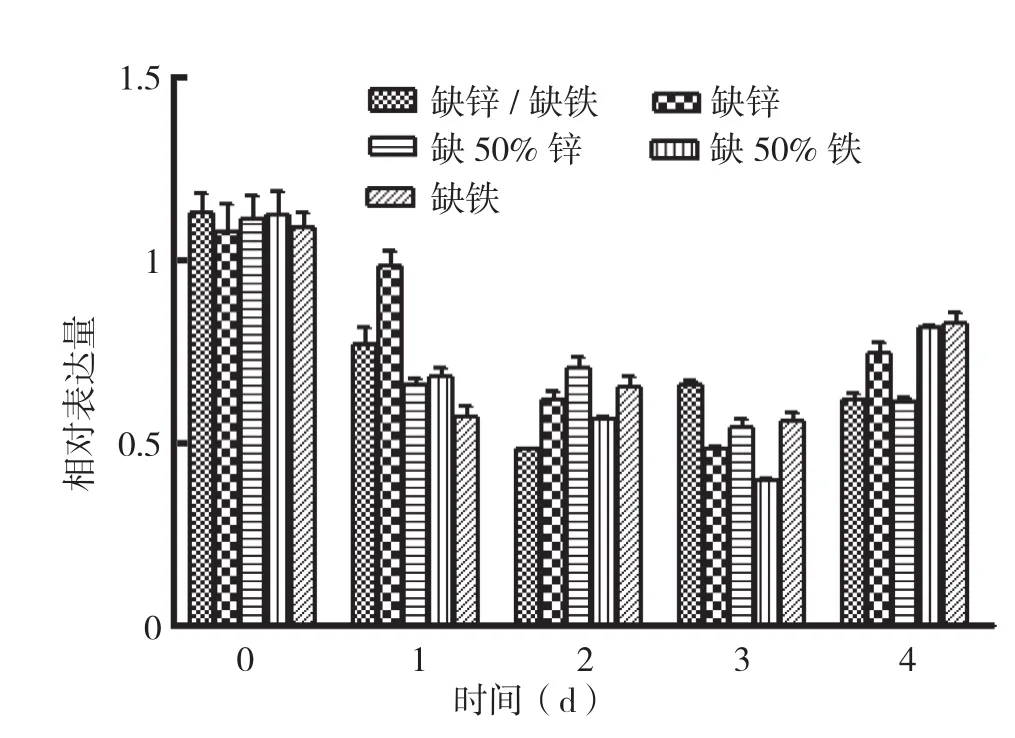
图6 NoZIP1在叶部不同条件下的相对表达量分析
3 结论与讨论
本研究利用RACE技术成功克隆出1 条ZIP全长基因,通过系统进化树聚类分析暂命名为NoZIP1。利用生物信息学方法分析,NoZIP1 蛋白具有9个跨膜域,1个信号肽序列(1~26)和1个ZIP家族特征序列(49~353),具有跨膜运输活性和阳离子转运载体结合位点,在 N 端、C 端、及跨膜区均存在明显的疏水区,因此推测NoZIP1蛋白为跨膜运输蛋白。实时荧光定量PCR分析表明,NoZIP1基因在根部和叶部均受诱导上调表达,其表达能够响应外界锌离子和铁离子浓度变化。
西洋菜是一种具有一定药用价值的可食用蔬菜,也是一种可对水体富营养化进行修复的蔬菜[21],在恶劣生长环境下也能生长良好,体内有一套对不同环境胁迫的应答机制。植物体内对锌、铁的吸收,运输,分配及维持细胞内锌铁离子的平衡稳定离不开一些蛋白家族的协同作用。与锌铁吸收的蛋白家族主要有ZIP家族、黄色条纹蛋白家族(yellow stripe-like,YSL)、自然抗性相关巨噬蛋白家族(The natural resistance associated macrophage protein,NRAMP)及阳离子扩散辅助蛋白家族(Cation diffusion facilitator protien,CDF)等[22]。对ZIP家族功能结构特点进行研究发现,多数锌铁转运蛋白含8个跨膜区及相似的膜拓扑结构,等电点在5~9.28之间,不稳定系数为27~44,ZIP蛋白长度为226~459个氨基酸,氨基酸数目的不同主要是因为Ⅲ、Ⅳ跨膜区间的“可变区”长度不同。一般认为,可变区位于胞内,且富含组氨酸残基,可能与金属离子的结合、转运有关[23-24]。本研究采用生物信息学方法对西洋菜NoZIP1蛋白进行分析发现,西洋菜NoZIP1蛋白具有ZIP家族基因的一些基本特征,且在第49~353位氨基酸之间有ZIP家族成员共有的典型结构域,因此推断NoZIP1是ZIP家族成员之一。在用NCBI的Blast P进行氨基酸序列比对时发现,NoZIP1与其他16种植物的ZIP1蛋白相似性达57%~90%,故将本研究中克隆得到的基因暂命名为NoZIP1。在进行系统分子进化树构建时发现,该蛋白分子进化历程与物种进化历程一致,同一分支中均为双子叶植物。与拟南芥ZIP家族构建系统进化树的结果中显示,NoZIP与AtZIP1属同一分支,亲缘关系最近,且西洋菜本身也属于南芥族,故推测NoZIP1与AtZIP1可能具有相似的功能。
在对ZIP蛋白表达情况的研究时发现,ZIP家族成员编码的基因在许多植物的各个不同器官中(籽粒、花、根、茎、根瘤)都有表达,但表达模式呈现一定的差异性[25]。目前已在拟南芥中发现了16个ZIP家族基因,且AtIRT1是最早被发现的ZIP 家族成员,主要在根部表达[26-28]。研究发现,AtZIP1、AtZIP5、AtZIP9 和AtZIP12受缺锌诱导表达[29],说明这些基因在缺锌条件下可能增强对锌的吸收。对水稻中的ZIP家族成员进行分析时发现,OsZIP1、OsZIP3、OsZIP8在根部和地上部中均受缺锌诱导表达,其中OsZIP1在根部的表达量比地上部高,OsZIP7a在根部缺铁诱导,OsZIP8在缺铁时根和叶中的表达量均不高[30-31]。López-Millón等[17]从苜蓿中分离得到了MtZIP1和MtZIP3-7,半定量RT-PCR分析结果显示,对苜蓿进行缺锌处理时,MtZIP1在苜蓿的根和叶中都表达,MtZIP3 和MtZIP4在根和叶中表现为诱导表达,而MtZIP6和 MtZIP7没有显著变化。本研究中NoZIP1蛋白表达结果显示,在缺营养素的条件下,NoZIP1在根部与叶部均受诱导表达,但表达情况具有一定差异。根部和叶部NoZIP1的表达趋势基本都是先下降后上升,可能是植物对初遇不良环境表现出的应答机制。缺营养素条件下,植物生长生理受到影响,基因表达降低。之后启动自身防御机制,表达一些基因对抗不利条件,因此出现先降后升的趋势。但植物根部和叶部出现这样趋势的时间有一定差
异,根部NoZIP1基因表达量下降得更为显著,尤其在双缺或缺铁的条件下。为对抗此两种不利条件,诱导锌铁转运蛋白基因的表达所需时间也要稍长,表现为其他缺营养素条件下都是第2天表达量开始上升且达到最大值,双缺和缺铁条件下,此变化出现在第3天。而缺锌或50%缺铁条件对植物的胁迫压力较双缺和缺铁稍小,因此植物对抗不利条件诱导锌铁转运蛋白基因的表达所需的时间也相对较短。后期即第4天开始植物整体的生长生理代谢受损,导致整体基因表达量出现下降。叶部对缺锌铁的胁迫反应响应速度较根部稍慢,表现在胁迫导致的基因表达量下降的较为缓慢。由于胁迫信号需从根部传递上来,因此叶部的响应速度比根部慢,对抗不利条件诱导基因表达也出现得比根部慢。
[1]Li S,Zhou X,Li H,et al. Overexpression of ZmIRT1 and ZmZIP3 enhances iron and zinc accumulation in transgenic arabidopsis[J]. Plos One,2015,10(8):1-21.
[2]Astudillo C,Fernandez A C,Blair M W,et al. The Phaseolus vulgaris ZIP gene family:identification,characterization,mapping,and gene expression[J]. Frontiers in Plant Science,2012,4(4):286-286.
[3]杨霞. 两个水稻金属离子转运体基因和两个水稻锌指蛋白基因的克隆与功能研究[D]. 南京:南京农业大学,2007.
[4]李素贞,陈景堂. 植物锌铁转运相关蛋白家族的研究进展[J]. 生物技术通报,2013(2):15-19.
[5]Tan S,Han R,Li P,et al. Over-expression of the Mx IRT1,gene increases iron and zinc content in rice seeds[J]. Transgenic Research,2015,24 (1):109-122.
[6]Xing F,Xing-Zheng FU,Wang N Q,et al. Physiological changes and expression characteristics of ZIP family genes under zinc def iciency in navel orange(Citrus sinensis)[J]. Journal of Integrative Agriculture,2016,15(4):803-811.
[7]Grotz N,Guerinot M L. Molecular aspects of Cu,Fe and Zn homeostasis in plants[J]. Biochimica Et Biophysica Acta Molecular Cell Research,2006,1763(7):595–608.
[8]Ishimaru Y,Bashir K,Nishizawa N K. Zn Uptake and Translocation in Rice Plants[J]. Rice,2011,4(1):21-27.
[9]Plaza S,Tearall K L,Zhao F J,et al. Expression and functional analysis of metal transporter genes in two contrasting ecotypes of the hyperaccumulator Thlaspi caerulescens[J]. Journal of Experimental Botany,2007,58(7):1717-1728.
[10]Milner M J,Seamon J,Craft E,et al. Transport properties of members of the ZIP family in plants and their role in Zn and Mn homeostasis[J]. Journal of Experimental Botany,2013,64(1):369-381.
[11]Bughio N,Yamaguchi H,Nishizawa N K,et al. Cloning an iron-regulated metal transporter from rice[J]. Journal of Experimental Botany,2002,53(374):1677-1682.
[12]Moreau S,Thomson R M,Kaiser B N,et al. GmZIP1 encodes a symbiosis-specific zinc transporter in soybean[J]. Journal of Biological Chemistry,2002,277(7):4738-4746.
[13]刘海军. 玉米锌铁转运蛋白基因ZmZIP4cDNA的克隆及表达分析[D]. 保定:河北农业大学,2011.
[14]Eckhardt U,Mas Marques A,Buckhout T J. Two iron regulated cation transporters from tomato complement metal uptake-deficient yeast mutants [J]. Plant Mol Biol,2001,45(4):437-448.
[15]Li S Z,Zhou X J,Huang Y Q,et al. Identification and characterization of thezinc-regulated transporters,iron-regulated transporter-like protein(ZIP)gene family in maize[J]. BMC Plant Bio,2013,13(1):114-128.
[16]巩元勇,郭书巧,束红梅,等. 棉花GhZIP4基因的克隆及表达分析[J]. 西北植物学报,2013, 33(1):27-33.
[17]Lópezmillán A F,Ellis D R,Grusak M A. Identification and characterization of several new members of the ZIP family of metal ion transporters in Medicago truncatula[J]. Plant Molecular Biology,2004,54(4):583-96.
[18]宋关玲. 铜和镉对水体修复植物西洋菜的生理影响[J]. 东北林业大学学报,2008,36(2):42-44.
[19]Rui M S C,Vieira M C,Silva C L M. Effect of heat and thermosonication treatments on peroxidase inactivation kinetics in watercress(Nasturtium officinale)[J]. Journal of Food Engineering,2006,72(1):8-15.
[20]Voutsina N,Payne A C,Hancock R D,et al. Characterization of the watercress(Nasturtium officinale R. Br.; Brassicaceae)transcriptome using RNASeq and identification of candidate genes for important phytonutrient traits linked to human health[J]. BMC Genomics,2016,17 (1):1-15.
[21]何江,利锋,诸振兵,等. 西洋菜净化养猪废水研究[J]. 安徽农业科学,2009,37(23):11115-11116.
[22]Li S,Zhou X,Zhao Y,et al. Constitutive expression of the ZmZIP7 in Arabidopsis alters metal homeostasis and increases Fe and Zn content[J]. Plant Physiology & Biochemistry Ppb,2016,106:1-10.
[23]傅明辉,陈肖丽. 植物锌铁转运蛋白ZIP家族的生物信息学分析[J]. 广东农业科学,2015,42 (1):124-128.
[24]秦海宏,王福俤,郭俊生. 锌铁调控蛋白ZIP的结构和功能[J]. 卫生研究,2003,32(3):261-264.
[25]蒲琦,李素贞,李盼. 植物锌铁转运蛋白ZIP基因家族的研究进展[J]. 生物技术通报,2012,28(10):15-19.
[26]Nishida S,Tsuzuki C,Kato A,et al. AtIRT1,the primary iron uptake transporter in the root,mediates excess nickel accumulationin Arabidopsis thaliana[J]. Plant and Cell Physiology,2011,52(8):1433-1442.
[27]Sinclair S A,Krämer U. The zinc homeostasis network of land plants[J]. Biochimica Et Biophysica Acta,2012,1823(9):1553-1567.
[28]Gainza-Cortés F,Pérez-Dïaz R,Pérez-Castro R,et al. Characterization of a putative grapevine Zn transporter,VvZIP3,suggests its involvement in early reproductive development in Vitis vinifera L[J]. BMC Plant Biology,2012,12(1):1-13.
[29]Kramer U,Talke I N,Hanikenne M. Transition metal transport[J]. FEBS Lett,2007,581(12):2263-2272.
[30]Ramesh S A,Schachtman D P. Differential metal selectivity and gene expression of two zinc transporters from rice[J]. Plant Physiology,2003,133(1):126-134.
[31]Yang X,Huang J,Jiang Y,et al. Cloning and functional identification of two members of the ZIP(Zrt,Irt-like protein)gene family in rice (Oryza sativa L.)[J]. Molecular Biology Reports,2009,36(2):281-287.
(责任编辑 崔建勋)
Cloning and expression analysis of NoZIP1 gene in Nasturtium officinale R. Br.
ZHANG Qiu-ling,LU Xiao-dan,ZHONG Yan-shan,FU Ming-hui
(School of Chemical Engineering and Light Industry, Guangdong University of Technology,Guangzhou 510000,China)
To contribute to the further functional determination of the gene involving growth and development of Nasturtium officinale R. Br.,ZIP1 gene was cloned according to homologous gene conserved region by RACE method. Its sequences and expression characters were examined by bioinformatics and real-time PCR,respectively. The full-length cDNA was 1 239 bp and it encoded a polypeptide of 356 amino acids with an entire ORF. It had high similarity to ZIP proteins of other plants. By real-time PCR approach,it was found that the expression of NoZIP1 was significantly induced both in roots and shoots by zinc-deficiency or iron-deficiency.
Nasturtium officinale R.Br.;ZIP (Zrt,Irt like Protein);RACE;real-time PCR
Q786
A
1004-874X(2017)02-0039-10
2016-12-05
国家自然科学基金(21177029);广东省科技计划项目(2016A010105020)
张秋玲(1992-),女,在读硕士生,E-mail:qiuling92@163.com
傅明辉(1967-),女,博士,教授,E-mail:mhfugd@126.com
张秋玲,卢晓丹,钟燕珊,等. 西洋菜锌铁转运蛋白NoZIP1基因的克隆及表达研究[J].广东农业科学,2017,44 (2):39-48.
