葡萄籽低聚原花青素体外抗氧化活性研究
2017-04-27梁红敏高德艳胡文效
梁红敏,高德艳,胡文效*
(山东省葡萄研究院,山东济南250100)
葡萄籽低聚原花青素体外抗氧化活性研究
梁红敏,高德艳,胡文效*
(山东省葡萄研究院,山东济南250100)
以实验室分离纯化得到的葡萄籽低聚原花青素为研究对象,水溶性维生素E和维生素C为对照,分别考察葡萄籽低聚原花青素对DPPH自由基、ABTS自由基、超氧阴离子自由基(O2-·)的清除能力以及铁离子还原能力(FRAP)。结果表明,葡萄籽低聚原花青素对DPPH自由基、ABTS自由基以及超氧阴离子自由基具有较高的清除能力,IC50值分别为23.52 μg/mL、51.38 μg/mL和684.46 μg/mL,具有较高的还原能力,且均优于对照水溶性维生素E。与维生素C相比,原花青素对ABTS自由基的清除能力以及还原能力均优于维生素C,两者DPPH自由基的清除能力相当,原花青素和水溶性维生素E在极低质量浓度(0.05~1.00 μg/mL)范围内,对超氧自由基具有清除能力,清除率为30%~40%,随着质量浓度的增加,维生素C的超氧阴离子自由基清除能力优于葡萄籽低聚原花青素。
葡萄籽低聚原花青素;还原力;自由基;抗氧化活性
近年来,国内以葡萄籽原花青素为原料的保健食品和膳食营养补充剂越来越多,但是由于还没有相应的国家和行业标准,各原料生产企业按照各自的企业标准生产,导致了现在市场上原料和产品质量的差异,而原花青素的生产应该以较高活性的组分为主,以提高产品质量,扩大其应用范围。
葡萄籽提取物中原花青素含量达95%[1]。原花青素具有较强的抗氧化作用和清除自由基的能力[2-3],其活性受结构特别是聚合度的影响,不同聚合度原花青素的抗氧化活性不同,大量研究证实,随着原花青素聚合度的增加,其抗氧化活性和对羟自由基和超氧阴离子自由基清除能力逐渐降低[4-7],低聚原花青素(oligomeric proanthocyanidins,OPC)具有更强的抗氧化活性[8-10]。
目前有关原花青素的抗氧化活性研究较多,抗氧化能力大小表示方法各异[11]。水溶性维生素E在国外常被用作测算抗氧化能力的标准物质,维生素C(vitamine C,VC)具有较强的抗氧化活性,本研究通过建立体外抗氧化模型,采用不同抗氧化活性测定方法探讨低聚原花青素的体外抗氧化活性,并与Trolox和VC进行对比,以期为葡萄籽低聚原花青素的开发应用提高理论依据。
1 材料与方法
1.1 材料与试剂
葡萄籽(公酿一号):山东日照。
1,1-二苯-1-苦基苯肼(1,1-dipheny1-2-picryhydrazyl,DPPH)自由基、2,2-氨基-二(3-乙基-苯并噻唑啉-6-磺酸)(2,2-azino-bis-(3-ethylbmzothiazoline-sulfonic,ABTS)自由基、Fe3+-三吡啶三吖嗪(tripyridyltriazine,TPTZ)、6-羟基-2, 5,7,8-四甲基苯并二氢吡喃-2-羧酸(6-hydroxy-2,5,7,8-tetram-ethylchroman-2-carboxylicacid,Trolox),水溶性维生素E(均为分析纯):美国Sigma公司;维生素C、邻菲啰啉、磷酸氢二钠、磷酸二氢钠、三氯化铁、无水乙醇、浓盐酸、冰醋酸、焦性没食子酸等均为国产分析纯。
1.2 仪器与设备
EL204型电子天平:梅特勒-托利多仪器上海有限公司;UV5200紫外可见分光光度计:上海元析仪器有限公司;DGG-9140B型电热恒温鼓风干燥箱:上海森信仪器有限公司;HH-S4型电热恒温水浴锅:广东环凯仪器有限公司。
1.3 方法
1.3.1 葡萄籽低聚原花青素的提取分离
称取一定量干燥的葡萄籽,粉碎至60目过筛,采用乙醇进行提取,提取条件为料液比1∶8(g∶mL),乙醇体积分数70%,提取温度70℃,提取时间为2 h,提取3次。采用HPD100大孔树脂作为原花青素的纯化树脂,原花青素含量为8.0 mg/mL的提取液进行吸附,吸附流速为3 BV/h,蒸馏水以2 BV/h流速逆向冲洗树脂柱,以去除树脂间隙中未吸附的原花青素及杂质组分,冲洗至流出液检测不到原花青素为止,吸附完毕后分别采用体积分数10%、20%、30%、40%、45%的乙醇溶液进行洗脱,随着乙醇体积分数的增加,洗脱液中原花青素的聚合度不断增加,低聚合度组分优先洗脱,当乙醇体积分数增加至45%左右时,洗脱液中原花青素聚合度>5。将聚合度<5的组分进行合并,低温浓缩、干燥得高纯度低聚体原花青素。
1.3.2 清除DPPH自由基法测定抗氧化能力
参考ESPÍN J C等[12]的方法,用无水乙醇溶解DPPH自由基,配制成浓度为1×10-4mmol/L的DPPH溶液。取不同质量浓度(10μg/mL、20μg/mL、30μg/mL、40μg/mL、50μg/mL、60 μg/mL、70 μg/mL、80 μg/mL、100 μg/mL)的葡萄籽低聚原花青素0.5mL分别加入3.5mLDPPH乙醇溶液中,避光反应2 h,以乙醇溶剂作空白对照,测量其在波长517 nm处的吸光度值(Ai)。取0.5 mL无水乙醇与3.5 mL DPPH反应,避光反应2 h,波长517 nm处测吸光度值(A0),按照下列公式计算自由基清除率。以Trolox和VC为对照,分别用无水乙醇和纯水配制成上述不同浓度的溶液进行测定。
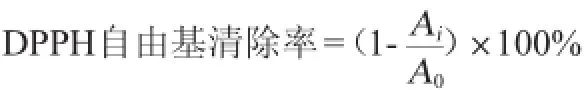
1.3.3 清除ABTS自由基法测定抗氧化能力
ABTS反应储备液的配制参考MARFIL R等[13]的方法。使用时用无水乙醇将其稀释至吸光度值为0.7±0.02,取不同质量浓度(10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL、80 μg/mL、100 μg/mL)的葡萄籽低聚原花青素200 μL分别加入6.0 mL ABTS工作液中,避光反应30 min,以乙醇溶剂作空白对照,测量其在波长734 nm处的吸光度值(Ai)。取200 μL无水乙醇与6.0 mL ABTS反应,避光反应30 min,波长734 nm处测吸光度值(A0),按照下列公式计算自由基清除率。以Trolox和VC为对照,分别用无水乙醇和纯水配制成上述不同浓度的溶液进行测定。

1.3.4 铁离子还原能力法测定抗氧化能力
参考SZYDŁOWSKA-CZERNIAK A等[14]的方法,取不同质量浓度(10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL、60 μg/mL、70 μg/mL、80 μg/mL、100 μg/mL)的葡萄籽低聚原花青素200μL,分别加入4.0 mLTPTZ工作液(由0.1 mol/L醋酸盐缓冲液25 mL,10 mmol/L TPTZ溶液2.5 mL,20 mmol/L FeCl3溶液2.5 mL组成)。混匀后37℃反应10 min,波长593 nm处测定吸光度值。分别用无水乙醇和纯水配制成上述不同浓度的溶液进行测定。
1.3.5 清除超氧阴离子自由基法测定抗氧化能力
参考郭雪峰等[15]的方法,采用邻苯三酚自氧化法测定。Tris-HCl缓冲液(50 mmol/L,pH值8.2,(4.5 mL)与纯水(3.3 mL)混合,25℃孵育20 min,快速加入不同质量浓度的葡萄籽低聚原花青素0.9 mL,0.3 mL邻苯三酚溶液(3 mmol/L,用10 mmol/L盐酸配制,经25℃预热),混匀后记录5 min内反应溶液在波长320 nm处的吸光度变化,绘制时间(t)-吸光度值(A)曲线,在线性范围内计算反应物单位时间内吸光度值的改变,得出受试物作用下邻苯三酚的自氧化速率。以Trolox和VC为对照,分别用无水乙醇和纯水配制成上述不同浓度的溶液进行测定。

式中:V0为邻苯三酚的自氧化速率,ΔA320nm/min;V1为受试物作用下邻苯三酚的自氧化速率,ΔA320nm/min。
2 结果与分析
2.1 清除DPPH自由基的能力

图1 不同质量浓度葡萄籽低聚原花青素对DPPH自由基清除率的影响Fig.1 Effect of different concentration of oligomeric procyanidins on DPPH free radical scavenging capacity
由图1可知,在不同质量浓度(10~100 μg/mL)范围内,低聚原花青素对DPPH自由由基具有清除作用,随着原花青素质量浓度的增加,DPPH自由基的清除能力逐渐增强,在质量浓度(10~50 μg/mL)的范围内,原花青素不同质量浓度与清除率呈线性关系,线性方程为y= 1.5932x+12.529,R2=0.992,线性关系较好,计算低聚原花青素对DPPH自由基的半数清除率IC50值为(23.52 μg/mL)。当质量浓度为50 μg/mL时,对DPPH自由基的清除率达到90%以上,具有很好的清除DPPH自由基的活性。与Trolox和VC相比,三者对DPPH自由基的清除作用相近,在低浓度范围内(10~30 μg/mL),葡萄籽低聚原花青素比Trolox和VC的DPPH清除作用强。
2.2 清除ABTS自由基的能力

图2 不同质量浓度低聚原花青素对ABTS自由基清除率的影响Fig.2 Effect of different concentration of oligomeric procyanidins on ABTS free radical scavenging capacity
由图2可知,在不同质量浓度(10~100 μg/mL)范围内,低聚原花青素对ABTS自由由基具有清除作用,随着原花青素质量浓度的增加,清除能力逐渐增强,在质量浓度(10~80 μg/mL)的范围内,原花青素不同浓度与清除率呈线性关系,线性方程为y=0.811 9x+8.284 1,R2=0.993 5,计算原花青素对ABTS自由基的半数清除率IC50值为(51.38 μg/mL),当质量浓度为100 μg/mL时,清除率达到75%以上,具有很好的清除ABTS自由基的活性。与Trolox和VC相比,低聚原花青素对ABTS自由基的清除作用最强,其次是Trolox,VC的清除作用最弱。
2.3 铁离子还原能力测定
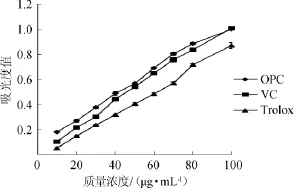
图3 不同质量浓度低聚原花青素的还原力Fig.3 Reduction capacity of different concentration of oligomeric procyanidins
由图3可知,在不同质量浓度(10~100 μg/mL)范围内,低聚原花青素具有还原力,随着原花青素质量浓度的增加,还原能力逐渐增强,原花青素不同浓度与吸光度值呈线性关系,线性方程为y=0.010 3x+0.070 2,R2=0.998 3,线性关系较好。与Trolox和VC相比,低聚原花青素的还原能力最强,其次是VC,Trolox的还原能力最弱。
2.4 清除超氧阴离子自由基的能力

图4 不同质量浓度低聚原花青素对超氧阴离子自由基清除率的影响Fig.4 Effect of different concentration of oligomeric procyanidins on superoxide anion free radical scavenging capacity
由图4可知,在低质量浓度(0.05~1.00 μg/mL)范围内,低聚原花青素与Trolox对超氧阴离子自由基具有清除作用,随着质量浓度的增加,清除能力也逐渐增强但是变化不大,清除率为30%~40%,且原花青素的清除能力强于Trolox,在此浓度范围内VC的清除能力很弱,几乎没有清除能力;在质量浓度5~100 μg/mL范围内,低聚原花青素与Trolox对超氧阴离子自由基的清除能力随质量浓度的增加逐渐增强但是变化不大,而VC的清除能力随质量浓度的增加逐渐增强,在质量浓度为50 μg/mL时,清除率达到87%;在质量浓度(500~7 000 μg/mL)范围内,低聚原花青素与Trolox对超氧阴离子自由基的清除能力随质量浓度的增加逐渐增强且变化较大,而VC的清除能力为100%;低聚原花青素在质量浓度>4 000 μg/mL时,使用乙醇溶解时,不能完全溶解,因此对于低聚原花青素,其质量浓度最高选择4 000 μg/mL,在500~4 000 μg/mL的质量浓度范围内,原花青素不同质量浓度与清除率呈线性关系,线性方程为y=0.0065x+45.551,R2=0.9843,线性关系较好,计算原花青素对超氧阴离子自由基的半数清除率IC50值为684.46 μg/mL。
3 结论
本实验采用多种体外抗氧化能力测定方法,以Trolox、VC为阳性对照评价葡萄籽低聚原花青素的抗氧化活性。结果表明,葡萄籽低聚原花青素对DPPH自由基、ABTS自由基以及超氧阴离子自由基具有较高的清除能力,IC50值分别为23.52 μg/mL、51.38 μg/mL和684.46 μg/mL,具有较高的还原能力,且均优于对照Trolox。与VC相比,原花青素对ABTS自由基清除能力以及还原能力优于VC,两者DPPH自由基的清除能力相当,原花青素和Trolox在低浓度(0.05~1.00 μg/mL)范围内,对超氧阴离子自由基具有清除能力,清除率为30%~40%,随着质量浓度的增加,VC的超氧自由基清除能力优于葡萄籽低聚原花青素。
[1]国植,徐莉.原花青素具有广阔发展前景的植物药用[M].国外医药植物分册,1996(2):203-20.
[2]高峰,张琨,宋昕恬,等.葡萄籽提取物抗氧化作用人体实验研究[J].中国卫生工程学,2010,17(4):757-759.
[3]格日勒,亓伟,刘淑娟.原花青HPLC测定方法研究进展[J].中国酿造,2014,33(6):6-9.
[4]赵丹,曾新安,徐中岳.不同聚合度葡萄皮原花青素的抗氧化活性[J].食品与发酵工业,2012,38(4):104-107.
[5]FRACASSETTI D,COSTA C,MOULAY L,et al.Ellagic acid derivatives,ellagitannins,proanthocyanidins and other phenolics,vitamin C and antioxidant capacity of two powder products from camucamu fruit (Myrciaria dubia)[J].Food Chem,2013,139(1/4):578-583.
[6]LIU Z Q,YANG Q L,ZHANG Y,et al.Study on antioxidant activity of proanthocyanidins from peanut skin[J].Adv Mat Res,2011,197/198(1): 1582-1586.
[7]BAGCHI D,GARG A,KROHN R L,et al.Oxygen free radical scavenging abilities of VC and VE,and a grape seed proanthocyanidinsextractin vitro[J].Res Comm Mol Pathol Pharmacol,1997,95(2):179-189.
[8]WOOD J E,SENTHILMOHAN S T,PESKIN A V.Antioxidant activity of procyanidin containing plant extracts at different pH[J].Food Chem, 2002,77(2):155-161.
[9]高羽,董志.原花青素的药理学研究现状[J].中国中药杂志,2009,34(6):651-655.
[10]FULEKI T,SILVA J M R D.Catechin and procyanidin composition of seeds from grape cultivate grown in ontario[J].J Agric Food Chem, 1997,(45):1156-1160.
[11]熊伟,曾梅花,韩晓丹.茶壳中原花青素的抗氧化活性研究[J].生物化工,2016,2(4):1-15.
[12]ESPÍN J C,SOLER-RIVAS C,WICHERS H J.Characterization of the total free radical scavenger capacity of vegetable oils and oil fractions using 2,2-diphenyl-1-picrylhydrazyl radical[J].J Agric Food Chem, 2000,8(3):648-656.
[13]MARFIL R,GIMÉNEZ R,MARTÍNEZ O,et al.Determination of polyphenols,tocopherols,and antioxidant capacity in virgin argan oil (Argania spinosa,Skeels)[J].Eur J Lipid Sci Technol,2011,113(7): 886-893.
[14]SZYDŁOWSKA-CZERNIAKA,KARLOVITS G,DIANOCZKI C,et al. Comparison of two analytical methods for assessing antioxidant capacity ofrapeseedandoliveoils[J].J Am Oil Chem Soc,2008,85(2):141-149. [15]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
In vitroantioxidant capacity of grape seed oligomeric procyanidins
LIANG Hongmin,GAO Deyan,HU Wenxiao*
(Shandong Academy of Grape,Jinan 250100,China)
Using grape seed oligomeric procyanidins isolated and purified from laboratory as research object,vitamin E and vitamin C as control,the effect of grape seed oligomeric proanthocyanidins on the scavenging capacity of DPPH free radical,ABTS free radical,superoxide anion free radical and ferric ion reducing antioxidant power(FRAP)was investigated.The results showed that grape seed oligomeric procyanidins had higher scavenging capacity against DPPH free radical,ABTS free radical and superoxide anion radical,with IC50value of 23.52 μg/ml,51.38 μg/ml and 684.46 μg/ml, respectively,and they were all higher than vitamin E.Comparing with vitamin C,the scavenging capacity of ABTS free radical and reducing power of procyanidins was better than that of vitamin C,and the scavenging capacity of DPPH free radical were equivalent.At very low concentration (0.05-1.00 μg/ml),procyanidins and vitamin E had scavenging ability against superoxide anion radicals,and the scavenging rate was 30%-40%. With the increase of concentration,the scavenging capacity of vitamin C against superoxide anion free radical was better than that of grape seed oligomeric procyanidins.
grape seed oligomeric procyanidins;reducing power;free radical;antioxidant capacity
R285.3
0254-5071(2017)04-0149-04
10.11882/j.issn.0254-5071.2017.04.031
2017-01-18
山东省农业科学院农业科技创新工程(CXGC2016D01)
梁红敏(1987-),女,助理工程师,硕士,研究方向为生物活性成分活性评价、分离与应用开发。
*通讯作者:胡文效(1964-),男,研究员,本科,研究方向为生物化工专业生物分离。
