一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价
2017-04-27孟丹王丽群谢国梁刘晓艳于纯淼国立东
孟丹,王丽群,谢国梁,刘晓艳,于纯淼,国立东*
(1.黑龙江中医药大学药学院,黑龙江哈尔滨150040;2.黑龙江省农业科学院食品加工研究所,黑龙江哈尔滨150086)
一株乳酸乳球菌产γ-氨基丁酸能力及其安全性评价
孟丹1,王丽群2,谢国梁1,刘晓艳1,于纯淼1,国立东1*
(1.黑龙江中医药大学药学院,黑龙江哈尔滨150040;2.黑龙江省农业科学院食品加工研究所,黑龙江哈尔滨150086)
探讨了乳酸乳球菌乳亚种HUCM 201产γ-氨基丁酸的能力,并初步评价了其安全性。以γ-氨基丁酸含量为评价指标,通过正交试验优化了乳酸乳球菌乳亚种HUCM 201菌株产γ-氨基丁酸的发酵条件,即接种量为4%、初始pH值6.5,发酵温度31℃,发酵时间60 h,其发酵液中γ-氨基丁酸的质量浓度可达218.7 μg/mL。通过硝基还原酶活性检测、生物胺产生能力分析、吲哚试验和溶血性试验,初步评价了菌株HUCM 201的安全性,发现其硝基还原酶阴性,吲哚试验阴性,无溶血,不能产生酪胺、组胺、尸胺和腐胺生物胺类物质,可初步认为是一株安全的益生菌。
乳酸菌;γ-氨基丁酸;生物胺;安全性
乳酸菌是一类能利用可发酵糖产生大量乳酸的细菌的通称[1],其作为工业微生物应用具有悠久的历史,广泛用于酸奶、开菲尔、泡菜等传统发酵食品的生产。继“酸奶长寿说”提出之后,乳酸菌对人体健康的有益作用一直是人们关注的焦点,目前公认的益生功能主要包括:调节肠道菌群平衡[2]、调节免疫[3]、降胆固醇[4]、降血压[5]、降血糖[6]、抗肿瘤[7-8]、抗过敏[9]等。然而,这些益生功能并不是所有乳酸菌的共性,不同种属的乳酸菌甚至是同一种属的不同株之间益生功能也不尽相同,但也有集两种以上益生功能于一身的乳酸菌菌株,如鼠李糖乳杆菌GG株(LGG)[10-11]。课题组先前从传统发酵乳制品—开菲尔发酵乳中分离到一株乳酸乳球菌乳亚种HUCM 201菌株,益生特性良好[12]且体内外试验均证实了其降胆固醇作用[13-14]。菌株HUCM 201是否还具有其他益生功能仍不清楚,另外,尽管乳酸菌通常被认为是安全的,但仍有个别关于乳酸菌引起感染事件的报道[15-17]。鉴于此,本试验对乳酸乳球菌乳亚种菌株HUCM 201产γ-氨基丁酸(γ-aminobutyric acid,GABA)的能力进行了检测,并对其安全性进行了初步评价,包括硝基还原酶活性、生物胺产生能力、吲哚生成以及溶血性试验,旨在为其作为益生菌应用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
乳酸乳球菌乳亚种(Lactococcus lactissubsp.lactis)HUCM 201菌株:来源于开菲尔发酵乳,实验室自行分离鉴定并保存。大肠杆菌(Escherichia coli)ATCC 25922和金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923为黑龙江中医药大学实验室保存。
1.1.2 培养基
改良MRS(mMRS)培养基,参照文献[18]的方法配制:蛋白胨5.0 g,胰蛋白胨10.0 g,酵母粉5.0 g,牛肉膏5.0 g,葡萄糖20.0g,吐温-801.0g,乙酸钠5.0g,七水硫酸镁0.58g,四水硫酸锰0.25 g,柠檬酸氢二铵2.0 g,磷酸氢二钾2.0 g,蒸馏水加至1 L,用HCl调至pH 6.2,121℃湿热灭菌15 min。
LB培养(基用于培养大肠杆菌):胰蛋白胨10.0 g,酵母粉5.0 g,氯化钠10.0 g,蒸馏水加至1 L,调pH值至7.4,121℃湿热灭菌15 min。
胰蛋白胨大豆肉汤(tryptonesoybroth,TSB)培养基(用于培养金黄色葡萄球菌):胰蛋白胨17.0g,大豆蛋白胨3.0g,葡萄糖2.5 g,氯化钠5.0 g,磷酸氢二钾2.5 g,蒸馏水加至1 L,调pH值至pH 7.2±0.2,121℃湿热灭菌15 min。
胰蛋白胨酵母膏葡萄糖(tryptone yeast glucose,TYG)液体培养基(用于发酵培养)参照文献[19]配制:胰蛋白胨5.0 g,酵母粉5.0 g,葡萄糖5.0 g,丁二酸钠5.0 g,蒸馏水加至1 L,HCl调至pH 6.8,121℃湿热灭菌15 min。
硝基还原酶活性检测培养基(用于检测乳酸菌的硝基还原酶活性):蛋白胨10.0 g,硝酸钾1.0 g,加蒸馏水至1 L,pH值调至pH 7.4,121℃灭菌15 min。
氨基酸脱羧酶检测培养基(用于检测乳酸菌是否产生生物胺):胰蛋白胨5.0 g,酵母粉5.0 g,氯化钠0.25 g,葡萄糖0.5 g,硫酸镁0.2 g,硫酸锰2.0 g,硫酸亚铁0.04 g,柠檬酸铵2 g,维生素B1 0.01g,磷酸氢二钾2.0 g,碳酸钙0.1 g,磷酸吡哆醛0.05 g,吐温-80 0.06 g,溴甲酚紫0.06 g,蒸馏水加至1 L,调至pH 5.8~6.0,121℃湿热灭菌15 min。
酪胺、组胺、尸胺或腐胺检测培养基,是在上述培养基中分别添加10.0g的酪氨酸、组氨酸、赖氨酸或鸟氨酸。
1.1.3 试剂
γ-氨基丁酸(GABA)标准品:美国Sigma公司;L-谷氨酸:国药集团化学试剂有限公司;哥伦比亚血琼脂培养基:贝瑞特生物技术有限责任公司;三乙胺、正己烷、乙腈(均为色谱纯):德国Merck公司;其他试剂均为国产分析纯。
1.2 仪器与设备
1260高效液相色谱(highperformanceliquidchromatography,HPLC)仪:安捷伦(中国)科技有限公司;AE200分析天平:梅特勒-托利多仪器上海有限公司;DM2500显微镜:上海徕卡显微镜有限公司;SPX-200-II生化培养箱:上海跃进医疗器械厂;SW-CJ-2D超净工作台:苏州净化设备有限公司;BXM-30R全自动高压灭菌锅:上海博讯实业有限公司;PB-10 pH计:赛多利斯科学仪器北京有限公司;TGL-20bR离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 菌株的培养
乳酸乳球菌乳亚种HUCM 201菌株,在37℃条件下培养于mMRS培养基中。试验前用mMRS液体培养基至少活化3次。大肠杆菌培养在LB培养基中,金黄色葡萄球菌培养在TSB培养基中,均采用37℃恒温培养。
1.3.2 产γ-氨基丁酸乳酸菌发酵液的制备
将活化后的乳酸乳球菌乳亚种HUCM 201菌株按1%接种量接种于含1%谷氨酸的TYG液体培养基中,37℃静置培养48 h,将发酵液离心后取上清液,经0.22 μm滤膜过滤后得无菌上清液,供HPLC检测分析。
(1)单因素试验条件优化
分别考察不同发酵时间(24 h、36 h、48 h、60 h、72 h)、初始pH值(pH 5.0、5.5、6.0、6.5、7.0)、发酵温度(28℃、31℃、34℃、37℃、40℃)以及接种量(1%、2%、3%、4%、5%)对乳酸菌发酵液中GABA积累量的影响。
(2)正交试验条件优化
在单因素试验的基础上,选取发酵时间、发酵温度、初始pH值和接种量为影响因素,以GABA含量为评价指标,采用L9(34)正交设计优化,试验因素与水平见表1。

表1 发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization
1.3.3 乳酸菌发酵液γ-氨基丁酸的检测
(1)高效液相色谱条件
色谱柱采用Syncronis-C18柱(4.6 mm×250 mm,5 μm);流动相A为50 mmol/L醋酸钠(pH 6.5)-5%乙腈溶液,流动相B为80%乙腈溶液,流速1.0 mL/min,柱温为35℃进行梯度洗脱,洗脱梯度程序见表2;检测器为紫外检测器,检测波长为254 nm,进样量10 μL。

表2 分离γ-氨基丁酸梯度洗脱程序Table 2 Gradient elution program for γ-aminobutyric acid separation
(2)衍生化处理
取标准品溶液或供试无菌上清液200 μL,加入3 mol/L三乙胺乙腈溶液100 μL、0.1 mol/L异硫氰酸苯酯乙腈溶液100 μL,混匀,室温放置1 h,加入400 μL正己烷充分混匀,静置10 min,取下层溶液,再次加入400 μL正己烷,充分混匀,静置10 min。吸取下层溶液,经0.45 μm滤膜过滤,取20 μL样品进样进行色谱分析。
1.3.4 硝基还原酶活性检测
供试菌株按1%接种量接种于硝基还原酶检测培养基中,37℃恒温培养72 h,依次向发酵培养液中加入α-萘胺溶液和对氨基苯甲磺酸溶液,观察培养基颜色的变化。大肠杆菌ATCC 25922为阳性对照菌株。未接种细菌的硝基还原酶检测培养基为空白对照。
1.3.5 生物胺产生能力检测
供试菌株接种于含0.1%氨基酸(酪氨酸、组氨酸、赖氨酸或鸟氨酸)和0.005%的5′-磷酸吡哆醛的MRS液体培养基中,37℃静置培养48 h,连续转接10代,分别划线于酪胺、组胺、尸胺、腐胺检测培养基,37℃培养72 h后观察菌落周围培养基颜色的变化。同空白培养基相比,若培养基呈黄色则为阴性结果;若培养基呈红色或紫色则为阳性结果。
1.3.6 吲哚试验
供试菌株接种于蛋白胨水培养基中,37℃恒温培养72 h,加入吲哚试剂8~10滴观察颜色变化。若液面出现玫瑰红色则为阳性结果,否则为阴性结果。大肠杆菌ATCC 25922为阳性对照菌株。未接种细菌的蛋白胨水培养基为空白对照。
1.3.7 溶血试验
供试菌株划线接种于含质量浓度5 g/100 mL人体血液的哥伦比亚琼脂平板上,37℃培养48 h,观察菌落周围变化情况。若菌落周围形成透明圈则为β-溶血;若出现绿色圈,则为α-溶血;若无溶血环,则为γ-溶血,也称无溶血。以金黄色葡萄球菌ATCC 25923为阳性参照菌株。
2 结果与分析
2.1 菌株HUCM 201发酵液中GABA的定量分析
乳酸乳球菌乳亚种HUCM 201菌株培养于含1%谷氨酸的TYG培养基中,培养48 h后,采用柱前衍生化高效液相色谱方法对发酵液中GABA含量进行测定,GABA标准品及菌株发酵液的高效液相色谱图如图1所示。

图1 γ-氨基丁酸标准品(A)以及发酵液(B)的高效液相色谱图Fig.1 HPLC chromatogram of γ-aminobutyric acid standard(A)and fermentation broth(B)
从图1可知,发酵液中GABA与其他杂质通过该方法可有效分开,GABA的保留时间为16.0 min左右。通过外标法以峰面积定量可知,菌株HUCM 201在含1%谷氨酸的TYG液体培养基中37℃发酵48 h后,发酵液中GABA的质量浓度可达95.3 μg/mL。
2.2 菌株HUCM 201产GABA条件优化单因素试验
2.2.1 发酵时间对GABA产量的影响
菌株HUCM 201按1%接种量接种于含1%谷氨酸的TYG液体培养基中,37℃静置培养,于不同时间点取发酵液,并经处理后供HPLC检测GABA含量,结果如图2所示。
由图2可知,GABA含量随发酵时间的增加呈上升趋势,菌株HUCM201发酵60 h后,发酵液中GABA累积量趋于平稳,60h时GABA含量为134.8μg/mL,72h时为138.7μg/mL,二者差异不显著。故最佳发酵时间为60 h。

图2 发酵时间对γ-氨基丁酸产量的影响Fig.2 Effect of fermentation time on γ-aminobutyric acid production
2.2.2 初始pH值对GABA产量的影响
菌株HUCM 201按1%接种量接种于不同初始pH值的含1%谷氨酸的TYG液体培养基中,37℃静置培养60 h,发酵液经处理后供HPLC检测GABA含量,结果如图3所示。
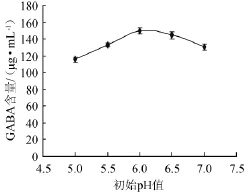
图3 初始pH值对γ-氨基丁酸产量的影响Fig.3 Effect of initial pH on γ-aminobutyric acid production
由图3可知,GABA含量随初始pH值的升高呈先上升后下降的趋势,在初始pH值为6.0时,发酵液中GABA累积量最大,达到149.4 μg/mL,故最佳初始pH值为6.0。
2.2.3 发酵温度对GABA产量的影响
菌株HUCM 201按1%接种量接种于含1%谷氨酸的TYG液体培养基(pH 6.0)中,不同温度下静置培养60 h,发酵液经处理后供HPLC检测GABA含量,结果如图4所示。
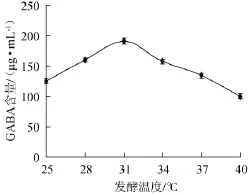
图4 发酵温度对γ-氨基丁酸产量的影响Fig.4 Effect of fermentation temperature on γ-aminobutyric acid production
由图4可知,随着培养温度的升高,GABA含量首先随之升高,培养温度为31℃时,菌株HUCM 201发酵液中GABA累积量最大,GABA含量达到191.2 μg/mL,发酵温度超过31℃后GABA产量出现明显下降。故最佳发酵温度为31℃。
2.2.4 接种量对GABA产量的影响
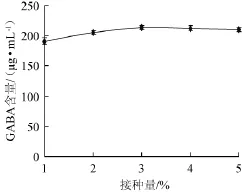
图5 接种量对γ-氨基丁酸产量的影响Fig.5 Effect of inoculum on γ-aminobutyric acid production
菌株HUCM 201按不同接种量接种于含1%谷氨酸的TYG液体培养基(pH 6.0)中,31℃静置培养60 h,发酵液经处理后供HPLC检测GABA含量,结果如图5所示。
由图5可知,接种量为3%时,菌株HUCM 201发酵液中GABA累积量最大,GABA含量达到213.4μg/mL,接种量超过3%后GABA产量无明显变化。故最佳接种量为3%。
2.3 发酵条件的优化正交试验
根据单因素条件优化结果,选择发酵时间、初始pH值、发酵温度、接种量4个因素,以GABA产量为评价指标,按照L9(34)正交表进行正交试验,优化结果如表3所示。
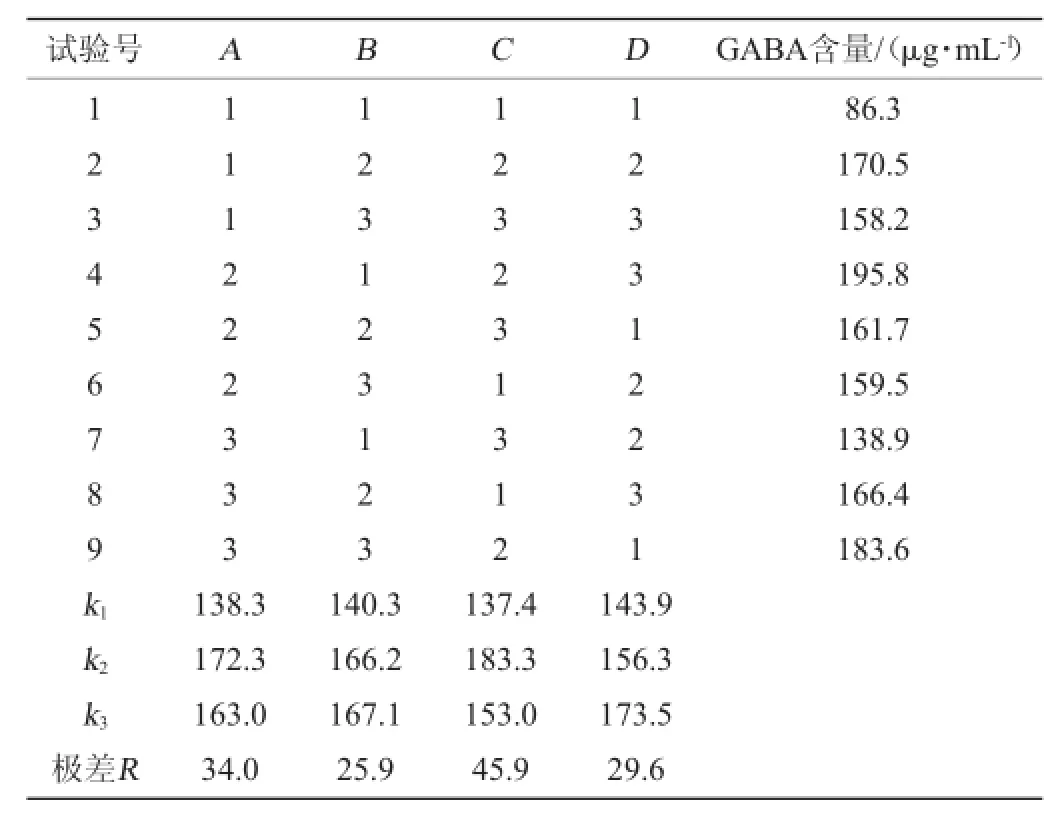
表3 发酵条件优化正交试验优化结果分析Table 3 Results and analysis of orthogonal experiments for fermentation conditions optimization
由表3结果可知,对GABA产量影响大小依次为发酵温度>发酵时间>接种量>初始pH值,最佳组合为A2B3C2D3,以此为最佳发酵条件进行发酵,即菌株HUCM 201按4%接种量接种于含1%谷氨酸的TYG液体培养基(pH 6.5)中,31℃培养60 h,GABA的产量达到218.7 μg/mL。
2.4 硝基还原酶活性检测结果

图6 硝基还原酶活性检测结果Fig.6 Determination results of nitroreductase activity
菌株的硝基还原酶活性检测结果如图6所示。由图6可知,接种大肠杆菌ATCC 25922的培养基颜色变成了红色,为阳性结果;而接种HUCM 201菌株的培养基颜色并未发生变化,其硝基还原酶活性试验结果呈阴性,说明菌株HUCM 201不能产生硝基还原酶,不会将环境中的硝酸盐还原为亚硝酸盐进而产生有害代谢物。
2.5 生物胺产生能力检测结果
生物胺产生能力的检测结果如图7所示。由图7可知,菌株HUCM201连续转接于含0.005%的5′-磷酸吡哆醛和0.1%酪氨酸、组氨酸、赖氨酸或鸟氨酸其中一种氨基酸的MRS液体培养基10代后,分别划线接种于酪胺、组胺、尸胺或腐胺检测培养基,经培养后,4种培养基均呈现为黄色,说明该菌株在生长过程中并未产生碱性物质而使培养基呈现紫色或红色,均为阴性结果。由此说明,菌株HUCM201在生长过程中并不会产生酪胺、组胺、尸胺或腐胺的有害代谢产物。
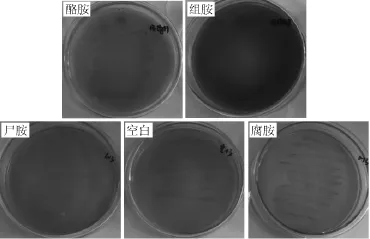
图7 菌株HUCM 201产生物胺的检测结果Fig.7 Determination results of biogenic amines production by strain HUCM 201
2.6 吲哚试验结果
供试菌株于37℃培养于蛋白胨水培养基中72h后,加入吲哚试剂检测吲哚产生情况,结果如图8所示。由图8可知,加入吲哚试剂后,大肠杆菌ATCC25922发酵液的液面出现玫瑰红色,呈阳性结果;而菌株HUCM 201发酵液的液面颜色未发生变化,为阴性结果。由此说明,菌株HUCM201在生长过程中不会代谢产生色氨酸酶分解蛋白胨中的色氨酸生成吲哚。

图8 吲哚试验结果Fig.8 Results of indole experiments
2.7 溶血试验结果
溶血试验结果如图9所示,供试菌株于哥伦比亚血琼脂平板上37℃培养48 h后,金黄色葡萄球菌ATCC 25923菌落周围出现了透明圈,发生了β-溶血,而菌株HUCM 201菌落周围无溶血环出现,为γ-溶血,即不溶血。由此说明,菌株HUCM 201无溶血能力,不会引起人体出现溶血。
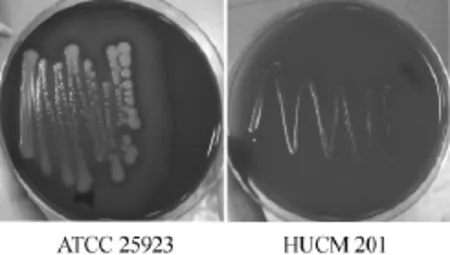
图9 溶血试验结果Fig.9 Results of haemolysis experiments
由上述硝基还原酶试验、生物胺产生能力检测、吲哚试验以及溶血试验的结果可知,菌株HUCM 201为硝基还原酶阴性、吲哚试验阴性、无溶血、不能产生酪胺、组胺、尸胺以及腐胺生物胺类有害代谢物,可初步判定其为一株安全的益生菌。
3 结论
乳酸乳球菌乳亚种HUCM 201菌株在其生长代谢过程中能产生重要的活性物质—γ-氨基丁酸,在单因素试验基础上,通过正交试验优化了其产GABA的发酵条件,菌株HUCM 201按4%接种量接种于含1%谷氨酸的TYG培养基(pH 6.5)中31℃发酵60 h,其发酵液中GABA的质量浓度可达218.7 μg/mL,并且该菌株不能代谢产生硝基还原酶,不能产生酪胺、组胺、尸胺或腐胺生物胺类有害代谢物,也不能利用色氨酸产生吲哚有害代谢物,不会引起人体血液发生溶血,可初步认为是一株较为安全的益生菌,但菌株HUCM 201作为益生菌应用前仍需做更为全面系统的安全性评价。
[1]凌代文,东秀珠.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:58-100.
[2]MADDEN J A,PLUMMER S F,TANG J,et al.Effect of probiotics on preventingdisruptionoftheintestinalmicroflorafollowingantibiotic therapy:A double-blind,placebo-controlled pilot study[J].Int Immunopharmacol,2005,5(6):1091-1097.
[3]VLASOVA A N,KANDASAMY S,CHATTHA K S,et al.Comparison of probiotic lactobacilli and bifidobacteria effects,immune responses and rotavirus vaccines and infection in different host species[J].Vet Immunol Immunopathol,2016,172:72-84.
[4]RAJKUMAR H,KUMAR M,DAS N,et al.Effect of probioticLacto-bacillussalivariusUBLS22andprebioticfructo-oligosaccharideonserum lipids,inflammatory markers,insulin sensitivity,and gut bacteria in healthyyoungvolunteers:arandomizedcontrolledsingle-blindpilotstudy [J].J Cardiovasc Pharmacol Ther,2015,20(3):289-298.
[5]GÓMEZ-GUZMÁN M,TORAL M,ROMERO M,et al.Antihypertensive effects of probioticsLactobacillusstrains in spontaneously hypertensive rats[J].Mol Nutr Food Res,2015,59,11:2326-2336.
[6]SUN J,BUYS N J.Glucose-and glycaemic factor-lowering effects of probiotics on diabetes:a meta-analysis of randomised placebo-controlled trials[J].Br J Nutr,2016,115(7):1167-1177.
[7]NAMI Y,ABDULLAH N,HAGHSHENAS B,et al.Assessment of probioticpotentialandanticanceractivityofnewlyisolated vaginal bacterium Lactobacillus plantarum5BL[J].Microbiol Immunol,2014,58(9):492-502.
[8]LI J,SUNG CY,LEE N,et al.Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J].Proc Natl Acad Sci USA,2016,113(9):E1306-E1315.
[9]WEST C E.Probiotics for allergy prevention[J].Benef Microbes,2016, 7(2):171-179.
[10]MEINI S,LAUREANO R,FANI L,et al.BreakthroughLactobacillus rhamnosusGG bacteremia associated with probiotic use in an adult patient with severe active ulcerative colitis:case report and review of the literature[J].Infection,2015,43(6):777-781.
[11]COSENZA L,NOCERINO R,DI SCALA C,et al.Bugs for atopy:the Lactobacillus rhamnosusGG strategy for food allergy prevention and treatment in children[J].Benef Microbes,2015,6(2):225-232.
[12]国立东,刘倩,江柳青,等.开菲尔粒中一株乳酸乳球菌的分离及性能研究[J].现代食品科技,2014,30(9):121-125.
[13]国立东,刘倩,刘爱芳,等.一株乳酸乳球菌对高胆固醇血症小鼠血脂轮廓的改善作用[J].食品与发酵科技,2014,50(4):26-29.
[14]国立东,王丽群,蒋琛,等.一株乳酸乳球菌的降胆固醇特性及其作用机制[J].中国酿造,2015,34(7):53-55.
[15]BERTELLIC,PILLONELT,TORREGROSSAA,et al.Bifidobacterium longumbacteremiainpreterminfantsreceivingprobiotics[J].Clin Infect Dis,2015,60(6):924-927.
[16]LANDMH,ROUSTER-STEVENSK,WOODS C R,et al.Lactobacillus sepsis associated with probiotic therapy[J].Pediatrics,2005,115(1): 178-181.
[17]MACKAY A D,TAYLOR M B,KIBBLER C C,et al.Lactobacillusendocarditis caused by a probiotic organism[J].Clin Microbiol Infect, 1999,5(5):290-292.
[18]刘倩,刘爱芳,江柳青,等.开菲尔粒中一株高加索酸奶乳杆菌的分离及鉴定[J].黑龙江医药,2013,26(5):810-813.
[19]NOMURA M,NAKAJIMA I,FUJITA Y,et al.Lactococcus lactiscontains only one glutamate decarboxylase gene[J].Microbiology,1999, 145:1375-1380.
γ-aminobutyric acid-producing ability and safety evaluation ofLactococcus lactis
MENG Dan1,WANG Liqun2,XIE Guoliang1,LIU Xiaoyan1,YU Chunmiao1,GUO Lidong1*
(1.College of Pharmacy,Heilongjiang University of Chinese Medicine,Harbin 150040,China; 2.Food Processing Institute,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China)
The γ-aminobutyric acid-producing ability ofLactococcus lactissubsp.lactisHUCM 201 was discussed and the strain safety was preliminarily evaluated.Using γ-aminobutyric acid concentration as evaluation index,the optimal fermentation condition of strain HUCM 201 was evaluated by orthogonal experiments.The optimal fermentation condition was inoculum 4%,initial pH 6.5,fermentation temperature 31℃and time 60 h.The γ-aminobutyric acid concentration was determined as 218.7 μg/ml based on the optimal fermentation condition.Moreover,the safety ofL.lactissubsp. lactisHUCM 201 was evaluated via nitroreductase activity determination,biogenic amines production analysis,indole experiments and haemolysis experiments.The results suggested that the strain HUCM 201 was a nitroreductase-negative,indole-negative,haemolysis-negative bacterium,and could not produce biogenic amines,such as tyramine,histamine,cadaverine,and putrescine.Thus,L.lactissubsp.lactisHUCM 201 was preliminarily considered as safe probiotic bacterium.
lactic acid bacteria;γ-aminobutyric acid;biogenic amine;safety
TS201.3
0254-5071(2017)04-0072-06
10.11882/j.issn.0254-5071.2017.04.016
2016-07-04
黑龙江省自然科学基金项目(C2016052);黑龙江省教育厅面上项目(12531631);黑龙江中医药大学校科研基金项目(201104)
孟丹(1978-),女,讲师,硕士,研究方向为食品营养与卫生。
*通讯作者:国立东(1982-),男,副教授,博士,研究方向为功能食品与食品生物技术。
