多发性硬化患者颅内深部灰质核团MRI的T2信号的定量分析及其临床意义
2017-04-26卢金婧
卢金婧
多发性硬化患者颅内深部灰质核团MRI的T2信号的定量分析及其临床意义
卢金婧
目的 应用T2加权成像观察多发性硬化大脑深部灰质核团(丘脑,尾状核,壳核,苍白球)病变的特点,对MRI T2信号强度进行定量分析,并探讨多发性硬化患者颅内深部灰质核团改变与临床指标(病程,有无行走障碍,有无视神经受累,脑脊液寡克隆带是否为阳性)的相关性。经过糖皮质激素治疗后,对比治疗前后颅内深部灰质核团T2信号强度。方法 依据Mc Donald 2010诊断标准,收集多发性硬化患者17例为实验组,选取17例同性别、同年龄的健康人作为对照组,实验组及对照组均行核磁共振,应用测量T2相对信号值的方法,对两组颅内深部灰质核团(丘脑,尾状核,壳核,苍白球)的MRI T2信号强度进行定量分析,对比组间是否有差异,同时搜集病程,有无行走障碍,有无视神经受累,脑脊液寡克隆带结果等临床指标,评价颅内深部灰质核团改变与临床指标是否有相关性。对比糖皮质激素治疗前后颅内深部灰质核团T2信号强度。结果 与对照组相比,MS组各灰质核团的T2信号均有所减低,差异有统计学意义:丘脑(P=0.001),尾状核(P=0.047),壳核(P=0.041),苍白球(P=0.009)。行走受限与各灰质核团T2信号强度具有相关性,spearman相关系数分别为丘脑0.566(P=0.018),尾状核0.51(P=0.037),苍白球0.538(P=0.026),壳核0.481(P=0.051>0.05)。其余临床指标与T2信号相关系数差异无统计学意义(P>0.05)。糖皮质激素治疗前后,颅内深部灰质核团T2信号强度差异无统计学意义(P>0.05)。结论 多发性硬化患者的灰质核团相比于正常组,T2信号值普遍偏低,提示灰质核团铁质沉积。行走障碍与各个灰质核团的T2低信号有显著相关性,而病程、脑脊液寡克隆带和视神经受累等临床指标均与T2低信号无关。激素治疗对灰质核团铁沉积无即时影响。
多发性硬化;灰质核团;MRI;T2低信号;铁沉积;糖皮质激素
0 引言
多发性硬化(Multiple sclerosis,MS)是一种中枢神经系统炎症脱髓鞘和神经退行性疾病[1],以髓鞘的损伤和修复,伴有轴索损伤为病理特点,可导致间歇和累积的神经功能缺失,其自身免疫性发病机制尚不明确[2]。
MRI不但是诊断MS最有效最重要的辅助手段,很多MRI指标也能够很好地监测疾病的进展(对于自然病程和动物均有效)。MS常常累及皮质和皮质下的灰质。在本研究中,我们应用计算机辅助获得的MRI参数,计算T2相对信号值,定量研究MS患者的颅内深部灰质核团病变情况及其与临床症状、病程等临床指标之间的关系。经过糖皮质激素治疗后,对比治疗前后颅内深部灰质核团T2信号强度。
1 资料与方法
1.1 临床资料 收集入住我院的多发性硬化患者17例为实验组(MS组):筛选符合以下标准的患者:①符合Mc Donald诊断标准,确诊为多发性硬化;②在入院时于我院放射科行头MRI扫描,均应用糖皮质激素治疗,治疗结束后,复查头MRI;③行脑脊液寡克隆带检查;④既往无神经系统其他疾病;⑤既往无其他系统疾病。对照组:选择与病例组同年龄、同性别的健康志愿者且MRI结果正常的患者。共有17例患者入选MS组,其中男3例,女14例;年龄13~59岁,平均(35.53±12.6)岁;病程2~114个月,平均(31.29±34.28)个月。对照组17例,性别、年龄均与MS组相同。MS组及对照组均签署知情同意书。
1.2 研究方法
1.2.1 MRI图像采集 将研究对象的头MRI 的T2加权序列图像上传至工作站(adw4.4,GE),进行定量分析。根据Rohit等的研究[3],我们选取尾状核头、丘脑、苍白球、壳核这几个部位,分析脑内深部灰质核团的T2信号强度。在双侧的尾状核头、丘脑前部、丘脑后部和侧脑室脑脊液,分别圈出6个圆形ROIs(Region of interests,感兴趣区)。尾状核头、丘脑前部、丘脑后部的ROIs直径为5 mm,脑脊液的ROIs直径为2 mm,同时注意避免圈入周围的脑实质和脉络丛。苍白球和壳核则用手动描记的方式圈出相应区域。选择经室间孔的层面(该层均包含有上述灰质结构),进行数据测量,在描记ROI时注意避免将高信号(MS斑块、血管周围间隙等)纳入。见图1。
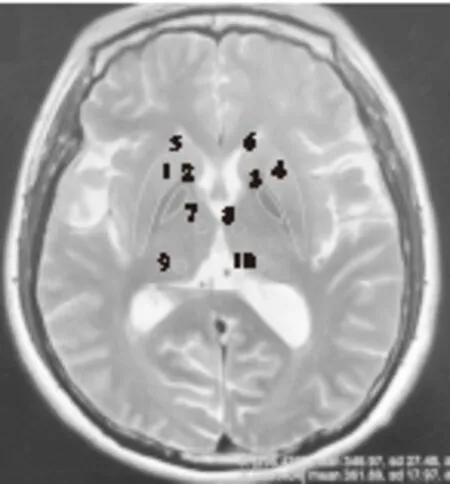
图1 MRI T2序列上典型的各灰质核团ROI定位方法 注:1、4为双侧壳核;2、3为双侧苍白球;5、6为双侧尾状核头; 7、8为双侧丘脑前部;9、10为双侧丘脑后部
1.2.2 MRI数据处理 对左右侧脑室脑脊液绝对信号强度进行分析,组内无差异:MS组(P=0.02),对照组(P=0.034)。组间无差异:左侧(P=0.037),右侧(P=0.029)。本研究用各个灰质核团ROI绝对信号平均值与右侧脑室脑脊液ROI绝对信号平均值之比,代表灰质核团的T2信号强度。其中前、后丘脑的ROI平均值作为丘脑核团的值。MS组住院期间均给予糖皮质激素治疗,治疗后复查MRI,对用药前后的颅内灰质核团的相对T2值进行对比。
1.2.3 临床观察指标 统计MS组患者病程(单位为月),是否有行走障碍,是否有视神经受累,脑脊液中寡克隆带是否为阳性。
1.3 统计学方法 应用SPSS 13.0统计学软件分析。对组间及组内各个灰质核团T2信号进行正态性检验及方差齐性检验,若服从正态分布且方差齐,应用配对样本t检验检测左右两侧灰质核团T2信号是否有差异,若无差异,则用左侧核团的T2信号值代表该核团的T2信号值,进行进一步统计分析;应用配对样本t检验和Pearson相关系数评价组间T2信号值差异。若不服从正态分布或方差不齐,应用非参数检验对上述指标进行评价。应用spearman相关系数评价各临床指标和灰质核团T2信号间的相关性。应用配对样本t检验对用药前后的颅内灰质核团的相对T2值进行对比。P<0.05为差异有统计学意义。
2 结果
2.1 MRI变量分析结果 应用Kolmogorov-Smirnov检验对双侧大脑半球的核团T2信号值进行正态分析检验,同时进行方差齐性检验。经检验,MS组和正常组各核团T2信号值均满足正态分布,且方差齐,因此,采用配对样本t检验进行分析。
左右两侧的Pearson相关系数:丘脑r=0.995,尾状核r=0.961,壳核r=0.992,苍白球r=0.953。配对样本t检验显示,尾状核、壳核、苍白球双侧比较差异无统计学意义,虽然双侧丘脑T2信号值有显著差异,但是其效应量(Effect size)仅为0.02(效应量=平均值的差/联合方差)[3]。总的来说,大脑双侧的灰质核团T2信号具有对称性。将MRI变量简化为丘脑、尾状核、壳核、苍白球4个核团的T2信号强度。
对MS组和正常组的上述5个MRI变量进行配对样本t检验,两组比较差异有统计学意义:丘脑(P=0.001),尾状核(P=0.047),壳核(P=0.041),苍白球(P=0.009)。与正常组相比,MS组各灰质核团的T2信号均较低,见表1。
对MS组经糖皮质激素治疗前后,颅内深部灰质核团的MRI变量进行配对样本t检验,两组差异无统计学意义:丘脑(P=0.236),尾状核(P=0.347),壳核(P=0.689),苍白球(P=0.752)。
2.2 临床指标分析结果 MS组17例患者中,病程2~114个月,平均(31.29±34.28)个月,其中病程0~24个月11例(占60.4%),25~48个月1例(5.9%),49~72个月3例(17.7%),73~96个月1例(5.9%),97~120个月1例(5.9%)。SPMS 2例,RRMS 15例;有行走受限4例,无行走受限13例;视神经受累8例(其中5例为首发症状),无视神经受累9例;脑脊液寡克隆带结果阳性2例,阴性15例。
经检验,临床指标中计量资料均不服从正态分布,对其应用秩相关分析。结果:①行走受限与各灰质核团T2信号的spearman相关系数分别为丘脑r=0.566(P=0.018),尾状核r=0.51(P=0.037),苍白球r=0.538(P=0.026),壳核r=0.481(P=0.051>0.05)。②其余临床指标与T2信号强度的相关性差异无统计学意义(P>0.05)。
3 讨论
传统观念认为,MS病变只累及脑白质,但随着病理学及影像技术的发展,越来越多的研究表明,MS同时累及白质与灰质(包括皮层灰质及深部灰质),其中多数研究发现,在大脑深部灰质核团中存在异常的铁沉积[4-6]。本研究采用统计计算T2相对信号值的方法,定量研究颅内灰质核团的病变情况及其与临床指标之间的联系。
本研究通过对同年龄、同性别的两组患者相对照,应用影像学定量方法,发现MS组脑内深部灰质核团(丘脑,壳核,尾状核,苍白球)的MRI T2WI的信号强度普遍降低,具有统计学意义,该结果与文献报道一致[3,7-8]。其原因考虑为铁沉积所致:组织病理学研究显示,MS患者的神经元内可见斑点状铁沉积,微观铁质沉积可导致T2弛豫时间缩短,T2低信号可能是铁质沉积所致。脑内铁参与脑组织内多种新陈代谢,是神经元代谢过程中重要的辅助因子,同时参与电子传递和神经递质的合成及髓鞘形成和少突胶质细胞发育。有研究表明,脑内铁调节最重要的两种物质是转铁蛋白和铁蛋白,这两种蛋白可能与铁参与髓鞘形成的生物合成有关[9-10]。
MS组患者T2信号强度与行走受限有显著相关性,该结果与国外多项研究结果较为一致:Bakshi等[3]认为,MRI深部灰质核团T2低信号比其他传统MRI变量,能够更好地预测疾病残疾程度和病程。Tjoa等[7]研究纳入了47例MS患者,发现齿状核T2低信号与25步定时行走速度关系显著,同时也能更好地预测EDSS评分。分析其原因,与上述铁沉积在MS中的作用机制有关。我们推断,颅内深部灰质核团T2低信号与多发性硬化患者的残疾情况有关,T2低信号有可能是提示多发性硬化预后的指标,甚至作为疗效评价指标。

表1 MS组和对照组各灰质核团T2信号平均值
本研究中,MS组T2信号强度与病程长短无显著相关性。而多项研究结果显示,T2低信号与病程长短、脑萎缩情况有关[11-12]。考虑有以下几点原因:①在17例患者中,视神经受累8例(47.06%),其中视神经炎为首发症状占5例(29.41%),而欧美MS患者视神经受累发病率较亚洲人群少,上述差异有可能与流行病学差异有关。②不能排除本实验的限制性因素。低场强:高场强下T2信号强度更为敏感,本实验均在1.5TMRI下进行,有可能与场强强度低,导致测量指标敏感性低有关;病程短:本研究中病程0~24个月的患者有11例(占60.4%),因此,有可能在病程早期,铁质沉积和病程并无显著关联性;样本量小:本研究样本量较少,可能存在偏倚,未来可用大样本试验进一步证实。
多项研究表明,在健康人双侧大脑半球中,铁质沉积具有非对称性,健康人左侧灰质核团的铁含量比右侧高[13-14]。而本研究中双侧大脑半球灰质核团的T2信号左右对称,与Bakshi 等[10]的研究结果一致。由此提示铁沉积累及双侧半球,同时推测MS是累及全脑的疾病,而非仅仅是局灶白质脱髓鞘疾病,常规的MRI显示的斑块(通常是不对称的),有可能只是疾病的冰山一角。
其余临床指标如脑脊液寡克隆带及视神经受累与铁质沉积无显著相关性。考虑寡克隆带的出现及视神经受累与灰质核团铁质沉积无关。患者经过糖皮质激素治疗后,临床症状缓解,但头MRI中T2信号与治疗前无显著差异,考虑铁质沉积为持续性的慢性过程,
综上所述,多发性硬化患者颅内灰质核团T2信号较正常组普遍降低,提示MS神经元存在异常铁质沉积。多发性硬化患者颅内灰质核团T2信号减低与行走障碍有显著相关,该结果与国外研究一致,提示颅内深部灰质核团T2低信号与多发性硬化患者的残疾情况有关,T2低信号有可能是提示多发性硬化预后的指标,甚至作为疗效评价指标。脑脊液寡克隆带和视神经受累均与T2低信号无关。本研究中,T2低信号与病程无显著相关性,与国外试验结论不同,考虑与国人MS流行病学特征与欧美不同有关,但由于样本量较小,尚需大样本试验进一步确认。激素治疗对颅内深部灰质核团铁质沉积无即时影响。在将来的研究中,我们将扩大样本量,同时结合SWI等磁敏感序列等影像研究方法,探讨其与皮层的关系。
[1] 刘亚欧,于春水,李坤成,等.临床孤立综合征和复发缓解型多发性硬化MR弥散张量成像的对比研究[J].中国医学影像技术,2008,24(7):996-1000.
[2] 易继平,姚晓喜,黄凤珍,等.糖皮质激素联合法舒地尔治疗多发性硬化的临床观察[J].中国临床实用医学,2015,6(4):44-45.
[3] Bakshi R,Benedict RH.T2 hypointensity in the deep gray matter of patients with multiple sclerosis:a quantitative magnetic resonance imaging study[J].Arch Neurol,2002,59:62-68.
[4] Geurts JJ,Calabrese M,Fisher E,et al.Measurement and clinical effect of grey matter pathology in multiple sclerosis[J].Lancet Neurol,2012,11:1082.
[5] Haacke EM,Makki M,Ge Y,et al.Characterizing iron deposition in multiple sclerosis lesions using susceptibility weighted imaging[J].Magn Reson Imaging,2009,29:537.
[6] 陈璇,李咏梅,罗天友,等.复发-缓解型多发性硬化与复发型视神经脊髓炎脑深部灰质核团铁沉积的ESWAN对比定量分析[J].中国医学影像技术,2012,28(4):630.
[7] Tjoa CW,Benedict RH,Weinstock-Guttman B,et al.MRI T2 hypointensity of the dentate nucleus is related to ambulatory impairment in multiple sclerosis[J].Neurol Sci,2005,234:17-24.
[8] Neema M,Arora A,Healy BC,et al.Deep gray matter involvement on brain MRI scans is associated with clinical progression in multiple sclerosis[J].Neuroimaging,2009,19(1):3-8.
[9] Thougaard AV,Langer SW,Hainau B,et al.A murine experimental anthracycline extravasation model:pathology and study of the involvement of topoisomerase 11 alpha and iron in the mechanism of tissue damage[J].Toxicology,2010,269(1):67-72.
[10]Haache EM,Makki M,Ge Y,et al.Characterizing iron deposition in multiple sclerosis lesions using susceptible weighted imaging[J].Magn Reson Imaging,2009,29(3):537-544.
[11]Van Munster CE,Jonkman LE,Weinstein HC,et al.Gray matter damage in multiple sclerosis:impact on clinical symptoms[J].Neuroscience,2015,303:446-461.
[12]Wang Q,Zhang N,Qin W,et al.Gray matter volume reduction is associated with cognitive impairment in neuromyelitis optica[J].AJNR Am J Neuroradiol,2015,36:1822-1829.
[13]Langkammer C,Krebs N,Goessler W,et al.Quantitative MR imaging of brain iron:a postmortem validation study[J].Radiology,2010,257(2):455-462.
[14]Xu XI.Age,gender,and hemispheric differences in iron deposition in the human brain:an in vivo MRI study[J].Neuroimage,2008,40(1):35-42.
Quantitative measurement of T2 intensity in the deep gray matter of patients with multiple sclerosis and its clinical significance
LU Jin-jing
(Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective By observing the lesion characteristics of deep brain gray matter (thalamus,caudatenucleus,putamen,globus pallidus)in multiple sclerosis patients,quantitatively determine the density of T2 WI,and to observe the changes of deep brain gray matter,and discuss whether it is associated with clinical findings(course of disease,impaired walking,neuritis optic and CSF Ig-G) in multiple sclerosis (MS).Compare the T2 signal intensity of intracranial deep gray matter nuclei before and after treatment of glucocorticoid.Methods According to the Mc Donald 2010 diagnostic criteria,we collected 17 patients with MS and 17 controls,who were the same gender and age.Both groups received MRI,and the relative T2 intensity was measured;the density of T2 WI of deep brain gray matter (thalamus,caudatenucleus,putamen,globus pallidus)was quantitatively determined;T2 intensity between MS and controls was compared.The clinical findings were collected,including the course of disease,impaired walking,neuritis optic and CSF Ig-G;the relationship between T2 hypointensity and clinical measurements was observed.The T2 signal intensity of intracranial deep gray matter nuclei before and after treatment of glucocorticoid was compared.Results Compared to the controls,T2 hypointensity of deep gray matter was present in patients with MS in all structures measured,with significant differences:thalamus(P=0.001),putamen(P=0.041),globus pallidus(P=0.009),and caudate(P=0.047).T2 hypointensity was associated with walk disability,but not with other clinical measurements.Spearman correlation was:thalamus 0.566(P=0.018),caudate 0.51(P=0.037),globus pallidus 0.538(P=0.026),and putamen 0.481(P=0.051).There was no significant difference in T2 signal intensity of intracranial deep gray matter nuclei before and after treatment of glucocorticoid(P>0.05).Conclusion Gray matter T2 hypointensity appears more often in MS patients,indicating iron deposition in grey matter.GM T2 hypointensity is associated with walk disability,not with other clinical findings,which include clinical course,neuritis optic and CSF Ig-G.These results suggest that pathologic iron deposition is a surrogate marker of the destructive disease process.Glucocorticoid treatment has no immediate effect on iron deposition in gray matter nuclei.
Multiple sclerosis;Grey matter;MRI;T2 hypointensity;Iron deposition;Glucocorticoid
2016-09-19
中国医科大学附属盛京医院,沈阳 110004
10.14053/j.cnki.ppcr.201704013
