控制电位还原法回收氯化浸出液中的贵金属
2017-04-26胡意文汪秋雨黄绍勇
胡意文,何 强,王 日,汪秋雨,黄绍勇
控制电位还原法回收氯化浸出液中的贵金属
胡意文1,何 强1,王 日1,汪秋雨1,黄绍勇2
(1. 江西铜业集团公司江西铜业技术研究院有限公司,南昌330096;2. 江西铜业集团公司贵溪冶炼厂,贵溪 335424)
以亚硫酸钠为还原剂,研究采用控制电位还原法回收氯化浸出液中的贵金属。结果表明:当控制金还原电位为530~550 mV时,氯化浸出液中98%以上的Au将被还原沉淀至粗金粉中,同时Pt、Pd和Te基本不被还原沉淀,所得粗金粉中Au含量在98%以上,Se、Te、Cu和Pb等杂质的含量均低于0.10%(质量分数),而且该金还原电位对不同Au浓度或酸度的氯化浸出液都具有良好的适应性;然后当控制铂钯还原电位为390~420 mV时,金还原后液中的Au、Pt和Pd将被还原沉淀至1 mg/L以下,而Te基本不被还原,所得铂钯精矿中贵金属含量高、杂质含量少,且所确定的铂钯还原电位对不同铂钯浓度或酸度的金还原后液以及反应温度均具备较好的适应性。可见,通过控制电位还原,可将氯化浸出液中贵金属选择性沉淀并与其他元素初步分离。
氯化浸出液;贵金属;电位;还原;亚硫酸钠
氯化浸出法是通过氯化剂的作用使固料中的元素转移至溶液中的物料处理方法,它常在强酸条件下进行,以氯酸盐、次氯酸盐或氯气等作为氯化剂,并加入一定量的氯离子以强化作用效果。
在酸性溶液中,氯化剂具有较强的氧化能力,可将绝大部分元素氧化成相应的阳离子,根据元素性质的不同,这些阳离子中有些将以水合阳离子、含氧酸或含氧酸根的形式存在于溶液中,有些将以难溶性盐的形式沉淀,还有些与Cl−发生配位反应转变成氯配离子而留于溶液中,因此,除了Ag、Pb等少量元素外,Au、Pt、Pd、Te、Se、Cu、Bi、Sb、Zn等许多元素都可被氯化浸出,得到成分复杂的浸出液[1]。
氯化浸出法具有元素浸出率高、操作简单、反应速度快、便于控制等特点,但也存在腐蚀性强、操作环境差、浸出选择性差等不足。近年来,随着氯化体系的改善和反应设备的改进,氯化浸出法的腐蚀性强、操作环境差等缺陷已被有效克服。目前,在贵金属物料的处理过程中已获得广泛的应用,但浸出选择性差的不足又大大限制了氯化浸出法的适用对象,由于当使用氯化浸出法处理复杂贵金属物料时,得到的氯化浸出液成分复杂,将其所含贵金属富集成高品位精矿的难度较大。因此,为了拓宽氯化浸出法在贵金属物料处理领域的使用范围,有必要开展复杂氯化浸出液中贵金属分离与回收的研究[2−3]。对于上述课题,一些学者在其研究报道中已有所涉及,如聂华平等[4]用亚硫酸钠溶液将氯化浸出液中的金元素还原沉淀至5 mg/L以下,而且发现反应液电位与金还原率之间存在着一定的关系;章尚发等[5]用硫酸亚铁将氯化浸出液中的金元素选择性还原,金还原率可达99.7%,还原产物中金以单质形式存在,基本不含硒、碲等杂质;郑雅杰等[6]先用SO2将氯化浸出液中的稀贵金属全部还原出来,得到稀贵金属渣,然后对稀贵金属渣进行多次浸出,分离出其中的Se、Te等元素,得到贵金属精矿和Se、Te浸出液,贵金属精矿再送下一步的分离回收;张二军等[7]则先往氯化浸出液中加入无水亚硫酸钠,沉淀后过滤,得到海绵金和含铂钯溶液,然后往含铂钯溶液中加锌粉,沉淀后过滤,得到铂钯泥和废水;张福元等[8]采用亚硫酸钠作还原剂,将金还原后液中的稀贵金属进行深度还原,得到复杂的稀贵金属沉淀渣。此类研究结果为复杂氯化浸出液中贵金属的分离与回收提供了有益参考,但也不同程度地存在着流程冗长、分离效果差、回收率低及处理成本高等诸多缺陷。因此,本文作者在现有研究成果的基础上,拟采用Na2SO3溶液为还原剂,通过控制电位将氯化浸出液中的Au、Pt、Pd等贵金属分步还原并沉淀出来,达到将其与其他元素分离并回收的目的。该处理工艺不仅可将氯化浸出液中的贵金属分离并回收,而且流程短、成本低、易操作、适应性好,为含稀贵金属溶液的综合利用探索出一条行之有效的途径。
1 热力学分析
氯化浸出中一些物种的电极反应及其标准电极电位如表1所列[9−12]。从表1可以看出,当编号为1、3、5、7、9、10、11、12、13及14的电极反应发生时,将有对应的元素以单质的形式从溶液中沉淀出来,在一定的条件下(1.0 mol/L H+、1.0 mol/L Cl−、0.1 MPa、298.15 K),根据表1中的数据和Nernst方程,可得到上述10个电极反应的电位值随其反应物质量浓度的变化关系,如图1所示。为了便于对比,给出SO42−浓度为0.5 mol/L、H+浓度为1.0 mol/L时,电极反应SO42−+2H++2e=SO32−+H2O的电位值随Na2SO3质量浓度的变化关系。

表1 氯化浸出中一些物种的电极反应及其标准电极电 位[9−12]
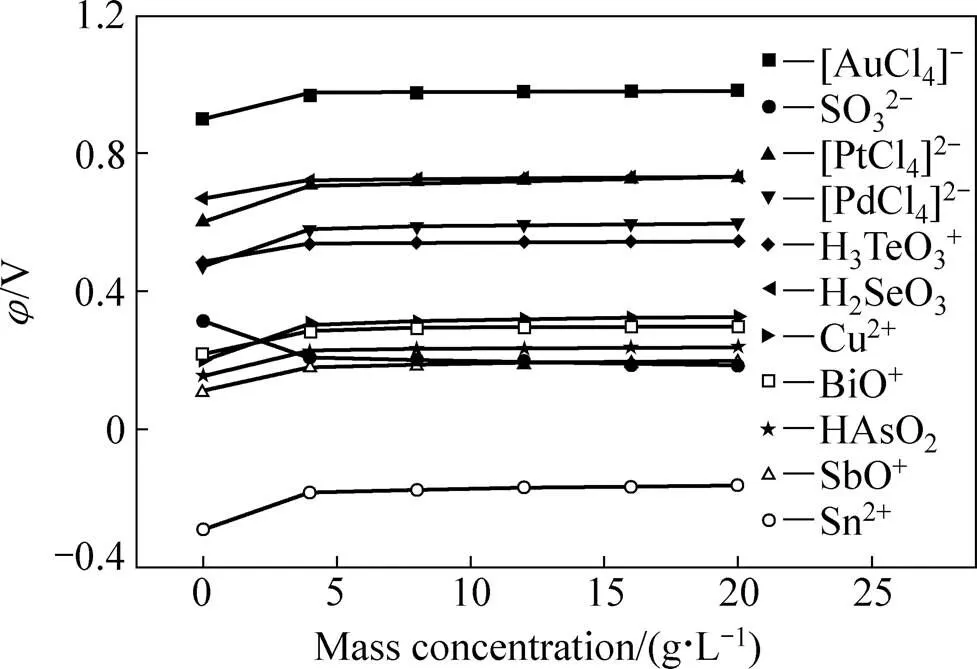
图1 电极反应的电位值随其反应物质量浓度的变化([H+]=1.0 mol/L、[Cl−]=1.0 mol/L、[SO42−]=0.5 mol/L、0.1 MPa、298.15 K)
由图1可看出,从热力学上讲,当采用一定浓度的Na2SO3溶液对氯化浸出液进行还原时,具有最高氧化电位的[AuCl4]−首先发生还原反应,生成单质Au而沉淀下来,且[AuCl4]−的浓度低于1 mg/L时,其氧化电位仍远高于其他物种的,因此,可以通过控制还原电位,选择性地将溶液中的Au沉淀出来,从而使其与其它元素分离并得以回收,需要说明的是,除了控制还原电位,保持氯化浸出液有足够的酸度对Au的分离也非常重要,由于酸度较小时,H6TeO6的还原产物(H6TeO6的氧化电位与[AuCl4]−相当,两者会一起被还原,详见表1)不再是H3TeO3+,而是TeO2和TeO2难溶于水,会与单质Au一起沉淀出来,造成Au分离效果的变差[13]。同样地,通过控制还原电位,可选择性地将金还原后液中的Se和Pt沉淀出来,之后再控制还原电位,选择性地将硒铂还原后液中的Pd和Te沉淀出来。另一方面,前人的理论和实验研究都表 明[14],Pd物种发生还原反应的速率往往比Pt物种的更大,因此,从动力学上来看,在加入Na2SO3溶液时,很可能是Pd比Pt先从溶液中沉淀,也就是说,Se、Pd和Pt将一起沉淀,与溶液中其它元素相分离并得以回收。
通过以上分析可以得出,对于Se含量较低的氯化浸出液,可采用Na2SO3溶液为还原剂,控制还原电位,分步地将其中的Au、Pt、Pd沉淀出来,得到粗金粉和铂钯精矿,从而达到将溶液中贵金属富集成高品位精矿的目的。
2 实验
2.1 实验原料
取某铜冶炼厂提供的氯化浸出液作为实验原液,其成分如表2所列。

表2 氯化浸出液的主要化学成分
2.2 实验步骤
量取一定量的氯化浸出液倒入耐酸反应器中,开启搅拌后缓慢加入Na2SO3溶液,并用电位计监测反应液的电位,当反应液电位达预定值后,停止添加Na2SO3溶液,继续搅拌约10 min后结束反应并过滤,得到粗金粉和金还原后液,粗金粉经洗涤烘干后送主金属品位分析和杂质含量分析,金还原后液量体积并取样送组成分析。
量取一定量的金还原后液倒入耐酸反应器中,开启搅拌并水浴加热至一定温度,然后缓慢加入Na2SO3溶液,并用电位计监测反应液的电位,当反应液的电位达预定值后,停止添加Na2SO3溶液,继续搅拌约10 min后结束反应,冷却后过滤,得铂钯精矿和铂钯还原后液,铂钯还原后液量体积并取样送组成分析,铂钯精矿经洗涤烘干后储存。待储存的铂钯精矿达到一定量后,将所储存的铂钯精矿混合均匀并送固体组成分析。
2.3 分析方法
粗金粉用火试金法进行主金属品位分析,经王水消解后用电感耦合等离子体发射光谱仪(ICP)进行杂质含量分析;铂钯精矿经王水消解后用ICP进行组成分析;液样组成用ICP进行定性和定量分析。
3 结果与讨论
3.1 金还原电位的确定
通过调节Na2SO3溶液加入量来控制反应液的电位,获得金还原时Au、Pt、Pd和Te的沉淀率随反应液电位的变化情况如图2所示。
由图2可看出,随着反应液电位的降低,Au、Pt和Pd的沉淀率逐渐增大,Te的沉淀率一直保持为0。当控制反应液的电位为530 mV时,99.9%以上的Au已被还原沉淀,同时也有约3%的Pt和Pd被还原沉淀;当控制反应液的电位为550 mV时,Au的沉淀率为98.3%,而Pt和Pd基本未被还原沉淀。因此,综合Au的直收率和分离效果两方面考虑,金还原时应控制反应液电位为530~550 mV,此时金的沉淀率高于98.3%,而Pt、Pd和Te则基本不发生还原沉淀。因此,通过控制反应液电位,可选择性地将绝大部分Au元素从氯化浸出液中沉淀出来,使其与Pt、Pd、Te分离并得以回收。
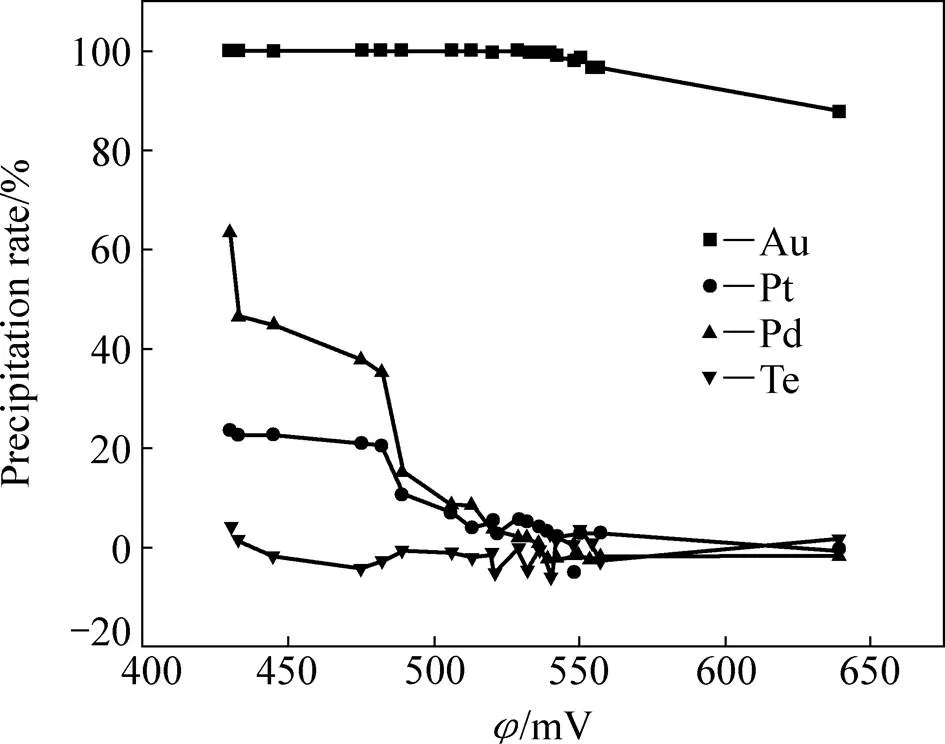
图2 金还原时Au、Pt、Pd、Te的沉淀率随反应液电位值的变化关系
将电位控制在530~550 mV之间还原所得的粗金粉送主金属品位分析和杂质含量分析,结果如表3所示。从表3可以看出,电位控制在530~550 mV之间还原所得的粗金粉中主金属Au的含量均在98%(质量分数)以上,杂质Se、Te、Cu和Pb的含量均不高于0.10%(质量分数),此实验结果再一次说明控制电位还原对Au与其他元素的分离具有良好的作用效果。
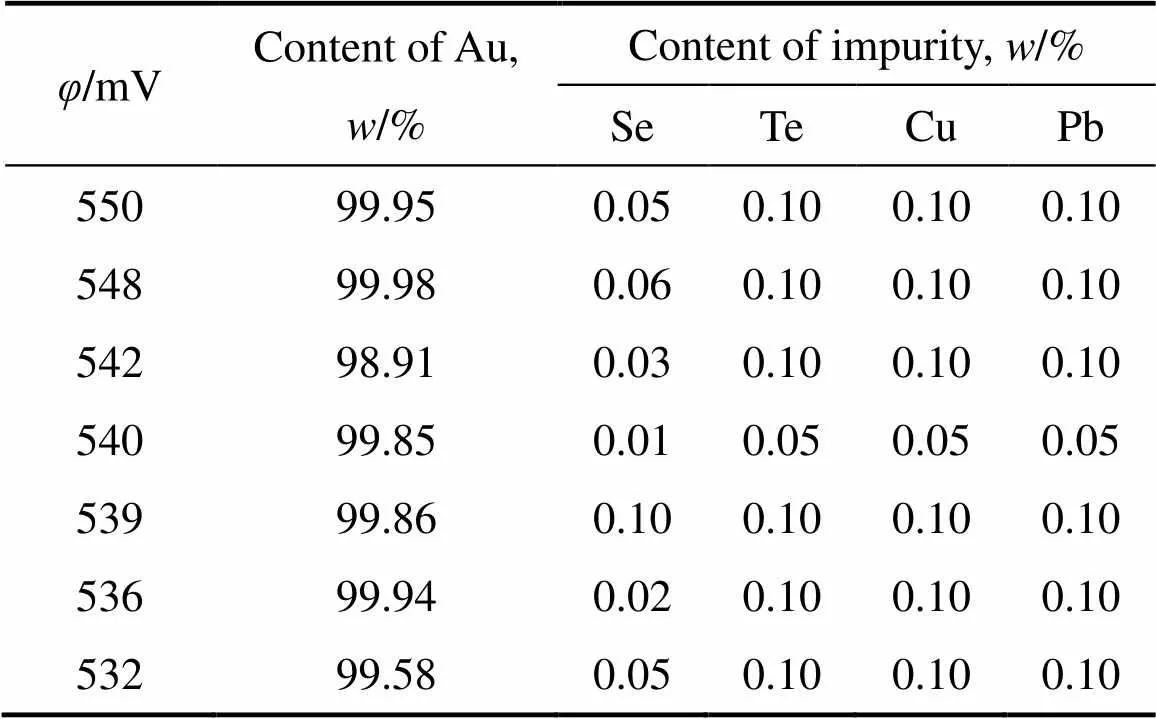
表3 粗金粉的主金属和杂质含量
3.2 金还原电位对金浓度的适应性
为了考察所得金还原电位对Au浓度不同的氯化浸出液的适应性,在其他组成都相同的情况下,对Au浓度各不相同的氯化浸出液进行还原,并控制还原电位为530~550 mV,得Au、Pt、Pd、Te的沉淀率随原液Au浓度的变化关系,如图3所示。
从图3可看出,控制反应液电位在530~550 mV之间对Au浓度不同的氯化浸出液进行金还原时,Au的沉淀率均在98%以上,而Pt、Pd和Te的沉淀率都基本为0,说明所确定的金还原电位对Au浓度不同的氯化浸出液具有良好的适应性。
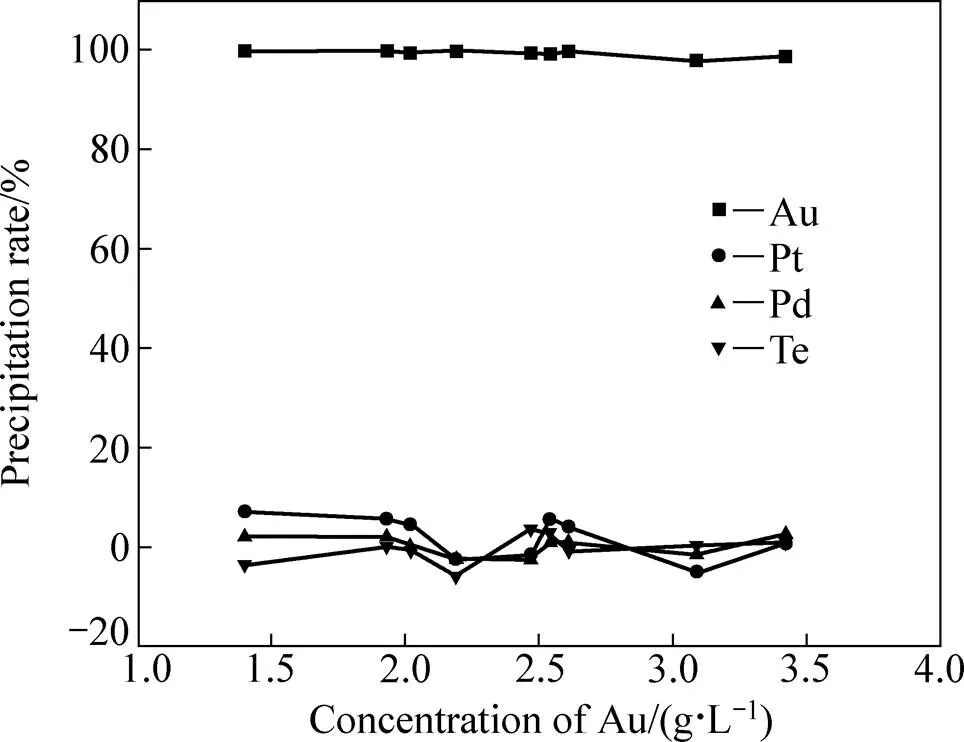
图3 金还原时Au、Pt、Pd、Te的沉淀率随氯化浸出液Au浓度的变化
3.3 金还原电位对酸度的适应性
为了考察所得金还原电位对酸度不同的氯化浸出液的适应性,在其他组成都相同的情况下,对H+浓度各不相同的氯化浸出液进行还原,并控制还原电位为530~550 mV,得Au、Pt、Pd、Te的沉淀率随原液H+浓度的变化关系,如图4所示。
从图4可看出,控制反应液电位在530~550 mV之间对H+浓度不同的氯化浸出液进行金还原时,Au的沉淀率均在98%以上,而Pt、Pd和Te的沉淀率都基本为0,说明所确定的金还原电位对酸度不同的氯化浸出液具有良好的适应性。
3.4 铂钯还原电位的确定
以金还原后液为原液进行铂钯还原,通过调节Na2SO3溶液加入量来控制反应液的电位,获得反应液中Au、Pt、Pd的浓度随反应液电位的变化情况,如图5所示;获得铂钯还原时Pt、Pd和Te的沉淀率随反应液电位的变化情况,如图6所示。
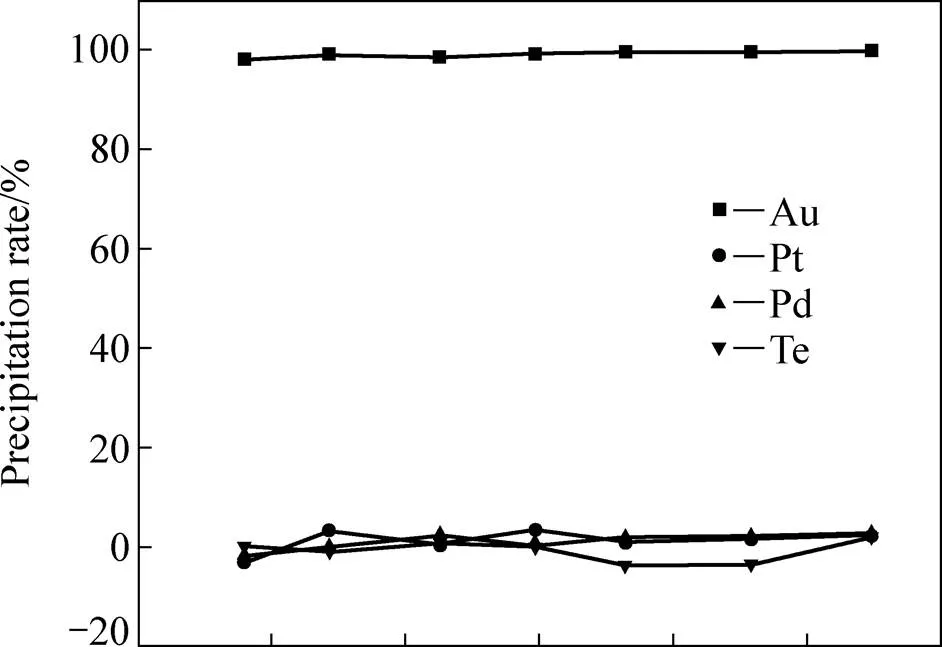
图4 金还原时Au、Pt、Pd、Te的沉淀率随氯化浸出液H+浓度的变化
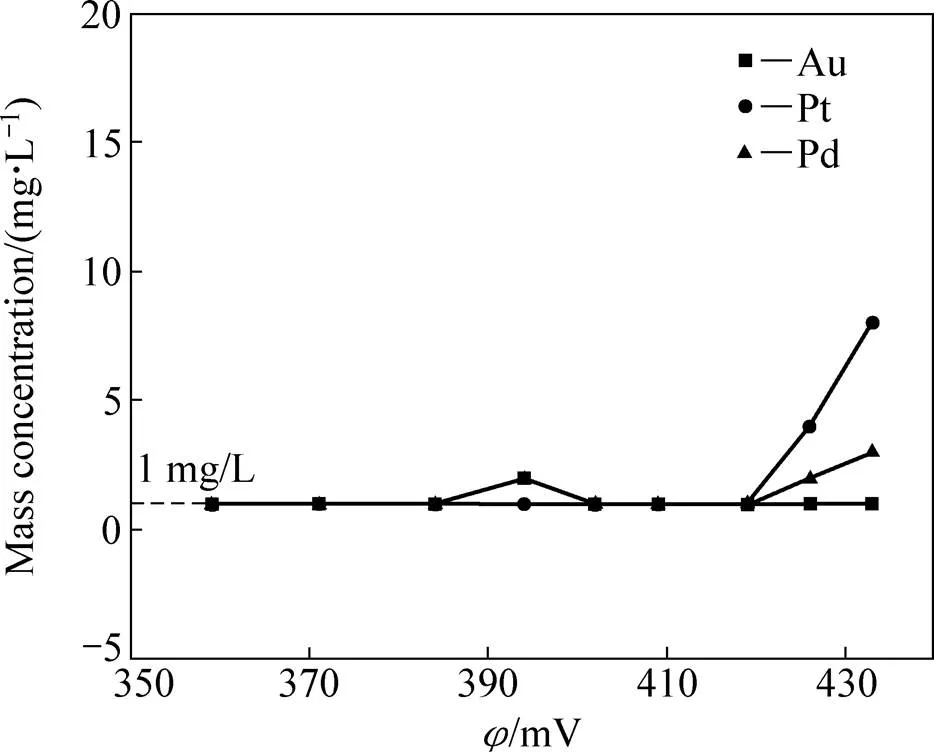
图5 铂钯还原后液中Au、Pt和Pd的质量浓度随反应液电位值的变化
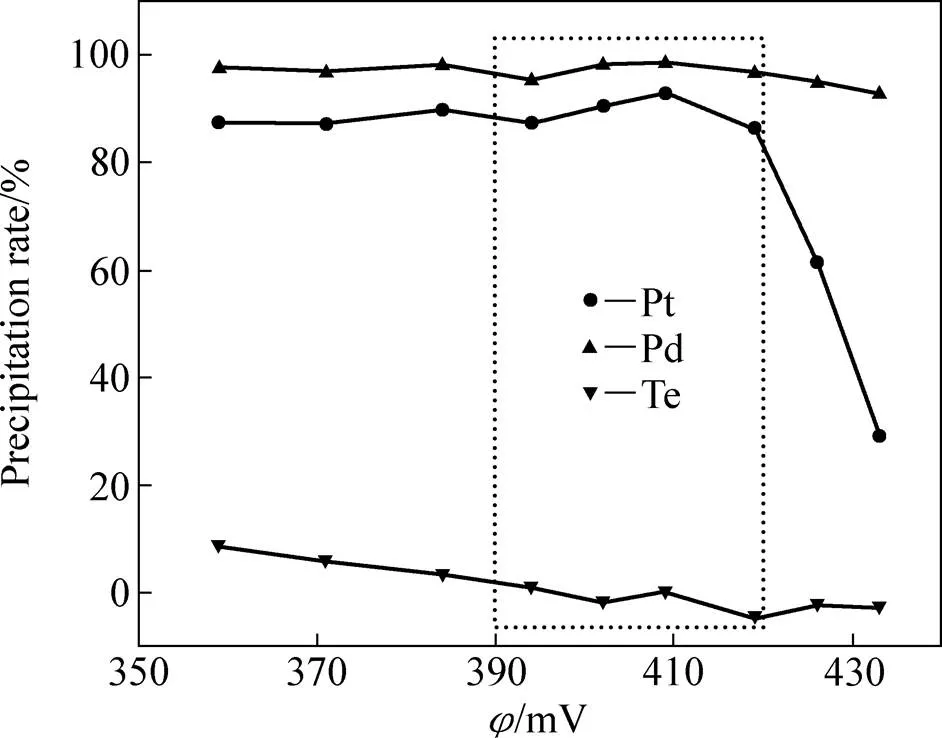
图6 铂钯还原时Pt、Pd、Te的沉淀率随反应液电位值的变化
由图5和6可看出,当控制反应液的电位在390~420 mV时,溶液中的Au、Pt和Pd浓度均降低至1mg/L左右,而Te则基本不发生还原沉淀,可见,通过控制电位还原,可有效地将金还原后液中的贵金属与其它元素分离,并富集至铂钯精矿中。由图2和6也能看出,在同一电位值下,Pd的沉淀率始终比Pt要大,说明在本实验条件下,[PdCl4]2−和[PtCl4]2−的还原反应受动力学的控制,即氧化电位更低的[PdCl4]2−因具有更高的反应活性而先于[PtCl4]2−发生还原反应而沉淀。
将电位控制在390~420 mV之间,还原所得的铂钯精矿混合均匀,送固体组成分析,结果如表4所示,为了对比,也给出铜粉置换法所得铂钯精矿的组 成[15−16]。从表4可以看出,用Na2SO3溶液控制电位还原所得的铂钯精矿中Au、Pt、Pd等贵金属含量高,Cu、Te、Se等杂质含量低,说明与铜粉置换相比,控制电位还原对Pt和Pd的沉淀具有更好的选择性,能更好地将Au、Pt和Pd与其他元素分离,获得更高品质的铂钯精矿。

表4 铂钯精矿的化学组成
1) Data is adopted from Ref. [13].
3.5 铂钯还原电位对铂钯浓度的适应性
为考察所得铂钯还原电位对铂钯浓度不同的氯化浸出液的适应性,在其他组成都相同的情况下,对不相铂钯浓度(但保持铂与钯浓度的比值不变)的金还原后液进行还原,并控制还原电位为390~420 mV,得Pt、Pd、Te的沉淀率随原液Pd浓度的变化关系,如图7所示。
从图7可看出,控制反应液电位在390~420 mV之间对铂钯浓度不同的金还原后液进行铂钯还原时,Pt和Pd的沉淀率均在85%以上(其对应的铂钯还原后液中Au、Pt和Pd的浓度均在1 mg/L以下),而Te的沉淀率都基本为0,说明所确定的铂钯还原电位对铂钯浓度不同的金还原后液具有良好的适应性。
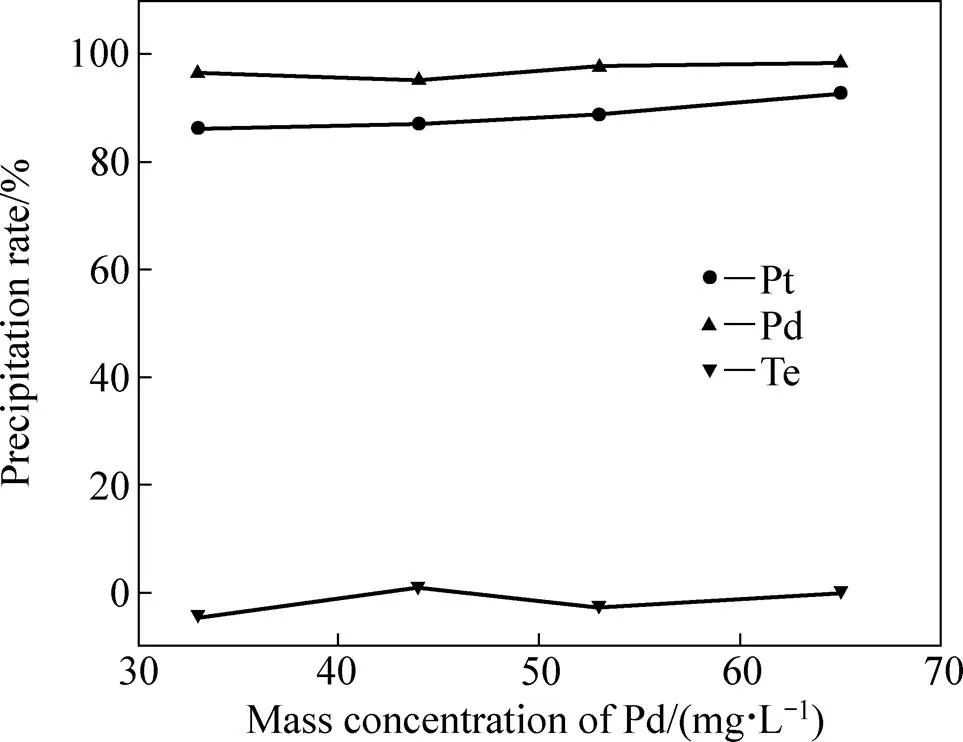
图7 铂钯还原时Pt、Pd、Te的沉淀率随金还原后液中Pd质量浓度的变化
3.6 铂钯还原电位对酸度的适应性
为了考察所得铂钯还原电位对酸度不同的金还原后液的适应性,在其他组成都相同的情况下,对H+浓度各不相同的金还原后液进行还原,并控制还原电位为390~420 mV,得Pt、Pd和Te的沉淀率随原液H+浓度的变化关系,如图8所示。
从图8可看出,控制反应液电位在390~420 mV之间对H+浓度不同的金还原后液进行铂钯还原时,Pt和Pd的沉淀率均在85%以上(其对应的铂钯还原后液中Au、Pt和Pd的浓度均在1 mg/L以下),而Te的沉淀率都基本为0,说明所确定的铂钯还原电位对酸度不同的金还原后液具有良好的适应性。
3.7 铂钯还原电位对反应温度的适应性
为了考察所得铂钯还原电位对反应温度的适应性,在其他条件都相同的情况下,在不同的温度下对金还原后液进行还原,并控制还原电位为390~420 mV,得Pt、Pd和Te的沉淀率随反应温度的变化关系,如图9所示。
由图9可以看出,在40~90 ℃的温度下对金还原后液进行铂钯还原,并控制反应液电位在390~420 mV之间时,Pt和Pd的沉淀率均在85%以上(其对应的铂钯还原后液中Au、Pt和Pd的浓度均在1 mg/L以下),在较低的反应温度下(40、50和60 ℃),Te的沉淀率约为2.5%;而在较高的反应温度下(70、80和90 ℃),Te的沉淀率则基本为0。另外,实验时还发现,较低温度下的铂钯控制电位还原需消耗非常多的还原剂,反应时间也需大大延长,而且还原出的铂钯不容易沉淀,因此,虽然所确定的铂钯还原电位对反应温度也具有良好适应性,但基于反应时间、还原剂消耗量、固液分离难易程度以及能耗大小等各方面考虑,反应温度以70~80 ℃为宜[17]。
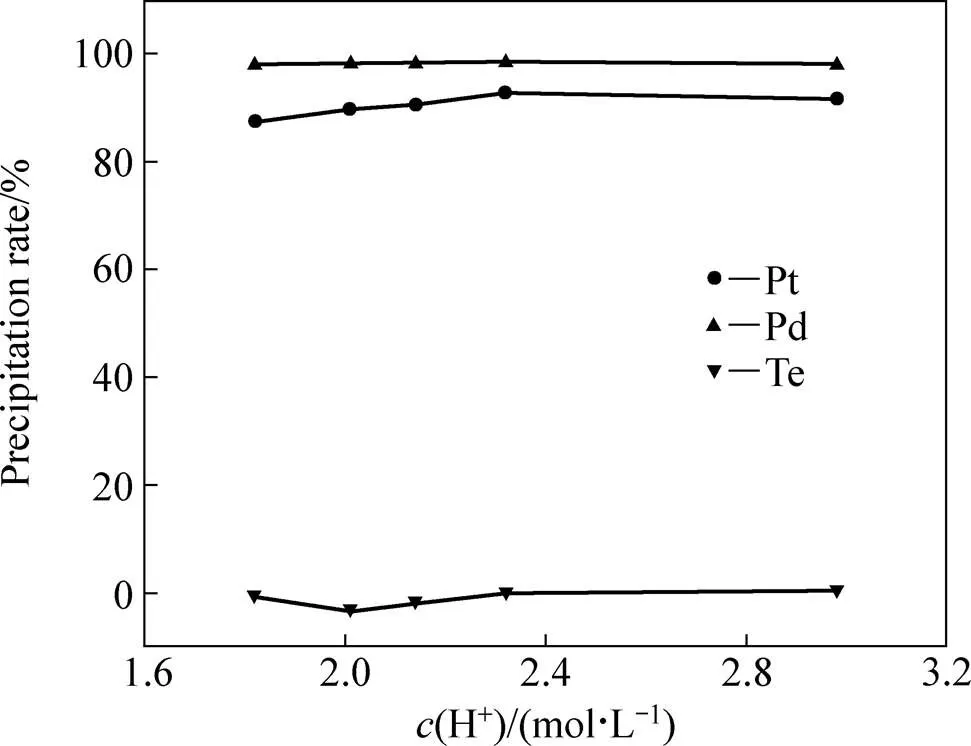
图8 铂钯还原时Pt、Pd、Te的沉淀率随金还原后液H+浓度的变化

图9 铂钯还原时Pt、Pd、Te的沉淀率随反应温度的变化
4 结论
1) 采用Na2SO3为还原剂,通过控制还原电位,可将氯化浸出液中的Au、Pt、Pd等贵金属分步还原并沉淀出来,得到粗金粉和铂钯精矿。所得粗金粉经洗涤后,Au含量均在98%以上,Se、Te、Cu和Pb等杂质的含量均低于0.10%;所得铂钯精矿中贵金属含量高、杂质含量少,品质高于比铜粉置换法所得铂钯精矿。
2) 当控制反应液电位为530~550 mV时,氯化浸出液中98%以上的Au元素将还原沉淀至粗金粉中,同时Pt、Pd和Te基本不被还原,从而实现了将氯化浸出液中Au与溶液中其他元素分离的目的,而且所确定的金还原电位适应性强,对不同Au浓度或酸度的氯化浸出液均具有良好的应用效果。
3) 当控制反应液电位在390~420 mV之间时,金还原后液中的Au、Pt和Pd将还原沉淀至1 mg/L以下,而Te基本不被还原,实现了将金还原后液中贵金属与溶液中其他元素初步分离并高效回收的目的,而且所确定的铂钯还原电位对温度、铂钯浓度和酸度等反应条件都具备良好的适应性。
[1] 王天丰. 铜阳极泥中贵金属的分离提纯[D]. 沈阳: 东北大学, 2013. WANG Tian-feng. Separation and purification of precious metals in copper anode slime[D]. Shenyang: Northeastern University, 2013.
[2] 李淑梅. 氯化湿法冶金研究进展[J]. 有色矿冶, 2010(3): 34−37. LI Shu-mei. Research progress on chloride hydrometallurgy[J]. Non-Ferrous Mining and Metallurgy, 2010(3): 34−37.
[3] 刘伟锋, 杨天足, 刘又年, 陈 霖, 张杜超, 唐谟堂. 脱除铅阳极泥中贱金属的预处理工艺选择[J]. 中国有色金属学报, 2013, 23(2): 549−557. LIU Wei-feng, YANG Tian-zu, LIU You-nian, CHEN Lin, ZHANG Du-chao, TANG Mo-tang. Selection of pretreatment process for removing base metals from lead anode slime[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(2): 549−557.
[4] 聂华平, 王莉红, 张忠堂, 吴芳芳. 基于电位控制的分金液亚硫酸钠深度还原试验研究[J]. 湿法冶金, 2015, 34(4): 296−300. NIE Hua-ping, WANG Li-hong, ZHANG Zhong-tang, WU Fang-fang. Research on deep reduction of gold ion in liquid by controlling of redox potential[J]. Hydrometallurgy of China, 2015, 34(4): 296−300.
[5] 章尚发, 王 冲, 王 华, 杨坤彬, 李英伟. 氯化浸出−还原法处理铜阳极泥分铜渣[J]. 稀有金属与硬质合金, 2014, 42(1): 5−8. ZHANG Shang-fa, WANG Chong, WANG Hua, YANG Kun-bin, LI Ying-we. Treatment of copper-separated residue from copper anode slime by chlorination leaching and reduction[J]. Rare Metals and Cemented Carbides, 2014, 42(1): 5−8.
[6] 郑雅杰, 陈昆昆. 从溶液中回收稀贵金属的一种方法: CN, 201010266679.0[P]. 2010−08−30. ZHENG Ya-jie, CHEN Kun-kun. The method to recover rare and noble metals from the solution: CN, 201010266679.0[P]. 2010−08−30.
[7] 张二军, 谭雄玉. 从含金废料中综合回收金银铂钯稀贵金属的工艺: CN, 201510148545.1[P]. 2015−04−01. ZHANG Er-jun, TAN Xiong-yu. The process for comprehensive recovery of rare and precious metal from gold-contenting waste materials: CN, 201510148545.1[P]. 2015−04−01.
[8] 张福元, 郑雅杰, 孙召明, 马亚赟, 董俊斐. 采用亚硫酸钠还原法从沉金后液中回收稀贵金属[J]. 中国有色金属学报, 2015, 25(8): 2293−2299. ZHANG Fu-yuan, ZHENG Ya-jie, SUN Zhao-ming, MA Ya-yun, DONG Jun-fei. Recovery of rare and precious metals from precipitated gold solution by Na2SO3reduction[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(8): 2293−2299.
[9] BOUROUSHIAN M. Electrochemistry of metal chalcogendies[M]. Berlin: Springer-Verlag, 2012.
[10] 郑雅杰, 陈昆昆, 孙召明. SO2还原沉金后液回收硒碲及捕集铂钯[J]. 中国有色金属学报, 2011, 21(9): 2258−2263. ZHENG Ya-jie, CHEN Kun-kun,SUN Zhao-ming. Recycling Se and Te and capturing Pt and Pd from solution after precipitating gold by SO2reduction[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(9): 2258−2263.
[11] HAIT J, JANA R K, SANYA S K. Mineralogical characteristics of copper electrorefining anode slime and its leached residues[J]. Industrial and Engineering Chemistry Research, 2004, 43(3): 2079−2087.
[12] 张博亚, 王吉坤, 彭金辉. 铜阳极泥中碲的回收[J]. 有色金属(冶炼部分), 2006,11(2): 33−35. ZHANG Bo-ya, WANG Ji-kun, PENG Jin-hui. Reclaiming tellurium from copper anode slime[J]. Nonferrous Metals (Extractive Metallurgy), 2006, 11(2): 33−35.
[13] 谢红艳, 王吉坤, 路 辉. 从铜阳极泥中回收碲研究现状[J]. 湿法冶金, 2010, 29(3): 143−146. XIE Hong-yan, WANG Ji-kun, LU Hui. Status on recovery of tellurium from copper anode slime[J]. Hydrometallurgy of China, 2010, 29(3): 143−146.
[14] 陈 景. 铂族金属氧化还原反应的规律[J]. 贵金属, 1991, 12(1): 7−16. CHEN Jing. Some rules on redox reaction of platinum group metals[J].Precious Metals, 1991, 12(1): 7−16.
[15] NOWOTTNY C, HALWACHS W, SCHUEGERI K. Recovery of platinum, palladium and rhodium from industrial process leaching solutions by reactive extraction[J]. Separation and Purification Technology, 1997, 12(2): 135−144.
[16] 胡建辉. 从金还原后液中置换铂钯的工艺优化研究[J]. 湿法冶金, 2000, 19(2): 22−25. HU Jian-hui. Study on optimum process for displacing Pt and Pd from the solution Au reduced[J]. Hydrometallurgy of China, 2000, 19(2): 22−25.
[17] 余建民, 毕向光, 李 权. 亚硫酸钠在稀贵金属冶金中的应用[J]. 黄金, 2014, 35(1): 48−51. YU Jian-min, BI Xiang-guang, LI Quan. Application of sodium sulfite in metallurgy of rare and precious metals[J]. Glod, 2014, 35(1): 48−51.
(编辑 李艳红)
Recovery of noble metals in chlorination-leaching solution by potential-controlled reduction method
HU Yi-wen1, HE Qiang1, WANG Ri1, WANG Qiu-yu1, HUANG Shao-yong2
(1. Jiangxi Copper Technology Research Institute Co., Ltd.,Jiangxi Copper Corporation, Nanchang 330096, China;2. Guixi Smelt, Jiangxi Copper Corporation, Guixi 335424, China)
Using sodium sulfite as the reducing agent, the recovery of noble metals in chlorination-leaching solution by potential-controlled reduction was investigated. The results show that, when the reduction potential of Au is controlled at 530−550 mV, 98% Au in the chlorination-leaching solution is reduced and precipitated as raw-gold powder while Pt, Pd and Te are almost not reduced. The content of Au in the obtained raw-gold powder is above 98% and those of Se, Te, Cu and Pb are all lower than 0.10% (mass fraction). Also, the potential value of gold reduction has good adaptability to many different kinds of the chlorination-leaching solutions that have various concentrations of Au or H+. Then, when the reduction potential of Pt/Pd is controlled in 390−420 mV, the concentration of Au, Pt and Pd in the precipitated-gold solution can be reduced to below 1 mg/L while most of Te still remains. The content of noble metals in the collected Pt-Pd concentrate is remarkably high and that of impurities is comparatively low. In addition, the determined potential value of Pt/Pd reduction exhibits greatly adaptable to those precipitated-gold solutions with different Pt/Pd concentrations or acidity as well as reaction temperature. Accordingly, the noble metals in chlorination-leaching solutions will selectively precipitate and preliminarily separate from other elements by potential-controlled reduction method.
chlorination-leaching solution; noble metal; potential; reduction; sodium sulfite
Project (20RC18) supported by Doctoral Daily Fund of Jiangxi Province, China
2016-03-28; Accepted date: 2016-08-11
HU Yi-wen; +86-791-88675643; E-mail: hyw1231@126.com
10.19476/j.ysxb.1004.0609.2017.03.021
1004-0609(2017)-03-0621-08
TF09
A
江西省博士后日常资助项目(20RC18)
2016-03-28;
2016-08-11
胡意文,博士;电话:0791-88675643;E-mail:hyw1231@126.com
