乙型肝炎病毒剪接特异性蛋白HBSP与TGFβ1诱导蛋白1相互作用促进TGFβ1诱导的肝癌细胞上皮间质转化
2017-04-26陈婉南黄俊高梁菲菲闫小利轩丹丹
陈婉南,黄俊高,梁菲菲,闫小利,轩丹丹,林 旭
乙型肝炎病毒剪接特异性蛋白HBSP与TGFβ1诱导蛋白1相互作用促进TGFβ1诱导的肝癌细胞上皮间质转化
陈婉南,黄俊高,梁菲菲,闫小利,轩丹丹,林 旭
目的 探讨乙型肝炎病毒剪接特异性蛋白(Hepatitis B spliced protein, HBSP)与转化生长因子1诱导蛋白1(transforming growth factor-β1-induced transcript 1,TGFβ1I1)相互作用对TGFβ1诱导的肝癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT)的影响。方法 构建HBSP慢病毒表达载体,利用293T细胞包装慢病毒颗粒,感染Huh7肝癌细胞株。以5 ng/mLTGFβ1分别诱导稳定表达HBSP的慢病毒细胞株及其对照细胞株,观察细胞形态的变化,并提取细胞蛋白,Westernblot检测上皮间质转化标志物E-钙黏素(E-cadherin,E-cad)、紧密连接蛋白(Claudin-1)、β-链蛋白(β-catenin)、N-钙黏素(N-cadherin,N-cad)的变化。进而以TGFβ1I1特异性siRNA转染上述细胞,Westernblot观察以上指标变化情况。最后以侵袭小室实验和划痕实验分别检测TGFβ1诱导的细胞侵袭与迁移能力的变化。结果 筛选获得稳定表达HBSP的慢病毒细胞株Huh7-HBSP-flag-HIV及其对照细胞株Huh7-flag-HIV。以TGFβ1诱导后在显微镜下观察到细胞形态由紧密的上皮形态变为松散的间质形态;特异性抗体检测表明上皮标志物E-cad、Claudin-1、β-catenin表达量下降,而间质标志物N-cad表达上升。侵袭小室实验和划痕实验表明TGFβ1诱导的HBSP表达株侵袭及迁移能力增强。而转染TGFβ1I1特异性siRNA可逆转以上现象。结论 HBSP与TGFβ1I1相互作用可促进TGFβ1诱导的肝癌细胞上皮间质转化并增强其侵袭迁移能力,提示HBSP在HBV相关性肝细胞肝癌发生发展中具有重要的致病意义。
乙型肝炎病毒;RNA剪接;转化生长因子β1诱导蛋白1;上皮间质转化;侵袭
乙型肝炎病毒剪接特异蛋白HBSP由HBV前基因组RNA (pregenomic RNA, pgRNA)在2 447 nt-489 nt发生RNA剪接产生的长度为2.2 kb的剪接变异体编码产生,已有研究表明该蛋白在HBV感染不同病程均可检出,与病毒的持续性感染及致病性相关[1-4]。HBSP定位于细胞浆[5],为了深入阐明HBSP在HBV导致肝癌发生发展的过程中具体的致病机制,本实验室在前期工作中采用细胞质酵母双杂交(CytoTrapTMtwo-hybrid system,Stratagene)筛选的方法,发现HBSP可以和转化生长因子1诱导蛋白1相互作用[6]。已有研究表明,TGFβ1I1可以促进鼠和人的上皮细胞发生上皮间质转化,对肿瘤的发生发展有着重要意义[7]。本文旨在通过研究HBSP与TGFβ1I1相互作用对肝癌细胞株上皮间质转化以及侵袭性的影响,更好地阐明HBV导致肝癌发生发展的机制。
1 材料和方法
1.1 材料
1.1.1 质粒与细胞 Huh7肝癌细胞株由本实验室保存。人胚肾293T细胞株、慢病毒表达载体pCDH-EF1-MCS-T2A-Puro与包装质粒pMDL、pVSVG、pREV由厦门大学吴乔教授惠赠。
1.1.2 主要试剂 高保真Taq DNA、转染试剂Lipofectamine 3000聚合酶购自Invitrogen公司,限制性内切酶和T4 DNA连接酶购自NEB公司,质粒提取试剂盒购自Qiagen公司。DMEM高糖培养基、胰酶、Puromycin抗生素购自Gibco公司,胎牛血清购自PAN公司,磷酸钙转染试剂盒、anti-TGFβ1I1抗体和Boyden Transwell侵袭小室购自BD公司。TGFβ1购自Sigma-Aldrich公司,TGFβ1I1特异性siRNA混合物及无关序列对照NC-siRNA、兔二抗购自Santa Cruz公司。RIPA裂解液、BCA蛋白定量试剂盒购自碧云天生物技术公司,PVDF膜购自Millipore公司,CDP-STAR化学发光检测底物购自Roche公司。anti-E-cadherin,anti-N-cadherin,anti-β-catenin,anti-Claudin-1抗体、anti-Flag抗体购自Cell Signaling Technology公司,anti-β-actin抗体购自康为世纪,anti-alpha Smooth Actin抗体、anti-Fibronectin抗体购自Abcam公司,鼠二抗购自Calbiochem公司。
1.2 方法
1.2.1 慢病毒载体pCDH-HBSP的构建 以pSos-HBSP为模板[6],PCR扩增获得C末端带有FLAG标签的HBSP基因,插入慢病毒表达载体pCDH-EF1-MCS-T2A-Puro,获得重组载体pCDH-HBSP-FLAG。空载体对照pCDH-FLAG为将8个氨基酸大小的FLAG编码基因插入上述慢病毒表达载体获得。
1.2.2 慢病毒包装与感染、筛选稳定表达HBSP的肝癌细胞株 使用以下质粒混合物、按照试剂盒说明书以磷酸钙转染法转染293T细胞:pCDH-HBSP-FLAG或pCDH-FLAG 2 μg、pMDL 1 μg、pVSVG 0.6 μg、pREV 0.4 μg, 48 h后收集含有病毒的细胞培养上清液,离心过滤后均匀滴加至Huh7肝癌细胞中,以1 μg/mL Puromycin抗生素筛选培养2周,取106个细胞接种于60 mm培养皿。次日以RIPA裂解液提取细胞总蛋白,以anti-FLAG抗体(1∶2 000稀释)检测目的蛋白HBSP的表达。其余细胞冻存至-80 ℃备用。
1.2.3 TGFβ1处理稳定表达HBSP的肝癌细胞株
将经过鉴定稳定表达HBSP的Huh7细胞株于加药处理前一天接种5×105个细胞于35 mm板。次日用PBS清洗后换成不含血清的DMEM培养液,加入TGFβ1(终浓度为5 ng/mL)作用24 h后观察细胞形态的变化。
1.2.4 Westernblot检测TGFβ1处理后EMT相关标志物 同上以5 ng/mL的TGFβ1处理HBSP表达细胞株,24 h后提取细胞总蛋白,以EMT标志物E-cad,N-cad,β-catenin,Claudin-1抗体(均为1∶1 000稀释)检测、Quantity One软件(Biorad)分析计算蛋白条带的灰度值。以各组蛋白条带的灰度值相对于内参β-actin条带的灰度值进行标准化。实验重复5次取平均值作图分析。
1.2.5 TGFβ1I1特异性siRNA转染,Westernblot检测EMT指标 同上以5 ng/mL的TGFβ1处理HBSP表达细胞株,24 h后采用Lipofectamine 3000转染TGFβ1I1特异性siRNA混合物,使用无关序列NC-siRNA作为对照。转染方法参照试剂说明书,转染后24 h提取细胞总蛋白,同上检测EMT相关标志物。实验重复5次取平均值作图分析。
1.2.6 侵袭小室实验 HBSP表达细胞株以5 ng/mL的TGFβ1处理24 h后,用TGFβ1I1特异性siRNA混合物以及对照NC-siRNA转染细胞24 h,以无血清培养液吹打混匀消化后的细胞,分别计数5 ×104个细胞接种到Boyden Transwell小室内,36 h,后用 0.1 %结晶紫染液染色,在倒置显微镜下随机取5个视野计数细胞取平均值并分别拍照,实验重复5次。
1.2.7 划痕实验 同上获得TGFβ1处理并使用TGFβ1I1特异性siRNA混合物转染的HBSP表达细胞株,接种于6孔板次日用灭菌枪头在培养皿底部垂直划出一道直线,在倒置显微镜下随机取5个视野拍照并测量划痕宽度并取平均值,继续无血清培养48 h后,拍照测量划痕宽度取平均值,实验重复5次。
2 结 果
2.1 慢病毒感染Huh7细胞,筛选获得稳定表达HBSP的肝癌细胞株 PCR扩增HBSP基因,经XbaI和BamH I双酶切位点克隆入慢病毒表达载体pCDH-EF1-MCS-T2A-Puro,重组载体经酶切(图1A)及测序证实插入的HBSP DNA片段正确无误,命名为pCDH-HBSP-FLAG。包装载体pMDL、pVSVG、pREV,以及pCDH-HBSP-FLAG或空载体对照pCDH-FLAG共转染293T细胞;获得慢病毒液,感染并以Puromycin筛选Huh7细胞,以anti-FLAG抗体检验目的蛋白的表达(图1B),获得的稳定表达HBSP的细胞株命名为Huh7-HBSP-flag-HIV,对照细胞株命名为Huh7-flag-HIV。
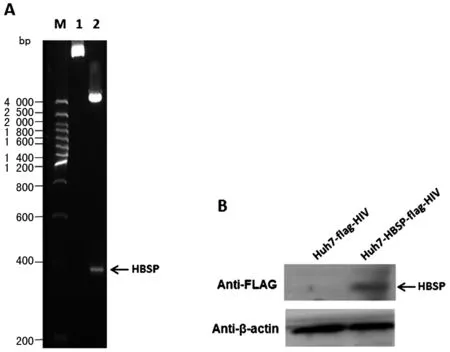
A.慢病毒重组载体双酶切鉴定 B.1. 未经酶切的重组载体;2. XbaI和BamH I双酶切重组载体 B.Westernblot检测Huh7细胞株HBSP蛋白的表达A.Restriction enzyme analysis of recombinant lentiviral expression vector 1.uncut recombinant plasmids; 2. recombinant plasmids digested with XbaI and BamH I B.Westernblot detection of HBSP expression in the established Huh7 cell lines图1 慢病毒表达载体构建及Westernblot检测HBSP蛋白表达的Huh7慢病毒细胞株Fig.1 Lentiviral vector construction and HBSP protein detection in the established Huh7 cell lines
2.2 HBSP 促进TGFβ1诱导的肝癌细胞上皮间质转化 以5 ng/mL的TGFβ1诱导Huh7-HBSP-flag-HIV与对照细胞株Huh7-flag-HIV24 h,镜下可见细胞形态发生变化:处理前,对照组Huh7-flag-HIV细胞呈铺路石样,细胞之间连接紧密,呈现典型的上皮细胞形态(图2A),而Huh7-HBSP-flag-HIV 细胞(图2B)为多边形,部分为梭形;经过5 ng/mL TGFβ1处理24 h,Huh7-flag-HIV 细胞间隙变宽,细胞间连接变得松散,多呈间质细胞形态(图2C),而Huh7-HBSP-flag-HIV细胞比对照细胞连接更松散,细胞变长呈梭形,几乎全为间质细胞形态(图2D)。提示HBSP促进TGFβ1诱导的肝癌细胞发生上皮间质转化。
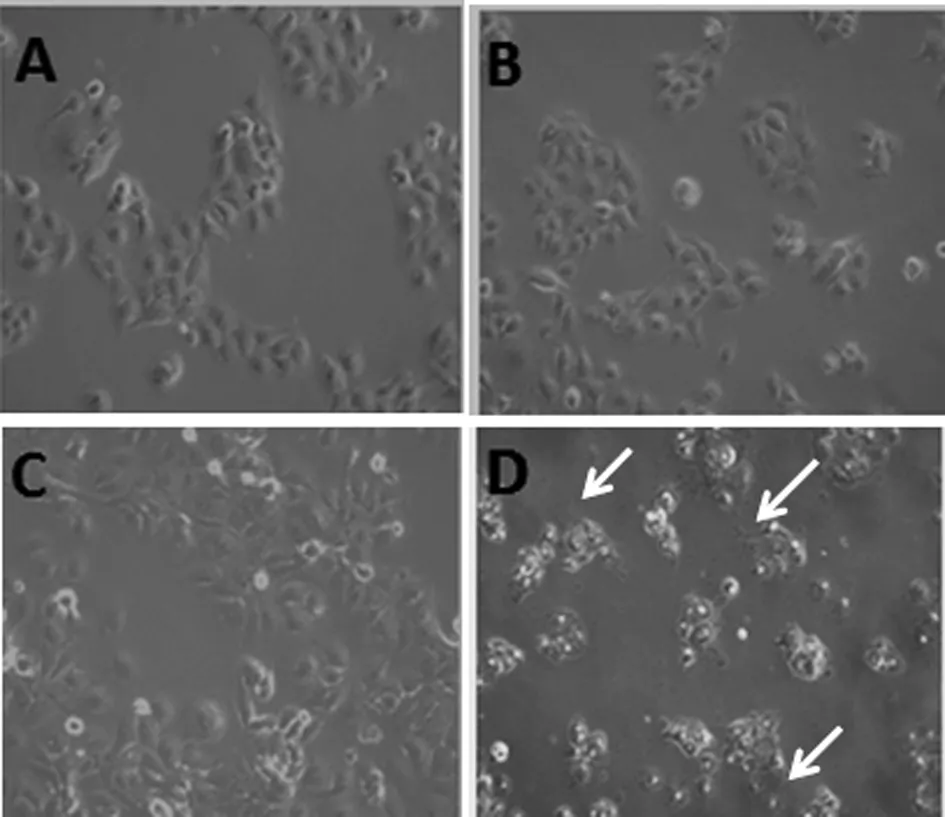
A:Huh7-flag-HIV细胞; B:Huh7-HBSP-flag-HIV细胞; C:5 ng/mL TGFβ1处理Huh7-flag-HIV细胞24 h后;D:5 ng/mL TGFβ1处理Huh7-HBSP-flag-HIV细胞24 h后A:Huh7-flag-HIVcells; B:Huh7-HBSP-flag-HIV cells; C:Huh7-flag-HIV cells treated with 5 ng/mL TGFβ1 for 24 hours; D:Huh7-HBSP-flag-HIV cells treated with 5 ng/mL TGFβ1 for 24 hours.图2 TGFβ1处理前后 Huh7-HBSP-flag-HIV 及对照组 Huh7-flag-HIV 细胞株形态学变化(10×)Fig.2 Huh7-HBSP-flag-HIV and Huh7-flag-HIV cells images before and after TGFβ1 treatment (10×)
2.3 HBSP促进TGFβ1诱导的肝癌细胞上皮间
质转化相关指标变化 以5 ng/mL TGFβ1诱导细胞24 h后,提取细胞总蛋白,用特异性抗体检测EMT相关指标表达水平,结果显示,Huh7-HBSP-flag-HIV与Huh7-flag-HIV对照细胞株相比,上皮样标志物E-cadherin、Claudin-1、β-catenin表达量都出现明显下降(n=5,P<0.01),而间质样标志物N-cadherin表达量出现明显升高(n=5,P<0.01)(图3)。HBSP在肝癌细胞株内过表达可下调TGFβ1诱导的肝癌细胞上皮样标志物表达水平,并上调间质样标志物表达水平,进一步证明HBSP可促进TGFβ1诱导的肝癌细胞发生上皮间质转化。
2.4 下调TGFβ1I1可逆转TGFβ1诱导的HBSP表达细胞株上皮间质转化 以5 ng/mL TGFβ1诱导Huh7-HBSP-flag-HIV以及Huh7-flag-HIV对照株,并分别转染TGFβ1I1 siRNA混合物与无关对照NC-siRNA,观察TGFβ1I1表达水平被特异性siRNA下调后(图4A)EMT相关指标的变化情况。结果显示:转染无关对照NC-siRNA组,Huh7-HBSP-flag-HIV细胞与Huh7-flag-HIV对照细胞株相比,上皮细胞相关指标E-cadherin、Claudin-1、β-catenin表达量都下降,而间质细胞标志物N-cadherin表达量增高(图4A,第三泳道与第一泳道对比,n=5,P<0.01);而TGFβ1I1 siRNA 混合物转染Huh7-HBSP-flag-HIV细胞,其上皮样标志物E-cadherin、Claudin-1、β-catenin表达量逆转上调,间质样标志物N-cadherin表达下降(图4A,第四泳道与第三泳道对比,n=5,P<0.01),说明下调TGFβ1I1可逆转TGFβ1诱导的HBSP表达细胞株上皮间质转化,提示HBSP借由与TGFβ1I1的相互作用来影响TGFβ1诱导的肝癌细胞上皮间质转化。
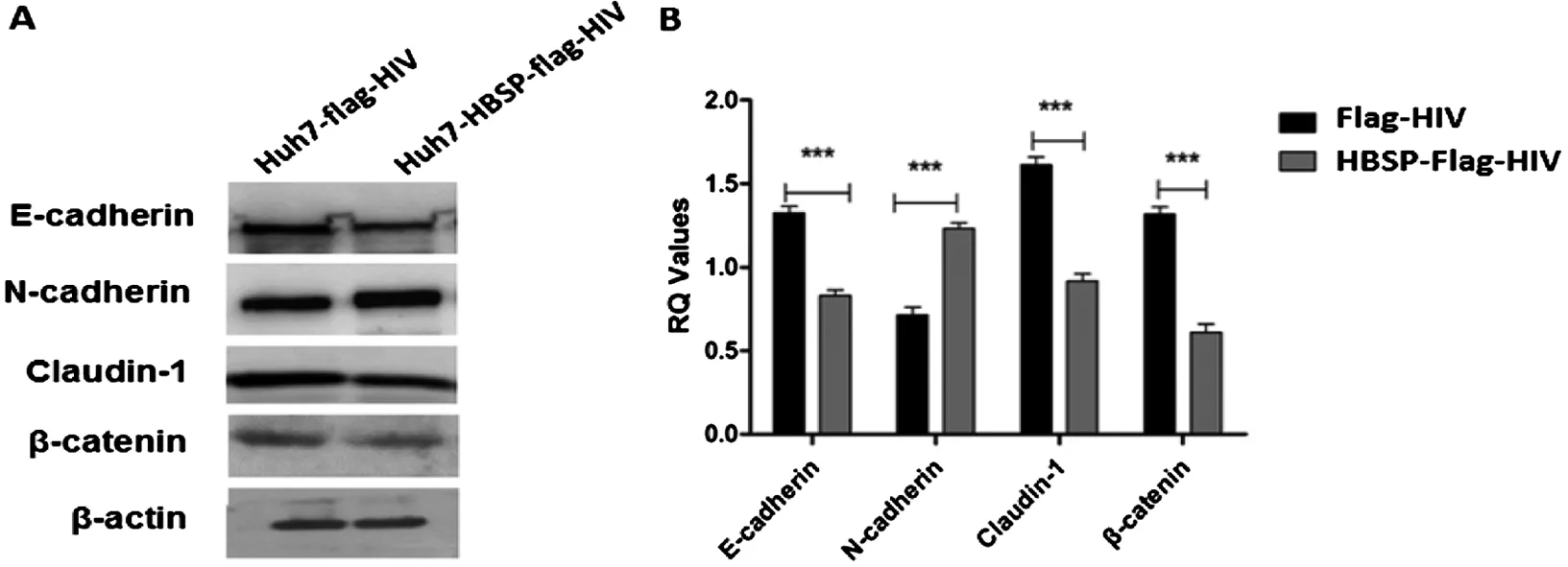
A:Westernblot检测Huh7 细胞株EMT标志物 B:蛋白条带灰度值比较A:Westernblot analysis of EMT markers; B:Relative intensities of plotted proteins.*** n=5, P<0.0001图3 TGFβ1诱导的肝癌细胞上皮间质转化相关指标变化Fig.3 TGFβ1-induced EMT markers detection in Huh7 cell lines
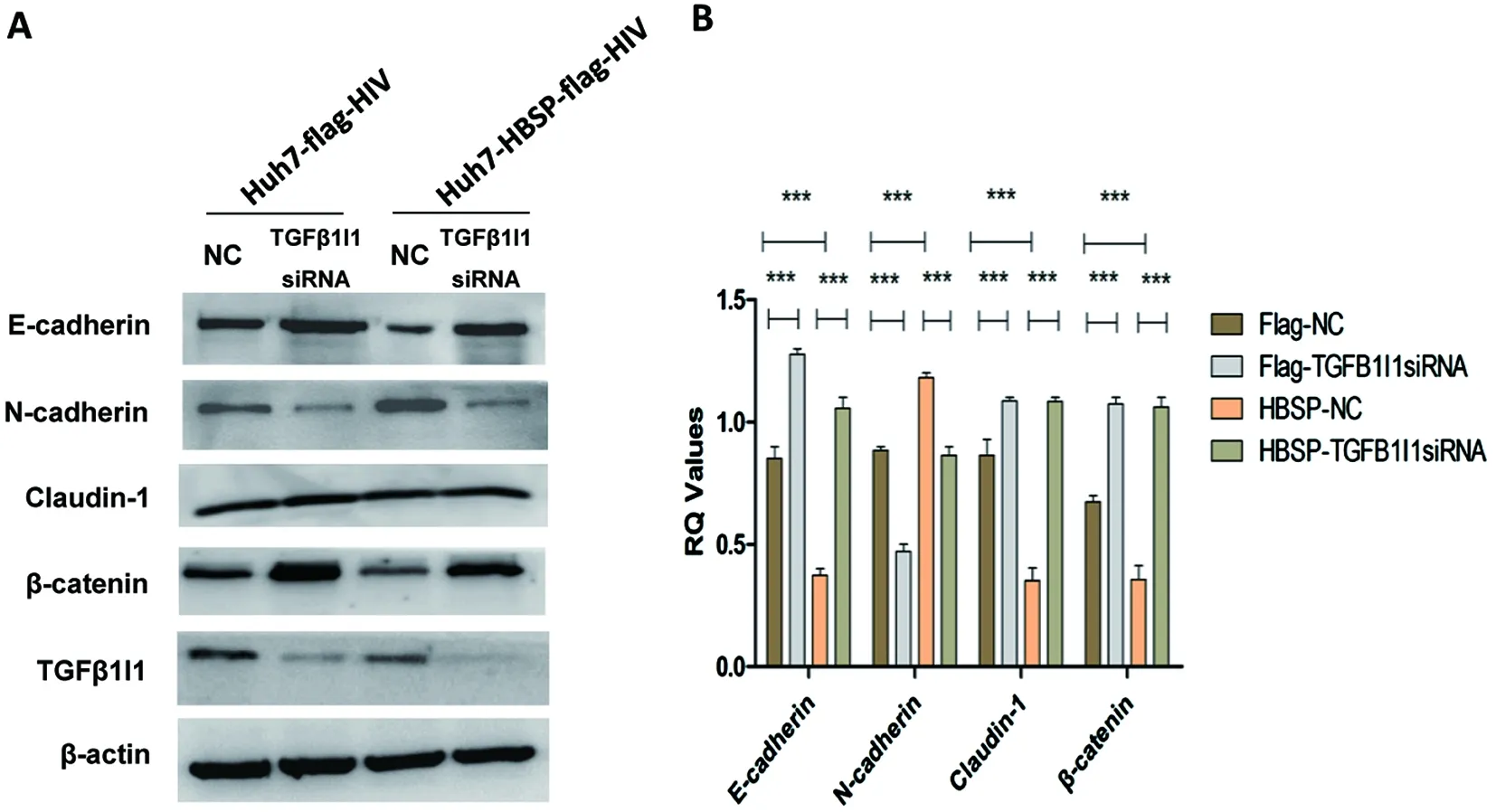
A:Westernblot检测 EMT标志物 B:蛋白条带灰度值比较A:Western blot detection of EMT markers; B:Relative intensities of plotted proteins.*** n=5, P<0.0001.图4 siRNA下调TGFβ1I1可逆转TGFβ1诱导的HBSP表达细胞株上皮间质转化Fig.4 TGFβ1I1 knockdown by siRNA could reverse epithelial-mesenchymal transition in HBSP expressed Huh7 hepatoma cells
2.5 HBSP与TGFβ1I1的相互作用促进TGFβ1诱导的肝癌细胞侵袭与迁移能力 Huh7-HBSP-flag-HIV以及Huh7-flag-HIV对照株分别以5 ng/mL TGFβ1处理24 h后分别转染TGFβ1I1 siRNA混合物与NC-siRNA,作用24 h后接种于侵袭小室,36 h后观察到:转染无关对照NC-siRNA,Huh7-HBSP-flag-HIV细胞与Huh7-flag-HIV细胞株相比(见图5A,第三列与第一列相比),细胞数明显增加(94±3 vs. 29±3,P<0.05),说明HBSP能够促进TGFβ1诱导的肝癌细胞侵袭能力。Huh7-HBSP-flag-HIV细胞株转染TGFβ1I1特异性siRNA后(见图5A,第四列与第三列相比)细胞数明显下降(29±3 vs. 9±2,P<0.05)。
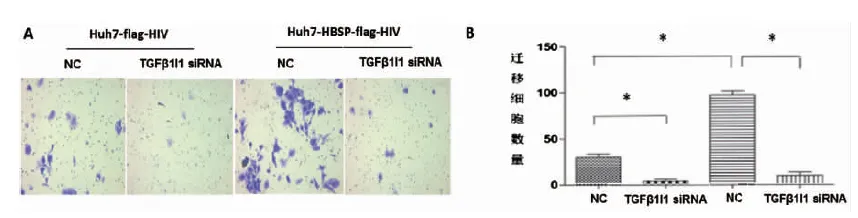
A:镜下观察迁移穿过transwell小室的细胞 B:迁移细胞数量比较A:Images of Huh7 invaded through membrane into the bottom of transwell chamber; B:Comparison of invaded cells quantities.* n=5, P<0.05.图5 HBSP与TGFβ1I1相互作用促进TGFβ1诱导的肝癌细胞侵袭能力Fig.5 HBSP-TGFβ1I1 interaction promotes invasion of TGFβ1-induced Huh7 hepatoma cells
同样地,对5 ng/mL TGFβ1处理Huh7-HBSP-flag-HIV以及Huh7-flag-HIV对照株转染TGFβ1I1 siRNA混合物与NC-siRNA 24 h后,进行划痕实验,48 h后观察细胞修复情况。结果与侵袭实验类似,转染无关对照NC-siRNA,Huh7-HBSP-flag-HIV细胞与Huh7-flag-HIV细胞株相比,细胞迁移能力明显加强(见图6A,第三列与第一列相比),说明HBSP促进TGFβ1诱导的肝癌细胞迁移能力。当TGFβ1I1被siRNA下调后,Huh7-HBSP-flag-HIV细胞株迁移能力下降(见图6A,第四列与第三列相比)。上述结果提示HBSP与TGFβ1I1的相互作用促进TGFβ1诱导的肝癌细胞侵袭与迁移能力。
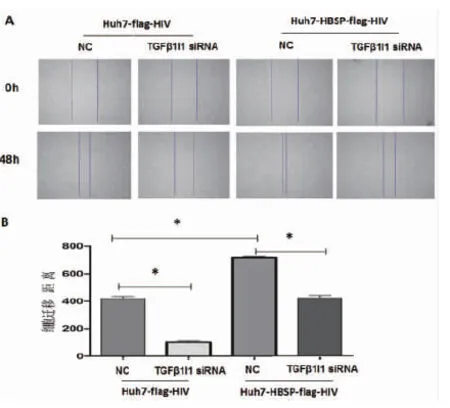
A:镜下观察划痕实验前后的细胞 B:划痕修复宽度比较A:Images of Huh7 with wound healing assay captured at 0 h and 48 h; B:Quantify the total distance of cells moved from the edge of the scratch toward the center.* n=5,P<0.05.图6 HBSP与TGFβ1I1相互作用促进TGFβ1诱导的肝癌细胞迁移能力Fig.6 HBSP-TGFβ1I1 interaction promotes migration of TGFβ1-induced Huh7 hepatoma cells
3 讨 论
乙型肝炎病毒是一种在其复制周期中存在逆转录过程的DNA病毒,由前基因组RNA剪接所产生的剪接变异体可编码产生一些剪接变异体特异性新蛋白。HBSP是HBV感染者中常见的一种剪接蛋白[8],已有研究认为,HBSP可诱导肝细胞凋亡,加重肝炎病情,还与肝纤维化有关[2];并通过诱导特异性细胞毒性T淋巴细胞(cytotoxic lymphocyte,CTL)活性,导致肝脏损伤[3]。我们先前的研究也显示HBSP与组织蛋白酶B(cathepsin B, CTSB)相互作用,通过PI3K/Akt通路及MAPK通路增强肝癌细胞株的侵袭能力[4]; HBSP与纤维蛋白原(fibrinogen gamma chain,FGG)相互作用,抑制其交联,能抑制血小板凝集、活化,造成凝血障碍[5]; HBSP与微粒体环氧化物酶(microsomal epoxidehydrolase, mEH)相互作用,通过促进后者活性,导致苯丙芘(Benzo(a)pyrene, B[a]P)的致癌产物增加,协同促进肝癌细胞生长[9]。为了更好地了解定位于细胞浆内的HBSP与肝细胞蛋白相互作用的情况,本实验室在前期工作中采用细胞质酵母双杂交研究与HBSP相互作用的蛋白,筛选出转化生长因子1诱导蛋白1,并利用哺乳动物细胞双杂交、免疫共沉淀等方法证实了HBSP可与其相互作用[6]。
转化生长因子β1诱导蛋白1受TGFβ1诱导[10],因其又受H2O2诱导,也称为Hic-5(hydrogen peroxide-inducible clone-5)[11]。TGFβ1I1对TGFβ1存在正反馈调节机制,即TGFβ1I1具有维持局部组织TGFβ1不断自分泌的作用[12]。TGFβ1I1可促进细胞发生上皮间质转化[13],且这类由TGFβ1诱导的EMT可促进细胞间基质的降解和提高细胞的侵袭转移能力[14],有研究表明,TGFβ1诱导的EMT与肝细胞性肝癌发生发展密切相关[15-16]。EMT是肿瘤转移的重要机制之一,主要特征是上皮细胞极性消失,转换成运动更为灵活、易于侵袭的间质细胞,最直观的表现就是其细胞形态常常发生改变[17]。本研究观察到乙型肝炎病毒剪接特异性蛋白HBSP在肝癌细胞株Huh7中过表达可促进TGFβ1诱导的EMT现象,经过5 ng/mL TGFβ1刺激24 h后,表达HBSP的慢病毒细胞株大部分发生明显形态改变,表现为细胞之间连接变得松散,细胞间隙变宽,细胞变长呈梭形,即上皮源性的肝细胞呈现出典型的间质细胞形态。为深入探讨其机制,我们进一步利用特异性抗体检测同样处理条件下EMT的一些标志分子,可见相应细胞上皮标志物E-cad、Claudin-1、β-catenin表达量下降,而间质标志物N-cad表达量升高,且该现象可随TGFβ1I1被特异性siRNA下调而逆转。提示HBSP过表达Huh7细胞株受TGFβ1诱导发生EMT,可能与HBSP-TGFβ1I蛋白相互作用有关。E-cad是一种跨膜类型的糖蛋白,在胞浆内通过α、β连接素(α、β-catenin)间接的与肌动蛋白骨架连接,对于稳定细胞骨架和保持上皮细胞间连接起重要作用,E-cad水平的下降往往同时伴随有细胞间连接分子Claudin-1和β-catenin的下调[18]。N-cad是间质细胞的主要标志物,在很多肿瘤细胞发生中都出现N-cad的上调[19]。
EMT发生往往导致肿瘤细胞黏附能力下降,迁移运动能力增加,使得肿瘤细胞更易于离开原有位置,发生原位浸润或者随血行、淋巴等途径转移[17]。为了深入揭示HBSP-TGFβ1I1相互作用导致EMT如何影响肝癌细胞恶性生物学行为,我们进一步做了侵袭小室实验,发现在TGFβ1诱导下,HBSP过表达组与对照组相比,侵袭能力显著增强,而当TGFβ1I1被特异性siRNA下调,侵袭能力得以减弱,说明HBSP能通过与TGFβ1I1相互作用加强Huh7细胞的侵袭能力。划痕实验也同样说明了HBSP蛋白与TGFβ1I1相互作用加强了Huh7细胞的迁移能力。
综上所述,我们认为乙型肝炎病毒编码的剪接特异性蛋白HBSP可借由与TGFβ1I1的相互作用,促进肝癌细胞发生EMT,继而促进肿瘤侵袭转移。本研究所获得的结果有助于阐明HBV病毒成分导致肝癌转移的具体机制,并为抑制HBV相关肝癌的侵袭转移提供新思路。
[1] Wu HL, Chen PJ, Tu SJ, et al. Characterization and genetic analysis of alternatively spliced transcripts of hepatitis B virus in infected human liver tissues and transfected HepG2 cells[J]. J Virol, 1991, 65(4):1680-1686.
[2] Soussan P, Tuveri R, Nalpas B, et al. The expression of hepatitis B spliced protein (HBSP) encoded by a spliced hepatitis B virus RNA is associated with viral replication and liver fibrosis[J]. J Hepatol, 2003, 38(3):343-348. DOI:10.1016/S0168-8278(02)00422-1
[3] Mancini-Bourgine M, Bayard F, Soussan P, et al. Hepatitis B virus splice-generated protein induces T-cell responses in HLA-transgenic mice and hepatitis B virus-infected patients[J]. J Virol, 2007, 81(10):4963-4972. DOI:10.1128/JVI.02619-06
[4] Chen WN, Chen JY, Jiao BY, et al. Interaction of hepatitis B spliced protein (HBSP) with cathepsin B promotes hepatoma cell migration and invasion[J]. J Virol, 2012, 86(24):13533-13541. DOI:10.1128/JVI.02095-12
[5] Chen JY, Chen WN, Liu LL, et al. Hepatitis B spliced protein (HBSP) generated by a spliced hepatitis B virus RNA participates in abnormality of fibrin formation and functions by binding to fibrinogen γ chain[J]. J Med Virol, 2010, 82(12):2019-2026. DOI:10.1002/jmv.21918
[6] Sciencepaper Online.Interaction of the hepatitis B spliced protein with transforming growth factor beta 1 induced transcript 1[EB/OL].[2015-7-13].http://www.paper.edu.cn/html/releasepaper/201507-118.
[7] Tumbarello DA, Turner CE. Hic-5 contributes to epithelial-mesenchymal transformation through a RhoA/ROCK-dependent pathway[J]. J Cellular Physiol, 2007, 211(3):736-47. DOI:10.1002/jcp.20991
[8] Soussan P, Garreau F, Zylberberg H, et al.Invivoexpression of a new hepatitis B virus protein encoded by a spliced RNA[J]. J Clin Investigat, 2000, 105(1):55-60. DOI:10.1172/JCI8098
[9] Chen JY, Chen WN, Jiao BY, et al. Hepatitis B spliced protein (HBSP) promotes the carcinogenic effects of benzo [alpha] pyrene by interacting with microsomal epoxide hydrolase and enhancing its hydrolysis activity[J]. BMC Cancer, 2014, 14:282. DOI:10.1186/1471-2407-14-282
[10] Shibanuma M, Mashimo J, Mita A, et al. Cloning from a mouse osteoblastic cell line of a set of transforming-growth-factor-beta 1-regulated genes, one of which seems to encode a follistatin-related polypeptide[J]. Eur J Biochem, 1993, 217(1):13-19. DOI:10.1111/j.1432-1033.1993.tb18212.x
[11] Shibanuma M, Mashimo J, Kuroki T, et al. Characterization of the TGF beta 1-inducible hic-5 gene that encodes a putative novel zinc finger protein and its possible involvement in cellular senescence[J]. J Biol Chem, 1994, 269(43):26767-26774. DOI:10.1007/s00109-010-0608-3
[12] Dabiri G, Tumbarello DA, Turner CE, et al. Hic-5 promotes the hypertrophic scar myofibroblast phenotype by regulating the TGF-beta1 autocrine loop[J]. J Invest Dermatol, 2008, 128(10):2518-2525. DOI:10.1038/jid.2008.90
[13] Tumbarello DA, Turner CE. Hic-5 contributes to epithelial-mesenchymal transformation through a RhoA/ROCK-dependent pathway[J]. J Cellular Physiol, 2007, 211(3):736-747. DOI:10.1002/jcp.20991
[14] Pignatelli J, Tumbarello DA,Schmidt RP, et al. Hic-5 promotes invadopodia formation and invasion during TGF-β-induced epithelial-mesenchymal transition[J]. J Cell Biol, 2012, 197(3):421-437. DOI:10.1083/jcb.201108143
[15] Xu Z, Shen MX, Ma DZ, et al. TGF-beta1-promoted epithelial-to-mesenchymal transformation and cell adhesion contribute to TGF-beta1-enhanced cell migration in SMMC-7721 cells [J]. Cell Res, 2003, 13(5):343-350. DOI:10.1038/sj.cr.7290179
[16] Calvisi DF, Pascale RM, Feo F. Epidermal growth factor-like repeats and discoidin I-like domains 3:a multifaceted oncoprotein at the crossroad of MAPK and TGF-beta pathways in human hepatocellular carcinoma[J]. Transl Cancer Res, 2016, 5(2):103-109. DOI:10.21037/tcr.2016.03.09
[17] Polyak K, Weinberg RA. Transitions between epithelial and mesenchymal states:acquisition of malignant and stem cell traits[J]. Nat Rev Cancer, 2009, 9(4):265-273. DOI:10.1038/nrc2620
[18] Tepass U, Truong K, Godt D, et al. Cadherins in embryonic and neural morphogenesis[J]. Nat Rev Mol Cell Biol, 2000, 1(2):91-100. DOI:10.1038/35040042
[19] An HT, Yoo S, Ko J.α-Actinin-4 induces the epithelial-to-mesenchymal transition and tumorigenesis via regulation of Snail expression and β-catenin stabilization in cervical cancer[J]. Oncogene, 2016, 35(45):5893-5904.DOI:10.1038/onc.2016.117
Lin Xu, Email:linxu@mail.fjmu.edu.cn
Hepatitis B spliced protein triggers TGFβ1-induced epithelial-mesenchymal transition via interaction with transforming growth factor beta-1-induced transcript 1 protein
CHEN Wan-nan, HUANG Jun-gao, LIANG Fei-fei, YAN Xiao-li, XUAN Dan-dan, LIN Xu
(KeyLaboratoryofMinistryofEducationforGastrointestinalCancer,KeyLaboratoryofFujianProvinceforTumorMicrobiology,SchoolofBasicMedicalSciences,FujianMedicalUniversity,Fuzhou350122,China)
To investigate the TGFβ1-induced epithelial-mesenchymal transition (EMT) of Huh7 hepatoma cells caused by interaction of hepatitis B spliced protein (HBSP) with transforming growth factor beta-1-induced transcript 1 protein (TGFβ1I1), coding region of HBSP was cloned into lentiviral expression vector. Huh7 hepatoma cells were infected by recombinant lentivirus packaged in 293T cells. Stable cell lines expressing HBSP or control cells were selected by puromycin. Cells were incubated with 5 ng/mL TGFβ1 for 24 h, and observed under contrast-phase microspcope. Then the whole cell lysates were collected for western blot analysis using specific antibodies against EMT markers including E-cadherin, N-cadherin, Claudin-1 and β-catenin. To evaluate the effects of HBSP-TGFβ1I1 interaction on EMT, TGFβ1-induced EMT marker transition, as well as cell invasion and migration were explored after knocking down of TGFβ1I1 by siRNA. Results showed that Huh7 cell lines expressing HBSP (Huh7-HBSP-flag-HIV) and control cell lines (Huh7-flag-HIV) were successfully established. Huh7-HBSP-flag-HIV cells lost their pebble-like shape and tight cell-cell adhesion and transformed into the mesenchymal-like cells in the presence of TGFβ1. Decreased expression level of epithelial marker of E-cadherin, Claudin-1, β-catenin, increased expression level of mesenchymal marker of N-cadherin, and enhanced migration and invasion abilities were observed in Huh7-HBSP-flag-HIV cells as compared to the control cells. Moreover, the changes of EMT markers and metastasis abilities of Huh7-HBSP-flag-HIV cells could be reversed when TGFβ1I1 was knocked down by siRNA. In conclusion, HBSP could promote hepatoma cell migration and invasion by triggering EMT via interaction with TGFβ1I1. Our findings highlight new insights for HBSP-induced HCC progression.
hepatitis B virus; RNA splicing; transforming growth factor beta-1-induced transcript 1 protein; epithelial-mesenchymal transition; metastasis
10.3969/j.issn.1002-2694.2017.04.003
国家自然科学基金青年基金项目 (No. 81201293);福建省卫生厅医学创新课题(No.2012-CX-14);福建省高校杰出青年科研人才培育计划(No. JA11104);国家卫生和计划生育委员会共建科学研究基金-福建省卫生教育联合攻关计划(No. WKJ-FJ-29);福建省高等学校新世纪优秀人才支持计划(No.JA13129);福建省卫生系统中青年骨干人才培养项目(No. 2014-ZQN-ZD-25)联合资助
林 旭:Email:linxu@mail.fjmu.edu.cn
福建医科大学基础医学院,消化道恶性肿瘤省部共建教育部重点实验室,福建省肿瘤微生物学重点实验室,福州 350122
Supported by the National Natural Science Foundation of China (No. 81201293), the Fujian Provincial Medical Innovation Project (No. 2012-CX-14), the Outstanding Young Researchers Training Plan of Fujian Province (No. JA11104), the Joint Research Program of Health and Planning Committee and Education Department of Fujian (No. WKJ-FJ-29), the New Century Talents Supporting Plan of Fujian Education Department (No. JA13129), and the Medical Elite Cultivation Program of Fujian (No. 2014-ZQN-ZD-25)
R373
A
1002-2694(2017)04-0305-07
2016-11-16 编辑:梁小洁
