低聚葡萄籽原花青素联合顺铂对A549细胞增殖及细胞周期的影响
2017-04-25连燕娜高丽萍
王 海,连燕娜,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
低聚葡萄籽原花青素联合顺铂对A549细胞增殖及细胞周期的影响
王 海,连燕娜,高丽萍*
(北京联合大学应用文理学院,生物活性物质与功能食品北京市重点实验室,北京 100083)
目的:探讨低聚葡萄籽原花青素(oligomer grape seed proanthocyanidins,O-GSP)联合顺铂(cisdichlorodiamineplatinum(Ⅱ),DDP)对A549细胞增殖、细胞周期及细胞周期相关蛋白表达的影响。方法:体外培养A549细胞,四甲基偶氮唑蓝法检测DDP和O-GSP单独及联合用药对A549细胞存活率的影响;流式细胞仪检测O-GSP联合DDP对A549细胞周期的影响;Western Blot检测促细胞周期相关蛋白CDK 4、Cyclin D1和p-Rb的表达。结果:DDP(≥5 mg/L)和O-GSP(≥16 mg/L)单独用药均对A549细胞增殖有抑制作用,且两者同时作用对细胞增殖抑制具有联合作用。5 mg/L DDP单独用药可以于S期阻滞A549细胞,4 mg/L O-GSP单独用药可以于G0/G1期阻滞A549细胞,两者联合可显著降低细胞周期调控蛋白CDK 4、Cyclin D1和p-Rb的表达(P<0.05)。结论:O-GSP可以联合DDP抑制A549细胞增殖,且这种联合作用与Cyclin D1-CDK 4-Rb通路介导的细胞周期调控有关。
低聚葡萄籽原花青素;顺铂;细胞增殖;细胞周期
肺癌是目前世界上发病率和死亡率极高的癌症之一,给人类的健康和生命带来了极大的威胁[1]。非小细胞肺癌患者占总肺癌患者的80%左右。与小细胞肺癌相比,由于非小细胞肺癌细胞生长分裂较慢,扩散转移相对较晚,诊断时多处于中晚期,错过了手术最佳治疗时机,因此化疗成为其主要治疗方式。自1978年被美国食品药品监督管理局批准使用以来[2],顺铂(cisdichlorodiamineplatinum(Ⅱ),DDP)已成为临床上应用最广泛的抗肿瘤药物之一,在多种癌症的治疗中取得了显著的疗效,如乳腺癌、肝癌、卵巢癌等[3-5]。DDP对肺癌的化疗效果也得到国内外一致认可[6]。但随着DDP的大量使用,患者也出现了明显的耐药性和毒副作用,如肾毒性、肝毒性和耳毒性等[7-9]。
葡萄籽原花青素是指从葡萄籽中提取的、由不同数量的结构单体(儿茶素、表儿茶素或表儿茶素没食子酸酯)缩合而成的聚合体的混合物[10],具有抗肿瘤、抗炎、抗辐射、保护心血管系统、抗衰老等广泛的药理学作用[11-14],尤其在抗肿瘤研究方面近年来备受关注,已有研究结果显示原花青素对多种癌细胞都有不同程度的抑制作用[15]。葡萄籽原花青素中活性较强的是聚合度≤4的低聚葡萄籽原花青素(oligomer grape seed proanthocyanidins,O-GSP)[16]。
本课题组前期研究结果表明,O-GSP对DDP所致的肾毒性、心肌毒性和生殖毒性具有很好的保护作用[17-19],但O-GSP与DDP是否具有联合抗癌作用至今鲜见报道,因此本研究初步探讨了O-GSP联合DDP对A549细胞增殖及细胞周期的影响,以期为临床上联合化疗药物的使用提供理论基础和实验依据。
1 材料与方法
1.1 材料与试剂
人肺腺癌细胞(A549)购自中国医学科学院基础医学研究所北京协和医学院基础学院细胞中心。
DDP(批号:406022CF)、注射用冻干粉剂 齐鲁制药有限公司;O-GSP(原花青素纯度≥95%,色谱级,其中二聚体纯度≥60%、原花青素B2纯度≥4%) 天津尖峰天然产物研究开发有限公司;杜氏改良Eagle培养基:营养混合物F-12(Dulbecco’s modif i ed Eagle medium: nutrient mixture F-12,DMEM/F12)培养基、0.25 g/100 mL胰酶、细胞周期试剂盒 美国G e n v i e w公司;胎牛血清 美国Hycolon公司;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT) 美国Sigma公司;Phospho-Rb抗体、Cyclin D1抗体 碧云天生物技术有限公司;CDK 4抗体 中杉金桥生物技术有限公司;β-actin抗体、辣根过氧化物酶标记上样抗兔(鼠)免疫球蛋白G(immunoglobulin G,IgG)、二辛可宁酸(bicinchonininc acid,BCA)蛋白浓度测定试剂盒 北京鼎国昌盛生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
酶标仪 美国Bio-Tek公司;FACS Calibar流式细胞仪 美国BD公司;电泳仪 美国Bio-Rad公司。
1.3 方法
② 刘坚,曹广顺,吴福祥.论诱发汉语词汇语法化的若干因素[J].中国语文,1995.(3).第161-168页.
1.3.1 O-GSP和DDP单独使用对A549细胞增殖的影响
将100 μL(1×105个/mL)处于对数生长期的细胞接种到96 孔板中,待细胞生长至融合状态时,弃原培养液,分别单独加入100 μL含0、5、7.5、10、15、20、25、30 mg/L DDP或0、4、8、16、32、64、128 mg/L O-GSP的无血清培养基,其中对照组的培养基中不加O-GSP或DDP,每组设 6 个复孔,在 37 ℃、含5% CO2和饱和湿度的孵育培养箱中培养24 h后,用酶标仪于570 nm波长处测定吸光度(A)。按照公式(1)计算细胞存活率。
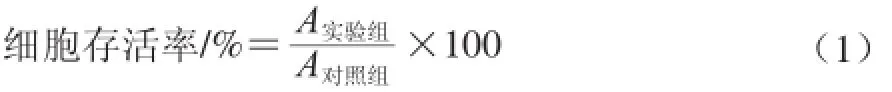
式中:A实验组为各加药组的吸光度;A对照组为对照组的吸光度。
1.3.2 O-GSP与DDP联合作用对A549细胞增殖的影响
将100 μL(1×105个/mL)处于对数生长期的细胞接种到96 孔板中,待细胞生长至融合状态时,将细胞分为对照组、单独用药组和联合用药组,按照预设浓度加药,联合用药组DDP质量浓度分别为0、5、10 mg/L,O-GSP质量浓度分别为0、4、8 mg/L。每组设6 个复孔,在 37 ℃、含5% CO2和饱和湿度的孵育培养箱中培养24 h后,测定细胞存活率。按照公式(1)计算细胞存活率。
1.3.3 O-GSP与DDP联合作用对A549细胞周期的影响
将2 mL(5×104个/mL)处于对数生长期的细胞接种到6孔板中,待细胞生长至融合状态时,对各处理组进行药物处理。细胞分为对照组、DDP组、O-GSP组和DDP+O-GSP组。除对照组,其余各组中DDP质量浓度为5 mg/L,O-GSP质量浓度为4 mg/L。在 37 ℃、含 5% CO2和饱和湿度的孵育培养箱中培养24 h,收集细胞后,按照试剂盒说明用70%乙醇4 ℃固定24 h,PI染色后用流式细胞仪进行检测分析。
1.3.4 O-GSP与DDP联合作用对A549细胞周期蛋白表达的影响
按照1.3.3节的方法对细胞进行分组处理后,每孔加入细胞裂解液200 μL,10 000 r/min离心10 min,BCA法测定总蛋白浓度,然后加入5×上样缓冲液,沸水浴10 min使蛋白变性。12%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)后,转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)转印膜上,5%脱脂牛奶封闭75 min,一抗4 ℃孵育过夜,二抗常温孵育75 min后,在凝胶成像系统曝光,按照公式(2)计算细胞周期相关蛋白CDK 4、Cyclin D1和p-Rb的相对表达量。

1.4 数据统计分析
2 结果与分析
2.1 O-GSP和DDP单独用药对A549细胞增殖的抑制作用

图1 DDP对A549细胞增殖的抑制作用(n=5)Fig. 1 Inhibitory effect of DDP on A549 cells (n=5)
由图1可知,随着DDP质量浓度的升高,A549细胞存活率逐渐降低,当DDP质量浓度高于25 mg/L时,所测吸光度不再随DDP质量浓度的升高而显著降低。通过SPSS软件计算,DDP对A549细胞的半抑制浓度(half maximal inhibitory concentration,IC50)值为10.68 mg/L。
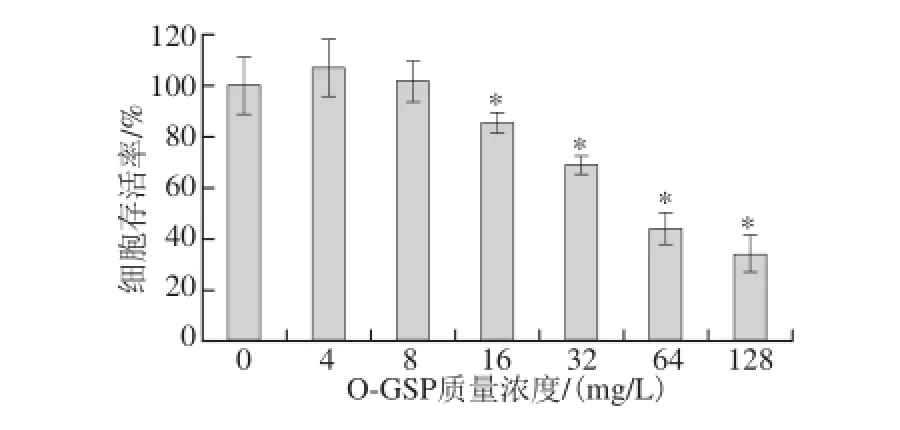
n=5)Fig. 2 Inhibitory effect of O-GSP on A549 cells (n = 5)图2 O-GSP对A549细胞增殖的抑制作用(
由图2可知,当O-GSP质量浓度<16 mg/L时,O-GSP对A549细胞存活率无显著性影响(P>0.05)。当O-GSP质量浓度≥16 mg/L时,A549细胞存活率显著低于对照组(P<0.05),说明O-GSP达到一定质量浓度时能够显著抑制A549细胞的增殖。
2.2 O-GSP与DDP联合用药对A549细胞增殖的抑制作用
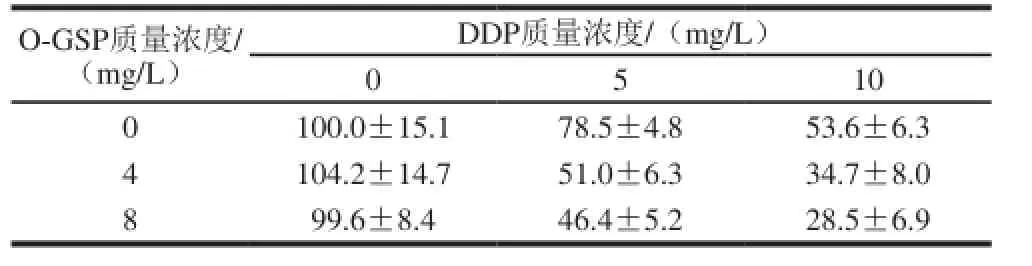
表1 O-GSP与DDP联合用药对A549细胞存活率的影响(n=5)Table 1 Effect of co-treatment with O-GSP and DDP on A549 cell survival (n= 5)

表2 析因分析结果Table 2 Results of factorial analysis
由表1可知,DDP单独用药于A549细胞时,能够抑制A549细胞的增殖,使细胞存活率显著降低(P<0.05)。由表2可知,当O-GSP和DDP共同作用于A549细胞时,其两者的互作效应对A549细胞的存活率也有显著性影响(P<0.05),结合表1中A549细胞存活率的变化,可知O-GSP和DDP对A549细胞增殖的抑制具有联合作用。DDP对A549细胞的1/2 IC50约为5 mg/L,且O-GSP质量浓度≥4 mg/L时,可以显著增强DDP对A549细胞的抑制作用,当DDP质量浓度为5 mg/L,O-GSP质量浓度为4 mg/L时,A549细胞存活率为(51.0±6.3)%,最接近50%。加药后细胞存活率太低,则在后期细胞进行流式检测时,细胞碎片太多,影响检测;细胞存活率太高,则较难检测出细胞损伤,因此选用此质量浓度用于后续实验。
2.3 O-GSP与DDP联合用药对A549细胞周期的影响


图3 O-GSP与DDP联合用药对A549细胞周期的影响Fig. 3 Effect of O-GSP combined with DDP on the cell cycle of A549 cells

表3 O-GSP与DDP联合用药对细胞周期中A549细胞比例的影响(n=5)Table 3 Effect of O-GSP combined with DDP on cell populations at different cell cycle phases (n= 5)
在细胞周期中,G0/G1期细胞的DNA含量为2 N(N:染色体组数,下同),含有双份基因组DNA的G2/M期细胞的DNA含量为4 N,而正在进行DNA复制的S期细胞的DNA含量理论上应在2~4 N之间。因此,可根据细胞中DNA含量的分布情况进行细胞周期分析。如图3和表3所示,与对照组细胞相比,DDP组G0/G1期细胞比例显著减少,S期细胞比例显著增大(P<0.05),说明DDP可将细胞周期阻滞在S期。而O-GSP组与对照组相比G0/G1期细胞比例显著增大,S期细胞比例显著减少(P<0.05),说明O-GSP可将细胞周期阻滞在G0/G1期。DDP与O-GSP同时作用于A549细胞后,G0/G1期细胞与DDP组相比显著增多,S期细胞比例与O-GSP组相比显著增加,G2/M期细胞比例与对照组相比显著减少(P<0.05)。说明O-GSP联合DDP作用后,既可以对A549细胞形成G0/G1期阻滞,又能形成S期阻滞,最终诱导细胞凋亡。
2.4 O-GSP与DDP联合用药对A549细胞周期蛋白表达的影响
为进一步证明O-GSP和DDP联合用药对A549细胞的周期阻滞作用,使用Western Blot分别检测促细胞周期相关蛋白CDK 4、Cyclin D1和p-Rb的表达。如表4所示,与对照组相比,DDP单独用药后,CDK 4和Cyclin D1蛋白表达量显著降低(P<0.05),而p-Rb的表达量显著升高(P<0.05)。O-GSP单独用药后,CDK 4、Cyclin D1和p-Rb的表达量均显著降低(P<0.05)。而DDP与O-GSP同时用药后,与对照组相比CDK 4、Cyclin D1和p-Rb的表达量均显著降低(P<0.05);与DDP组相比,Cyclin D1和p-Rb的表达量显著降低(P<0.05);与O-GSP组相比,Cyclin D1蛋白表达量显著降低(P<0.05)。说明O-GSP与DDP联合阻滞A549细胞周期可能与Cyclin D1-CDK 4-Rb通路介导的细胞周期调控有关。

表4 O-GSP与DDP联合用药对A549细胞周期蛋白表达的影响(n=5)Table 4 Effect of O-GSP combined with DDP on the expression levels of cell cycle-related proteins in A549 cells (n= 5)
3 讨 论
本课题组前期研究结果表明,O-GSP质量浓度为16 mg/L时,对DDP诱导的HEK293细胞损伤的保护作用最佳,与DDP损伤组有显著性差异(P<0.05)[20]。氧化应激是DDP造成肾毒性的主要原因,DDP含有的亲核氨基能够与水分子作用生产大量的自由基,造成线粒体的氧化损伤,功能丧失。另一方面,DDP可诱发机体抗氧化水平降低,DDP可通过直接或间接与GSH结合而引起细胞内GSH耗竭,同时还可抑制谷胱甘肽过氧化物酶、超氧化物歧化酶等的活力,使细胞内抗氧化能力减弱而引发氧化应激[21]。O-GSP拮抗DDP肾细胞损伤的机制可能与其拮抗DDP所致肾细胞氧化应激反应和线粒体损伤有关[19]。而O-GSP与DDP联合抗肿瘤机制还有待于进一步探讨。
DDP抗肿瘤作用机制主要是DDP进入细胞后,氯原子能够被水分子取代形成活化状态。活化后的DDP与DNA分子嘌呤碱的N7活性中心结合形成DNA链内或链间加合产物,从而造成癌细胞DNA损伤,最终诱导细胞凋亡[22]。O-GSP属于植物多酚类物质,研究表明,O-GSP具有很好的抗肿瘤作用,其作用机制包括促进肿瘤细胞凋亡、阻滞细胞周期、降低肿瘤细胞转移和扩散等[23-25]。本研究结果表明,单独使用O-GSP和DDP均可抑制A549细胞的增殖,且两者联用时对A549细胞增殖抑制具有联合作用。
细胞周期调控在细胞增殖和凋亡中起重要的作用。细胞周期可分为 G0/G1、S、G2/M 3 个阶段,其中在G1期与G2期细胞进行RNA的复制与有关蛋白质的合成,S期进行DNA的复制[26]。S期阻滞可以为细胞的受损DNA修复提供充足的时间,当损伤DNA超过细胞的修复或耐受极限时,S期检验点的关卡功能灵敏度就会降低,最终由于细胞内DNA损伤不能得到有效修复而导致细胞凋亡或死亡。有研究结果显示DDP可以使细胞产生S期阻滞,当用其他药物去除S期阻滞后,可增加DDP的毒性[27]。因此推测S期阻滞与癌细胞对DDP的耐药存在一定关系。本研究结果表明,DDP单独用药可以引起A549细胞S期阻滞,而O-GSP单独用药可以引起A549细胞G0/G1期阻滞,两者联用后既可以对A549细胞形成G0/G1期阻滞,又能形成S期阻滞。提示DDP和O-GSP对细胞周期的联合阻滞作用进一步抑制了细胞增殖。
细胞周期的调控有外源性和内源性调控,外源性调控主要是由外界刺激引起的,在细胞周期内源性调控中,细胞周期蛋白(Cyclin)和细胞周期蛋白依赖激酶(CDKs)具有关键性的调控作用[28]。Cyclin D1蛋白被认为是一种原癌基因表达的蛋白,在人类多种肿瘤组织中高表达或有突变。Rb是一种抑癌基因表达的蛋白,可以通过调控细胞周期G1期的检验点来调节细胞增殖。Rb蛋白的活性通过其磷酸化水平来调控。Cyclin D1-CDK 4-Rb通路在调控细胞周期的过程中起到关键作用[29]。Cyclin D1和CDK 4结合形成复合物后,能够使Rb蛋白磷酸化形成p-Rb,进而促进S期所需基因的转录,使细胞由G0/G1期转化到S期[30]。本研究结果显示,DDP虽然可以使A549细胞中Cyclin D1和CDK 4蛋白水平下降,但却使p-Rb蛋白水平升高,促进了细胞由G0/G1期向S期转化。由于DDP又能形成DNA损伤,DNA复制过程受阻,从而使细胞形成了S期阻滞。与对照组相比,O-GSP单独用药后可以使Cyclin D1、CDK 4和p-Rb的蛋白表达水平均显著降低,细胞形成G0/G1期阻滞。而DDP与O-GSP联合用药后,Cyclin D1、CDK 4和p-Rb蛋白表达水平降低幅度更大,说明O-GSP降低了DDP引起的p-Rb蛋白表达水平的升高。然而,DDP升高p-Rb蛋白表达水平的通路以及此通路与Cyclin D1-CDK 4-Rb通路的关系还有待进一步研究。
综上,本研究显示,O-GSP与DDP联合作用可以增强DDP对A549细胞的杀伤作用,且这种联合作用与Cyclin D1-CDK 4-Rb通路介导的细胞周期调控有关。该研究可为临床上化疗联合用药提供一定的参考。
[1] YOULDEN D R, CRAMB S M, BAADE P D. The international epidemiology of lung cancer: geographical distribution and secular trends[J]. Journal of Thoracic Oncology, 2008, 3(8): 819-831. DOI:10.1097/JTO.0b013e31818020eb.
[2] KELLAND L. The resurgence of platinum-based cancer chemotherapy[J]. Nature Reviews Cancer, 2007, 7(8): 573-584. DOI:10.1038/nrc2167.
[3] LEONE R, BENONI G, APOSTOLI P, et al. Two-cycle cisplatin kinetics in patients with ovarian and mammary cancer[J]. Therapeutic Drug Monitoring, 1987, 9(4): 374-377.
[4] CAVANNA L, BODINI F C, STROPPA E M, et al. Advanced gastric cancer with liver and lymph node metastases successfully resected after induction chemotherapy with docetaxel, cisplatin and 5-f l uorouracil[J]. Chemotherapy, 2014, 60(4): 224-227. DOI:10.1159/000375156.
[5] XIA Lingfang, WEN Hao, HAN Xiaotian, et al. Luteinizing hormone inhibits cisplatin-induced apoptosis in human epithelial ovarian cancer cells[J]. Oncology Letters, 2016, 11(3): 1943-1947. DOI:10.3892/ ol.2016.4122.
[6] ABRAMS T J, LEE L B, MURRAY L J, et al. SU11248 inhibits KIT and platelet-derived growth factor receptor beta in preclinical models of human small cell lung cancer[J]. Molecular Cancer Therapeutics, 2003, 2(5): 471-478.
[7] 丁大连, 亓卫东, 张梅, 等. 顺铂及其耳毒性[J]. 中华耳科学杂志, 2008, 6(2): 125-133. DOI:10.3969/j.issn.1672-2922. 2008.02.001.
[8] 李革新, 金亚平, 陆春伟, 等. 顺铂肝毒性的实验研究[J]. 中国工业医学杂志, 2005, 18(6): 352-353. DOI:10.3969/j.issn.1002-221X.2005.06.014.
[9] 赵艳萌, 高丽萍, 郭卓雨. 顺铂诱发肾毒性机制的研究进展[J]. 广东医学, 2013, 34(23): 3679-3681. DOI:10.13820/j.cnki. gdyx.2013.23.032.
[10] 李春阳, 张红城, 王乃富, 等. 葡萄籽原花青素的单元结构[J].江苏农业学报, 2010, 26(5): 1070-1077. DOI:10.3969/ j.issn.1000-4440.2010.05.031.
[11] LUAN Yunyan, LIU Zimin, ZHONG Jinyi, et al. Effect of grape seed proanthocyanidins on tumor vasculogenic mimicry in human triple-negative breast cancer cells[J]. Asian Pacif i c Journal of Cancer Prevention, 2015, 16(2): 531-535.
[12] 颜小梅, 杨光, 马媛, 等. 葡萄籽原花青素对老年病的预防作用研究进展[J]. 食品科学, 2014, 35(21): 339-343. DOI:10.7506/spkx1002-6630-201421064.
[13] PONS Z, GUERRERO L, MARGALEF M, et al. Effect of low molecular grape seed proanthocyanidins on blood pressure and lipid homeostasis in cafeteria diet-fed rats[J]. Journal of Physiology and Biochemistry, 2014, 70(2): 629-637. DOI:10.1007/s13105-014-0329-0.
[14] SHAO Z, VANDEN H T, LI C Q, et al. Synergistic effect of Scutellaria baicalensis and grape seed proanthocyanidins on scavenging reactive oxygen species in vitro[J]. American Journal of Chinese Medicine, 2004, 32(1): 89-95. DOI:10.1142/ S0192415X04001722.
[15] 江海洋, 张华. 葡萄籽原花青素的研究进展[J]. 临床误诊误治, 2012, 25(11): 97-100. DOI:10.3969/j.issn.1002- 3429.2012.11.038.
[16] 郭磊, 杨静玉, 王芳, 等. 葡萄籽提取物化学成分及药理活性的研究进展[J]. 沈阳药科大学学报, 2008, 25: 32-34.
[17] 郭培培, 郭卓雨, 赵艳萌, 等. 葡萄籽原花青素对顺铂导致H9c2细胞毒性的保护作用[J]. 食品科学, 2014, 35(3): 213-216. DOI:10.7506/ spkx1002-6630-201403043.
[18] 连燕娜, 张海莲, 赵江燕, 等. 顺铂诱发大鼠睾丸毒性的机制及葡萄籽原花青素的防护作用[J]. 食品科学, 2015, 36(15): 189-194. DOI:10.4506/spkx1002-6630-201515035.
[19] 赵艳萌, 赵江燕, 高丽萍. 葡萄籽原花青素对顺铂所致大鼠肾脏氧化损伤和线粒体损伤的防护作用[J]. 现代食品科技, 2015, 31(1): 6-10. DOI:10.13982/j.mfst.1673-9078.2015.1.002.
[20] 连燕娜, 高丽萍, 郭豫, 等. 低聚体葡萄籽原花青素对顺铂损伤HEK293细胞及抗癌活性的影响[J]. 食品科学, 2016,37(7): 182-186. DOI:10.7506/spkx1002-6630-201607033.
[21] 李贞, 高丽萍. 氧化应激在顺铂肾毒性中的作用[J]. 广东医学, 2010(19): 2600-2602. DOI:10.3969/j.issn.1001- 9448.2010.19.052.
[22] DASARI S, TCHOUNWOU P B. Cisplatin in cancer therapy: molecular mechanisms of action[J]. European Journal of Pharmacology, 2014, 740: 364-378. DOI:10.1016/ j.ejphar.2014.07.025.
[23] MA Jia, FANG Binbin, ZENG Fanpeng, et al. Grape seed proanthocyanidins extract inhibits pancreatic cancer cell growth through down-regulation of miR-27a expression[J]. Journal of Central South University(Medical Sciences), 2015, 40(1): 46-52. DOI:10.11817/j.issn.1672-7347.2015.01.008.
[24] PUNATHIL T, KATIYAR S K. Inhibition of non-small cell lung cancer cell migration by grape seed proanthocyanidins is mediated through the inhibition of nitric oxide, guanylate cyclase, and ERK1/2[J]. Molecular Carcinogenesis, 2009, 48(3): 232-242. DOI:10.1002/mc.20473.
[25] VAID M, KATIYAR S K. Grape seed proanthocyanidins inhibit cigarette smoke condensate-induced lung cancer cell migration through inhibition of NADPH oxidase and reduction in the binding of p22(phox) and p47(phox) proteins[J]. Molecular Carcinogenesis, 2015, 54(Suppl 1): 61-71. DOI:10.1002/mc.22173.
[26] 高燕, 林莉萍, 丁健. 细胞周期调控的研究进展[J]. 生命科学, 2005, 17(4): 318-322. DOI:10.3969/j.issn.1004-0374.2005.04.009.
[27] EASTMAN A, KOHN E A, BROWN M K, et al. A novel indolocarbazole, ICP-1, abrogates DNA damage-induced cell cycle arrest and enhances cytotoxicity: similarities and differences to the cell cycle checkpoint abrogator UCN-01[J]. Molecular Cancer Therapeutics, 2002, 1(12): 1067-1078.
[28] 卢梦玲, 闫超, 赖多, 等. Cyclin D1与细胞周期调控[J]. 生物技术通报, 2011, 27(10): 55-59. DOI:10.13560/j.cnki.biotech. bull.1985.2011.10.025.
[29] MARZEC M, KASPRZYCKA M, LAI R, et al. Mantle cell lymphoma cells express predominantly cyclin D1a isoform and are highly sensitive to selective inhibition of CDK4 kinase activity[J]. Blood, 2006, 108(5): 1744-1750. DOI:10.1182/blood- 2006-04-016634.
[30] 范祖森, 敖世洲. 肿瘤抑制基因Rb与细胞周期调控研究新进展[J].生物化学与生物物理进展, 1999, 26(5): 429-433. DOI:10.3321/ j.issn:1000-3282.1999.05.005.
Effect of Oligomeric Proanthocyanidins from Grape Seeds Combined with Cisplatin on A549 Cell Proliferation and Cell Cycle
WANG Hai, LIAN Yanna, GAO Liping*
(Beijing Municipal Key Laboratory of Biologically Active Substances and Functional Food, College of Arts and Science, Beijing Union University, Beijing 100083, China)
Objective: To investigate the effect of oligomeric proanthocyanidins from grape seeds (O-GSP) combined with cisplatin (DDP) on the proliferation, cell cycle and cell cycle-related protein expression of A549 cells. Methods: A549 cells were cultured in vitro. The effects of DDP and O-GSP alone and in combination on the survival rate of A549 cells were observed by MTT assay; the combined effect of O-GSP and DDP on the cell cycle of A549 cells was detected by fl ow cytometry and the expression levels of the cell cycle-related proteins CDK 4, Cyclin D1 and p-Rb were detected by Western blot. Results: DDP (≥ 5 mg/L) and O-GSP (≥16 mg/L) treatments alone could inhibit A549 cell proliferation. The combined treatment had a synergistic effect on the inhibition of cell proliferation. DDP treatment alone at 5 mg/L arrested A549 cells at S phase and O-GSP at 4 mg/L arrested the cells at G0/G1phase. The combination of DDP at 5 mg/L and O-GSP at 4 mg/L significantly reduced the expression levels of the cell cycle regulatory proteins CDK 4, Cyclin D1 and p-Rb. Conclusion: DDP can inhibit the proliferation of A549 cells in combination with O-GSP through a mechanism related to the regulation of cell cycle progression mediated by the Cyclin D1-CDK 4-Rb pathway.
oligomeric proanthocyanidins from grape seeds; cisplatin; cell proliferation; cell cycle
10.7506/spkx1002-6630-201707034
Q946.8
A
1002-6630(2017)07-0213-06
王海, 连燕娜, 高丽萍. 低聚葡萄籽原花青素联合顺铂对A549细胞增殖及细胞周期的影响[J]. 食品科学, 2017, 38(7): 213-218. DOI:10.7506/spkx1002-6630-201707034. http://www.spkx.net.cn
WANG Hai, LIAN Yanna, GAO Liping. Effect of oligomeric proanthocyanidins from grape seeds combined with cisplatin on A549 cell proliferation and cell cycle[J]. Food Science, 2017, 38(7): 213-218. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201707034. http://www.spkx.net.cn
2016-04-12
北京市自然科学基金资助项目(7163211)
王海(1992—),男,硕士研究生,研究方向为生物活性物质对机体的生化作用。E-mail:916319176@qq.com
*通信作者:高丽萍(1962—),女,教授,博士,研究方向为生物活性物质对机体的生化作用。E-mail:gaolip62@163.com
