冬凌草甲素诱导小鼠肝癌细胞醌还原酶活性及其机理研究
2017-04-25陈忠正刘杏宜林晓蓉张媛媛
王 佐,王 璐,陈忠正*,劳 扬,刘杏宜,高 雄,燕 妮,林晓蓉,张媛媛,李 斌*
(华南农业大学食品学院,广东 广州 510642)
冬凌草甲素诱导小鼠肝癌细胞醌还原酶活性及其机理研究
王 佐,王 璐,陈忠正*,劳 扬,刘杏宜,高 雄,燕 妮,林晓蓉,张媛媛,李 斌*
(华南农业大学食品学院,广东 广州 510642)
为筛选鉴定出溪黄草中抗癌活性组分,本研究以溪黄草为材料得到乙酸乙酯提取物,通过硅胶柱层析、半制备色谱分离纯化,利用小鼠肝癌细胞Hepa1c1c7体外模型测定分离产物对细胞存活率和醌还原酶(quinone reductase,QR/NAD(P)H: reductase 1,NQO1)诱导活性。通过核磁共振、质谱分析鉴定组分结构;采用细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)、磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)、丝裂原活化蛋白激酶(mitogen activated protein kinases,MAPK)p38、蛋白激酶C(protein kinase C,PKC)和c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)5 种蛋白激酶的特异性抑制剂,确定冬凌草甲素诱导QR活性的信号转导通路,采用实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)和Western blot法分别检测NQO1的mRNA和蛋白表达情况。结果:1)从溪黄草中筛选鉴定出一较强诱导QR活性组分为冬凌草甲素;2)冬凌草甲素质量浓度为0.94 μg/mL时,即可诱导QR活性倍增;3)PI3K抑制剂处理显著抑制冬凌草甲素诱导的QR活性,而ERK抑制剂处理显著促进冬凌草甲素诱导的QR活性,但PKC、p38和JNK抑制剂处理对冬凌草甲素诱导的QR活性无明显影响;4)冬凌草甲素显著提高细胞内NQO1的mRNA和蛋白表达水平。结论:溪黄草中的冬凌草甲素具有抗癌活性,其抗癌活性通过提高Hepa1c1c7细胞中NQO1基因的转录及翻译水平以增加QR活性实现,并且其抗癌功能主要通过激活PI3K通路、抑制ERK通路进行信号传导。研究结果为深入开展溪黄草和冬凌草甲素的癌症化学预防研究奠定前期理论基础。
溪黄草;冬凌草甲素;醌还原酶;Hepa1c1c7细胞株;信号通路
随着环境污染的日益严重和人们生活习惯的改变,癌症已成为世界范围内引起死亡的主要原因[1]。1991年哥伦比亚大学癌症研究中心Weinstein[2]指出,30%以上的癌症是可以预防的。Sporn[3]首次提出癌症化学预防的概念,即:在饮食和药物治疗中加入某些天然或合成化学物质,通过逆转或延迟癌症发生的各个阶段来降低癌症的发生。机体在各阶段都形成了预防细胞发生癌变的代谢体系,主要包括Ⅰ相代谢和Ⅱ相代谢体系。Ⅰ相代谢可能活化某些致癌物前体,而Ⅱ相代谢能够使致癌物彻底解毒失活。参与Ⅱ相代谢过程的酶统称为Ⅱ相酶,常见的Ⅱ相酶包括醌还原酶。醌还原酶(quinone reductase,QR/NAD(P)H: reductase 1,NQO1)是一种黄素蛋白酶,它以NADP(H)为受体,催化醌类及其衍生物失去两个电子,从而保护细胞免受醌类物质代谢过程中产生的活性氧及亲电物质的损伤[4-5]。由于QR催化的反应底物非常广泛,具有与其他Ⅱ相酶协同增效的作用,对诱导剂具有良好的响应性,所以其活性被认为是癌症化学预防的重要指标,被广泛用作筛选诱导Ⅱ相酶活性物质的生物标记物[6],因此从天然植物中筛选具有较强诱导QR活性组分对癌症化学预防具有重要意义。对于QR代谢,核转录E2相关因子2-Kelch样ECH相关蛋白1-抗氧化反应元件(nuclear factor erythroid-2 related factor 2-Kelch-like ECH-associated protein 1-antioxidant response element,Nrf2-Keap1-ARE)是最主要的信号通路[3]。该信号通路包括抗氧化反应元件(antioxidant response element,ARE)、核转录E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)和Kelch样ECH相关蛋白 l(Kelch-like ECH-associated protein l,Keap1)。在正常生理条件下,Nrf2被Keap1锚定于细胞质中,处于不断降解的非活性状态,Nrf2的激活依赖于蛋白磷酸化作用,而这些蛋白磷酸化作用主要受蛋白激酶的调控。Nrf2被激活后与Keap1解离并入核积累,参与QR表达调控。目前研究中对QR代谢起调控作用的蛋白激酶主要有:丝裂原活化蛋白激酶家族(mitogen-activated protein kinases,MAPKs)、PKC和PI3K[7],其中MAPKs包括3 个主要亚族:细胞外信号调节蛋白激酶(extracellular signal-regulated kinase,ERK)、 c-Jun N-末端激酶(c-Jun N-terminal kinase,JNK)、p38[8]。天然活性成分诱导QR作用也体现在促进NQO1基因转录翻译方面[9-11]。由于诱导QR活性是细胞内多通路共同作用的复杂过程,因此研究QR代谢信号转导通路和NQO1基因转录翻译以预防癌症的发生具有积极意义。
溪黄草Rabdosia serra (Maxim) Hara是唇形科香茶菜属植物干燥的地上部分,主产于广东、福建、广西和江西等地[12],主要含有萜类、黄酮类、挥发油、甾醇类、微量元素、香豆素类、酚类等多种化学成分[13]。已有研究发现溪黄草具有抗癌、抗炎、抑菌、抗病毒[14-17]等多种功效。
本研究以溪黄草为材料,利用小鼠肝癌细胞Hepa1c1c7体外模型,通过提取、分离纯化,对分离产物测定细胞存活率和QR诱导活性,筛选出具有较强诱导QR活性组分,并通过核磁共振、质谱分析鉴定其结构。采用ERK抑制剂(PD98059)、PI3K抑制剂(Wortmannin)、p38抑制剂(SB203580)、PKC抑制剂(Gö6983)和JNK抑制剂(SP600125)5 种特异性蛋白激酶抑制剂确定诱导QR活性的信号转导通路,采用实时定量聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)和Western blot法分别检测NQO1的mRNA和蛋白表达水平,为从天然植物中筛选抗癌组分并研究其作用机理以预防癌症的发生提供研究基础。
1 材料与方法
1.1 材料与试剂
溪黄草 广州采芝林药业;冬凌草甲素标准品(纯度≥98%) 北京普博欣生物科技有限公司;小鼠肝癌细胞Hepa1c1c7 美国模式培养物储存库。
α-MEM培养基、胰蛋白酶、胎牛血清、青霉素和链霉素、杜尔贝科磷酸盐缓冲盐水(dulbecco phosphatebuffered saline,DPBS) 美国Life公司;四甲基偶氮唑蓝、甲萘醌、6-磷酸葡萄糖、6-磷酸葡萄糖脱氢酶、洋地黄皂苷 美国Sigma公司;结晶紫 美国Genview公司;柱层析硅胶粉(200~300 目) 青岛谱科试剂有限公司;细胞总蛋白抽提试剂盒 上海碧云天生物技术研究所;聚氰基丙烯酸正丁酯(bicinchonininc acid,BCA)蛋白浓度测定试剂盒、封闭液、辣根过氧化物酶标记的山羊抗兔抗体 美国Thermo公司; NQO1的兔抗小鼠抗体 美国Abcam公司;β-actin兔抗小鼠抗体、ERK1/2抑制剂(PD98059) 美国Cell Signaling Technology公司;PI3K抑制剂(Wortmannin)、p38抑制剂(SB203580)、PKC抑制剂(Gö6983)、JNK抑制剂(SP600125) 美国Merck公司;Trizol提取试剂盒、4S Red Plus核酸染色剂、琼脂糖、第一链cDNA合成试剂盒上海生工生物有限公司;活性炭、乙酸乙酯、石油醚均为国产分析纯。
1.2 仪器与设备
Spectra Max Plus酶标仪 美国Molecular Devices公司;HERAcell 150i CO2培养箱 美国Thermo公司;Ckx41显微镜 日本Olympus公司;LC300高效液相色谱仪 北京创新通恒科技有限公司; 1200高效液相色谱仪、6430质谱仪 美国Agilent公司;AV 600核磁共振仪 瑞士Bruker Biospin AG公司;PCR反应扩增仪、垂直电泳仪、电转漕 美国Bio-Rad公司;OmegaLumG自动化学发光仪 美国Aplegen公司;Stepone Plus型荧光定量PCR仪 美国ABI公司。
1.3 方法
1.3.1 溪黄草抗癌组分提取分离
1.3.1.1 溪黄草乙酸乙酯提取和硅胶柱层析分离
用乙酸乙酯溶剂提取溪黄草样品,旋转蒸发浓缩、氮吹干燥制成初提取样品。取初提取样品5 g,乙酸乙酯溶解,加入15 g硅胶吸附。用6 cm×60 cm层析柱进行分离,干法上样,以石油醚-乙酸乙酯体积比1∶1湿法装柱,采用体积比1∶1、1∶3、1∶5以及0∶1的石油醚-乙酸乙酯体系依次梯度洗脱、收集。于254 nm波长处测定吸光度,分别浓缩、干燥。
1.3.1.2 溪黄草硅胶柱层析产物半制备色谱分离纯化
色谱柱为Z O R B A X E c l i p s e X D B-C18(9.4 mm×250 mm,5 µm);流动相为甲醇和水;进样量50 µL;流速2 mL/min;柱温40 ℃;检测波长254 nm。甲醇-水体积比1∶1洗脱20 min后,变为甲醇-水体积比17∶3洗脱。
1.3.2 溪黄草抗癌组分结构鉴定
1.3.2.1 溪黄草半制备色谱分离产物高效液相色谱分析
取样品0.1 mg,溶于1 mL色谱级甲醇中,0.22 µm滤头过滤。色谱条件:色谱柱ZORBAX SB-C18(4.6 mm×150 mm,5 µm);流动相为甲醇和水;进样量10 µL;流速1 mL/min;柱温40 ℃;检测波长254 nm。甲醇-水体积比11∶9洗脱30 min后,变为甲醇-水体积比14∶6洗脱。
1.3.2.2 溪黄草半制备色谱分离产物核磁共振、质谱分析
称取样品7 mg,用0.5 mL氘代甲醇溶解,采用AV 600核磁共振仪进行氢谱、碳谱扫描。称取样品0.1 mg,用1 mL甲醇溶解,并用0.22 μm的滤头过滤,质谱离子源为正离子ESI扫描,进样量5 µL。
1.3.3 细胞培养
小鼠肝癌细胞Hepa1c1c7经解冻复苏后,培养于37 ℃、5% CO2的细胞培养箱中,培养液为89% α-MEM培养基、10%胎牛血清(经热处理和活性炭吸附)、1%青霉素(100 U/mL)和链霉素(100 μg/mL),每3~4 d继代一次。
1.3.4 诱导QR活性测定
参照Prochaska等[18]的方法。接种细胞:取Hepa1c1c7细胞接种于96 孔板,5×103个细胞/孔,于37 ℃、含5% CO2培养箱中培养24 h;加样:弃去旧培养液后,含抑制剂预处理组先添加含不同质量浓度抑制剂的新鲜培养液150 μL/孔,预处理3 h后弃去,再添加含有1.25 μg/mL冬凌草甲素的新鲜培养液,150 μL/孔培养48 h;非抑制剂预处理组直接添加含不同质量浓度的溪黄草分离组分或1.25 μg/mL冬凌草甲素的新鲜培养液,150 μL/孔培养48 h;测定:弃去旧培养液,每孔加50 μL的0.08 g/100 mL洋地黄皂苷(含2 mmol/mL乙二胺四乙酸溶液),轻微振荡30 min。用酶标仪测定490 nm波长处10 min内反应液中噻唑蓝吸光度,绘制动力学曲线。另备份一块96 孔板,弃掉旧培养液,结晶紫溶液染色15 min,弃去;十二烷基硫酸钠溶解1 h,用酶标仪测定610 nm波长处吸光度。样品的相对QR诱导活性用CD值(concentration to double relative QR specif i c activity)表示,定义为使相对QR诱导活性值达到倍增时对应的样品质量浓度;以细胞活力(cell viability,CV)>0.5(即IC50>50%)和相对QR活性≥2作为样品具有QR诱导活性的筛选指标,测定样品重复2 次以上。
1.3.5 定量PCR检测mRNA表达水平
接种细胞:取Hepa1c1c7细胞接种于6 孔板,5×105个细胞/孔,于37 ℃、含5% CO2的培养箱中培养24 h;加样:弃去旧培养液,添加含不同质量浓度冬凌草甲素的新鲜培养液,2 mL/孔,培养48 h;总RNA提取:弃去旧培养液后,用Trizol提取试剂盒提取细胞总RNA,紫外分光光度计分别测定OD260nm及OD280nm,要求OD260nm/OD280nm比值介于1.8~2.0,根据OD260nm计算总RNA含量,-80 ℃保存备用;逆转录反应:按试剂盒说明,在PCR管中加入RNA 800 ng和随机引物p(dN)6(0.2 μg/μL)1 μL,用不含RNA酶的双蒸水定容至13 μL;70 ℃温浴5 min,冰浴10 s,离心后加入5×反应缓冲液4 μL、dNTP混合液(10 mmol/L)2 μL、RNA酶抑制剂(20 U/μL)1 μL、AMV反转录酶(10 U/μL)2 μL;37 ℃温浴5 min,42 ℃温浴60 min,70 ℃温浴10 min后终止反应,将上述溶液-20 ℃保存;荧光定量PCR检测:采用Primer Premier 5.0软件设计NQO1、GADPH基因的引物序列,具体见表1,并由生工生物工程(上海)股份有限公司合成引物;PCR反应体系为2×SybrGreen qPCR Master Mix 10 μL、Template (cDNA)7.2 μL、10 μmol/L的FP和RP各0.4 μL,加双蒸水定容至20 μL;PCR反应条件为95 ℃预变性3 min,随后95 ℃变性7 s,57 ℃退火10 s,共40 个循环。

表1 目的基因和内参基因PCR引物序列Table 1 PCR primer sequences for target gene and reference gene
1.3.6 Western blot法检测蛋白表达量
接种细胞:取Hepa1c1c7细胞接种于6 孔板,5×105个细胞/孔,于37 ℃、含5% CO2的培养箱中培养24 h;加样:弃去旧培养液,添加含不同浓度冬凌草甲素的新鲜培养液,2 mL/孔,按实验所需培养一定时间;收集细胞总蛋白:取出培养板弃去培养基,用磷酸盐缓冲液洗3 遍,用细胞刮刀刮下细胞并离心收集细胞后,每孔加入200 μL添加了苯甲基磺酰氟(1 mmol/L)的细胞裂解液,充分裂解后,14 000×g离心5 min,取上清液即为抽提得到的细胞总蛋白;蛋白浓度定量:将BCA试剂A与B按50∶1的比例混合,配制成BCA工作液;取适当体积样品到96 孔板的样品孔中,每孔加入200 μL BCA工作液,混匀,37 ℃放置30 min;取出96 孔板,562 nm波长处测定吸光度,根据牛血清白蛋白标准曲线计算出各样品的蛋白浓度;检测蛋白表达:将蛋白抽提液与上样缓冲液按体积比4∶1混合,沸水浴5 min后,-80 ℃贮存备用;采用聚丙烯酰氨凝胶电泳法,按照实验需要先后配制分离胶和浓缩胶;取蛋白样品各20 μg上样,电压90 V电泳40 min后转换电压120 V电泳150 min;在200 mA条件下转膜45 min将蛋白转印至PVDF膜上,用Western blot缓冲溶液漂洗3 次(每次5 min)后,将PVDF膜置于封闭液中室温封闭2 h;将膜置于含稀释后一抗的封闭液中(一抗的与封闭液的比例为1∶2 000,后同),4 ℃孵育过夜;洗膜后加入TBST溶液稀释的辣根过氧化物酶标记的二抗(1∶20 000),室温孵育2 h,洗膜后显影,采用自动化学发光仪进行扫描并记录条带光密度值。
1.4 数据统计分析
采用SPSS 19.0软件进行差异显著性分析;采用ABI 7500 system SDS Software 1.4进行荧光定量PCR数据处理,以GADPH为内参基因,采用2-△△Ct法计算基因转录的相对变化;采用FluorChem进行蛋白质条带光密度值积分,以β-actin为内参蛋白做相对定量分析。
2 结果与分析
2.1 溪黄草抗癌组分提取分离
2.1.1 溪黄草乙酸乙酯提取物抗癌活性

图1 溪黄草乙酸乙酯提取物诱导QR活性Fig. 1 Induction of QR activity by ethyl acetate extracts from Rabdosia serra (Maxim) Hara
采用乙酸乙酯提取溪黄草,利用小鼠肝癌细胞Hepa1c1c7进行相对QR活性测定结果由图1可知,溪黄草乙酸乙酯提取物在7.81~15.63 µg/mL质量浓度范围内相对QR活性倍增。表明溪黄草此提取物具有较强的抗癌活性,进而对该提取物进行分离纯化。
2.1.2 溪黄草硅胶柱层析分离产物及抗癌活性
溪黄草乙酸乙酯提取物经硅胶柱层析分离纯化,以石油醚-乙酸乙酯体系梯度洗脱,根据每管在254 nm波长处的吸光度绘制变化曲线,收集合并馏分依次标记为F1~F5,5 组分经诱导QR活性测定均具有抗癌活性,其诱导QR活性达到倍增的质量浓度均在1.56~6.25 µg/mL范围内,其中组分F5的抗癌活性最强,为分离得到强抗癌活性单体,故本研究选择组分F5继续分离纯化。
2.1.3 溪黄草F5组分半制备柱分离产物及抗癌活性
溪黄草F5组分经半制备色谱分离,收集其中5 个峰的组分,标记为F5-1~F5-5(图2),5 个组分诱导QR活性测定结果见图3。除F5-1和F5-5外,其余3 个组分均具有强的抗癌活性,其诱导QR达到倍增的质量浓度均为1.56~3.13 µg/mL。其中F5-3抗癌活性最强,为明确强抗癌活性单体分子结构,本研究选择F5-3进行结构鉴定。
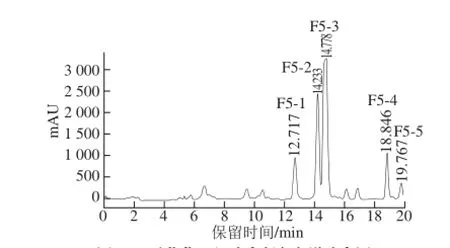
图2 溪黄草F5组分半制备色谱分离图Fig. 2 Semi-preparative chromatographic analysis of F5 from Rabdosia serra (Maxim) Hara

图3 溪黄草半制备色谱分离产物诱导QR活性Fig. 3 Induction of QR activity by isolated fractions with semipreparative chromatography from Rabdosia serra (Maxim) Hara
2.2 溪黄草抗癌组分结构鉴定
2.2.1 溪黄草抗癌组分HPLC结果分析

图4 溪黄草F5-3组分HPLC分析图谱Fig. 4 High performance liquid chromatographic analysis of F5-3 from Rabdosia serra (Maxim) Hara
对溪黄草半制备色谱分离的F5-3进行HPLC分析,监测其在254 nm波长处的出峰情况(图4),发现F5-3的峰比较单一,初步推断其纯度相对较高。因此,对F5-3进行了核磁共振、质谱分析,从而鉴定其结构。
2.2.2 溪黄草F5-3核磁共振、质谱分析结果
溪黄草F5-3的1H核磁共振、13C核磁共振图谱如图5、6所示,根据质子和碳原子在一定条件下所固有的化学位移值和积分曲线高度,结合溪黄草化学成分波谱数据的相关文献报道[19],初步推测该化合物为冬凌草甲素,其分子式为C20H28O6。进一步对溪黄草F5-3进行质谱分析,结果如图7所示。经解谱分析F5-3的相对分子质量为364,与冬凌草甲素的相对分子质量相同。故此鉴定溪黄草F5-3为冬凌草甲素,其结构式见图8。

H-NMR图谱Fig. 51H-NMR analysis of F5-3 from Rabdosia serra (Maxim) Hara图5 溪黄草F5-3组分1

C-NMR图谱Fig. 613C-NMR analysis of F5-3 from Rabdosia serra (Maxim) Hara图6 溪黄草F5-3组分13
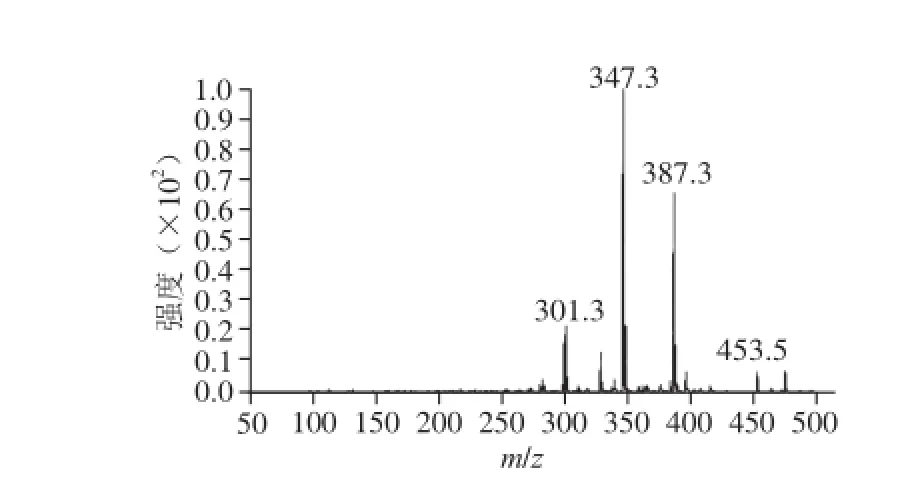
图7 溪黄草F5-3组分质谱图Fig. 7 Mass spectrum of F5-3 from Rabdosia serra (Maxim) Hara

图8 冬凌草甲素分子结构式Fig. 8 Molecular structure of oridonin
2.3 冬凌草甲素抗癌机理研究
2.3.1 冬凌草甲素诱导QR活性的信号转导通路
为进一步研究冬凌草甲素具有强的诱导QR活性机理,本实验采用不同质量浓度冬凌草甲素与Hepa1c1c7细胞共孵育48 h后检测诱导QR活性。结果如图9所示,在0.31~2.50 μg/mL范围内,Hepa1c1c7细胞存活率均大于0.50,而冬凌草甲素质量浓度为0.94 μg/mL时,即显著诱导QR活性倍增。
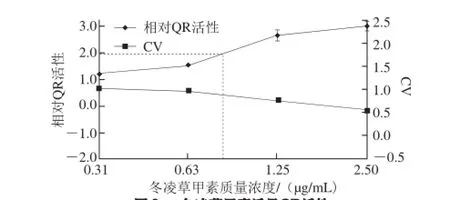
图9 冬凌草甲素诱导QR活性Fig. 9 Induction of QR activity by oridonin
为了在酶活性水平上确定冬凌草甲素诱导QR活性的信号转导通路,本实验先采用5种不同浓度的蛋白激酶抑制剂单独预处理细胞3 h后弃去,再添加1.25 μg/mL冬凌草甲素与Hepa1c1c7细胞共孵育,对照组为1.25 μg/mL冬凌草甲素单独与Hepa1c1c7细胞共孵育,48 h后检测QR活性。
由图10可知,在实验范围内,p38抑制剂预处理组的诱导细胞QR活性与对照组相比没有显著差异,表明冬凌草甲素诱导Hepa1c1c7细胞QR活性不通过p38信号转导通路。同理,冬凌草甲素诱导Hepa1c1c7细胞QR活性也不通过PKC和JNK细胞通路转导信号。在2.5~15.0 μmol/L范围内,PI3K抑制剂预处理组对冬凌草甲素诱导细胞QR活性有极显著抑制作用(P<0.01),相对QR活性分别为对照组的0.85、0.87、0.77、0.80 倍,表明冬凌草甲素通过激活PI3K信号转导通路诱导Hepa1c1c7细胞QR活性。在20~60 μmol/L浓度范围内,ERK抑制剂预处理组对冬凌草甲素诱导细胞QR活性有显著促进作用(P<0.05,P<0.01),相对QR活性分别为对照组的1.08、1.12、1.43倍和1.46倍,表明冬凌草甲素通过抑制ERK信号转导通路诱导Hepa1c1c7细胞QR活性。
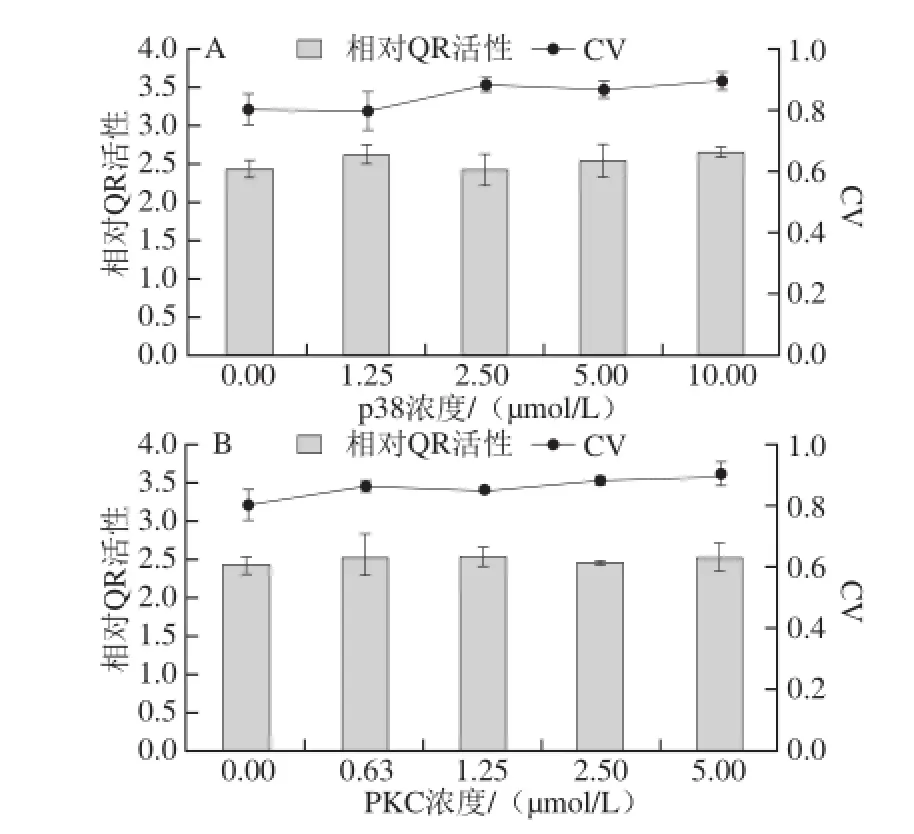
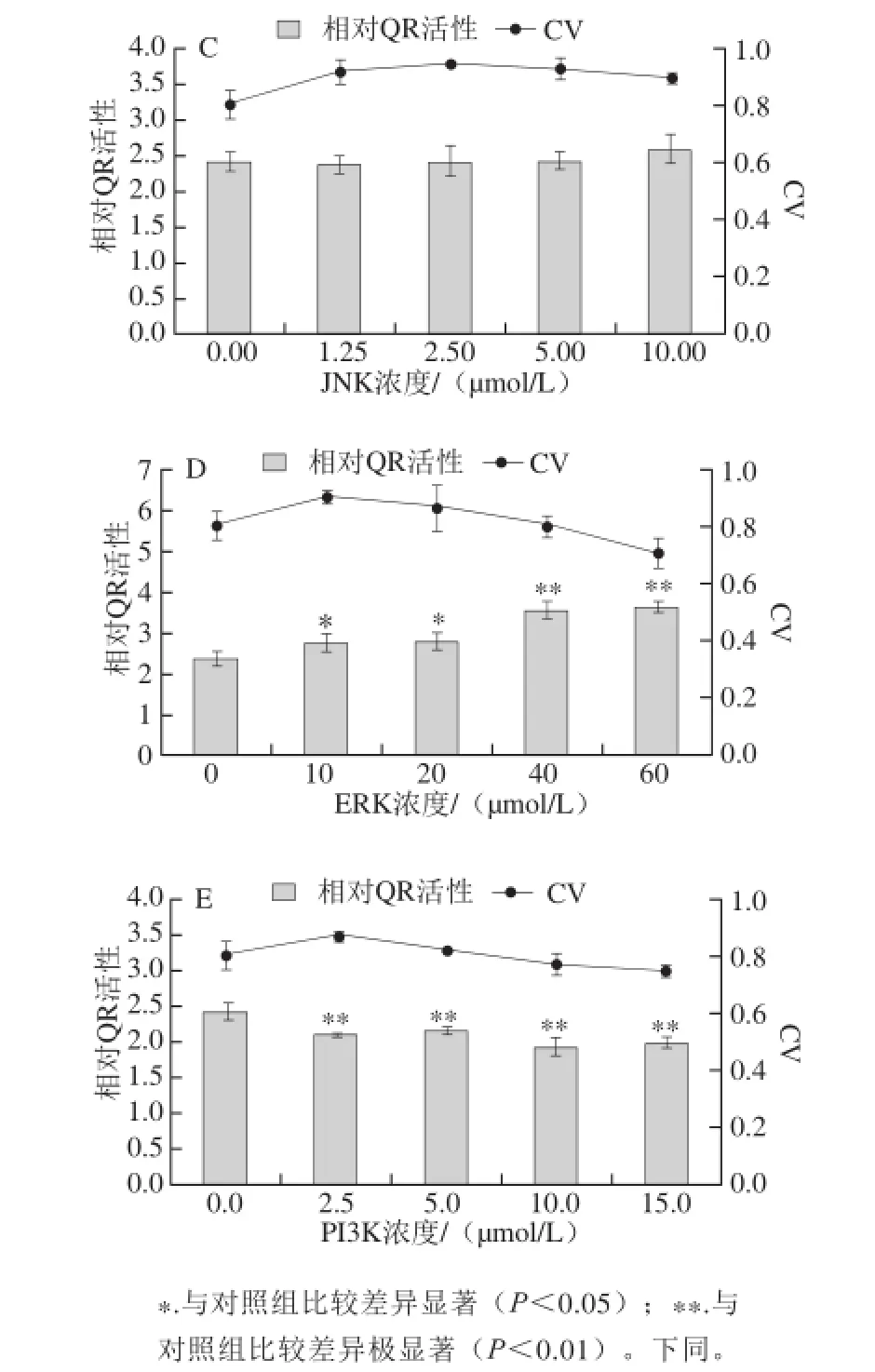
图10 5 种蛋白激酶抑制剂对冬凌草甲素诱导QR活性的影响Fig. 10 Effects of fi ve protein kinase inhibitors on the induction of QR activity by oridonin
2.3.2 冬凌草甲素对NQO1基因转录和翻译的影响
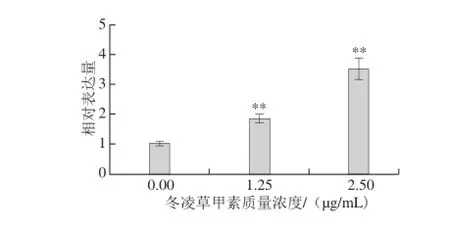
图11 冬凌草甲素作用Hepa1c1c7细胞后对NQO1 mRNA表达的影响Fig. 11 Effect of oridonin on the mRNA expression of NQO1 in Hepa1c1c7 cell line
为进一步证实冬凌草甲素具有较强QR诱导作用,本实验将不同质量浓度冬凌草甲素作用Hepa1c1c7细胞48 h后,细胞内NQO1 mRNA表达情况如图11所示。在0.0~2.5 μg/mL范围内,随着冬凌草甲素质量浓度增高,实验组NQO1 mRNA相对表达量分别为对照组的(1.83±0.07)、(3.47±0.28)倍,表明冬凌草甲素显著促进NQO1 mRNA表达。
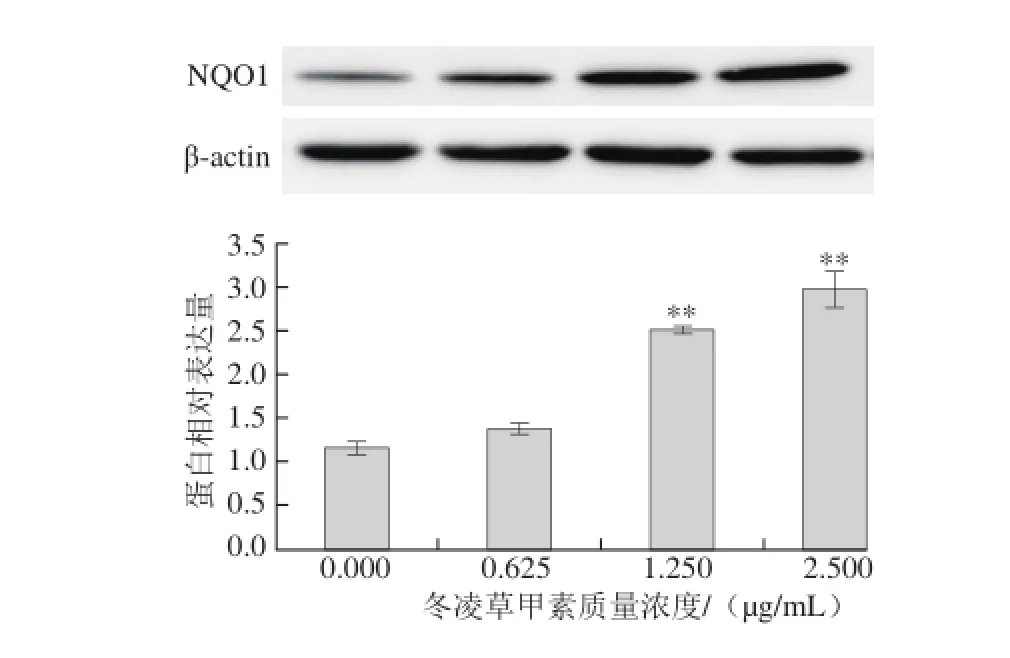
图12 冬凌草甲素作用Hepa1c1c7细胞后对NQO1蛋白表达的影响Fig. 12 Effect of oridonin on the protein expression of NQO1 in Hepa1c1c7 cell line
不同质量浓度冬凌草甲素作用Hepa1c1c7细胞48 h后,细胞内NQO1蛋白表达的情况如图12所示。实验组细胞中NQO1蛋白相对表达量随冬凌草甲素质量浓度增加而升高,呈现良好的剂量-效应关系,分别达到对照组表达量的(1.18±0.02)、(2.16±0.01)、(2.56±0.15)倍。在1.5~2.5 μg/mL范围内,实验组显著上调NQO1蛋白的表达水平。以上结果表明,冬凌草甲素可以上调Hepa1c1c7细胞中NQO1 mRNA及其蛋白的表达水平。
李广义等[20]从溪黄草中分离出冬凌草甲素,其主要具有抗癌、抗炎、抑菌、抗病毒、抗氧化等作用[21-30]。本研究结果发现溪黄草中的冬凌草甲素具有强的诱导QR活性,而对QR代谢起调控作用的蛋白激酶主要有p38、PKC、JNK、PI3K和ERK,抗癌活性物质对这5 种蛋白激酶的调控分别在相应的细胞信号转导通路中发挥重要作用。因此本研究针对上述5 种蛋白激酶和NQO1基因的转录、翻译展开冬凌草甲素抗癌机理研究。结果表明,冬凌草甲素通过激活PI3K活性、抑制ERK活性、不影响p38、PKC、JNK活性的方式诱导Hepa1c1c7细胞QR活性。冬凌草甲素显著促进NQO1基因转录及翻译。综上所述,溪黄草中的冬凌草甲素,在酶活性水平上,通过激活PI3K通路、抑制ERK通路,显著提高Hepa1c1c7细胞QR活性;在基因转录和翻译水平上,显著促进NQO1基因的转录及翻译,从而诱导QR活性显著倍增,显示出强的抗癌活性。
3 结 论
本研究提取、分离、纯化溪黄草乙酸乙酯提取物,利用小鼠肝癌细胞Hepa1c1c7体外模型,通过核磁共振、质谱分析,筛选鉴定出具有较强诱导QR活性的F5-3组分为冬凌草甲素,其诱导QR倍增质量浓度范围为1.56~3.13 μg/mL。冬凌草甲素质量浓度为0.94 μg/mL时显著诱导QR活性倍增。1.25 μg/mL冬凌草甲素经10 μmol/L的PI3K抑制剂处理后抑制QR活性最明显,经60 μmol/L的ERK抑制剂处理后促进QR活性最明显,测得QR活性分别为冬凌草甲素单独处理组的0.77 倍和1.46 倍。冬凌草甲素不通过p38、PKC和JNK信号通路影响QR活性。冬凌草甲素2.5 μg/mL显著促进Hepa1c1c7细胞中NQO1的mRNA表达水平和蛋白表达量,相对表达量分别为对照组的3.47 倍和2.56 倍。
[1] JEMAL A, BRAY F, CENTER M M, et al. Global cancer statistics[J]. CA: A Cancer Journal for Clinicians, 2011, 61(2): 69-90. DOI:10.3322/ caac.20107.
[2] WEINSTEIN I B. Cancer prevention: recent progress and future opportunities[J]. Cancer Research, 1991, 51(Suppl 18): 5080-5085.
[3] SPORN M B. Approaches to prevention of epithelial cancer during the preneoplastic period[J]. Cancer research, 1976, 36(7): 2699-2702.
[4] CUENDET M, OTEHAM C P, MOON R C, et al. Quinone reductase induction as a biomarker for cancer chemoprevention[J]. Journal of Natural Products, 2006, 69(3): 460-463. DOI:10.1021/np050362q.
[5] BELINSKY M, JAISWAL A K. NAD(P)H: quinone oxidoreductase1 (DT-diaphorase) expression in normal and tumor tissues[J]. Cancer Metastasis Reviews, 1993, 12(2): 103-117. DOI:10.1007/BF00689804.
[6] 李锋. 生姜化合物诱导Ⅱ相酶及抗炎症活性研究[D]. 南京: 南京农业大学, 2011: 7. DOI:10.7666/d.Y2038535.
[7] KANG Y H, PEZZUTO J M. Induction of quinone reductase as a primary screen for natural product anticarcinogens[J]. Quinones and Quinone Enzymes, 2004, 382: 380-414. DOI:10.1016/S0076-6879(04)82021-4.
[8] CHANG L, KARIN M. Mammalian MAP kinase signalling cascades[J]. Nature, 2001, 410: 37-40. DOI:10.1038/35065000.
[9] LAMBERTI M J, RUMIE VITTAR N B, da SILVA F D C, et al. Synergistic enhancement of antitumor effect of beta-lapachone by photodynamic induction of quinone oxidoreductase (NQO1)[J]. Phytomedicine, 2013, 20(11): 1007-1012. DOI:10.1016/ j.phymed.2013.04.018.
[10] LIAO K, NIU F, HAO H, et al. Advances on structure-activity relationship of NQO1-targeting antitumor quinones[J]. Chinese Journal of Natural Medicines, 2012, 10(3): 170-176. DOI:10.3724/ SP.J.1009.2012.00170.
[11] ALCAIN F J, VILLALBA J M. NQO1-directed antitumour quinones[J]. Expert Opinion on Therapeutic Patents, 2007, 17(6): 649-665. DOI:10.1016/S0006-2952(03)00452-0.
[12] 付琳, 邓乔华, 曾飞燕, 等. 中药溪黄草名字考证[J]. 中药材, 2012(3): 493-495. DOI:10.13863/j.issn1001-4454.2012.03.009.
[13] 谢兴亮, 盛艳梅. 溪黄草的研究进展[J]. 医药导报, 2011, 30(4): 494-497. DOI:10.3870/yydb.2011.04.032.
[14] 张文静, 黄启来, 华子春. 冬凌草甲素抗肿瘤作用的研究进展[J]. 生命科学, 2010(5): 416-420. DOI:10.13376/j.cbls/2010.05.008.
[15] 桂蜀华. 溪黄草提取物抗免疫肝损伤作用机理研究[D]. 广州: 广州中医药大学, 2007: 48. DOI:10.7666/d.y1111612.
[16] 张鹰, 施鉴芝. 溪黄草水提取物及其抑菌效果研究[J]. 包装与食品机械, 2012, 30(2): 21-24. DOI:10.3969/j.issn.1005-1295.2012.02.005.
[17] 胡英杰, 赖小平, 刘中秋, 等. 狭基线纹香茶菜(溪黄草)的化学成分与抗乙肝病毒作用研[J]. 中草药, 2005(11): 1612-1615. DOI:10.3321/j.issn:0253-2670.2005.11.005.
[18] PROCHASKA H J, SANTAMARIA A B. Direct measurement of NAD(P)H: quinone reductase from cells cultured in microtiter wells: a screening assay for anticarcinogenic enzyme inducers[J]. Analytical Biochemistry, 1988, 169(2): 328-336. DOI:10.1016/0003-2697(88)90292-8.
[19] 孔漫, 汪茂田. 香茶菜属二萜的2D NMR研究(1)[J]. 波谱学杂志, 1993(3): 309-314.
[20] 李广义, 宋万志, 季庆义, 等. 溪黄草二萜成分的研究[J]. 中药通报, 1984(5): 29-30.
[21] FUJITA E, NAGAO Y, NODE M, et al. Antitumor activity of the Isodon diterpenoids: structural requirements for the activity[J]. Experientia, 1976, 32(2): 203-206. DOI:10.1007/BF01937766.
[22] XU Y, XUE Y, WANG Y, et al. Multiple-modulation effects of oridonin on the production of proinflammatory cytokines and neurotrophic factors in LPS-activated microglia[J]. International Immunopharmacology, 2009, 9(3): 360-365. DOI:10.1016/ j.intimp.2009.01.002.
[23] 焦明庆, 徐汉虹. 显脉香茶菜的抑菌活性及活性成分[J]. 植物保护学报, 2010(1): 67-72. DOI:10.13802/j.cnki.zwbhxb.2010.01.011.
[24] LIU J J, WU X Y, PENG J, et al. Antiproliferation effects of oridonin on HL-60 cells[J]. Annals of Hematology, 2004, 83(11): 691-695. DOI:10.1007/s00277-004-0919-y.
[25] 秦方园. 冬凌草甲素通过激活Nrf2通路保护肝细胞的研究[D]. 开封: 河南大学, 2009: 45. DOI:10.7666/d.y1485066.
[26] CAO S J, XIA M J, MAO M Y, et al. Combined oridonin with cetuximab treatment shows synergistic anticancer effects on laryngeal squamous cell carcinoma: involvement of inhibition of EGFR and activation of reactive oxygen species-mediated JNK pathway[J]. International Journal of Oncology, 2016, 49(5): 2075-2087. DOI:10.3892/ijo.2016.3696.
[27] DING Y, DING C Y, YE N, et al. Discovery and development of natural product oridonin-inspired anticancer agents[J]. European Journal of Medicinal Chemistry, 2016, 122: 102-117. DOI:10.1016/ j.ejmech.2016.06.015.
[28] XU S T, LUO S S, YAO H, et al. Probing the anticancer action of oridonin with fluorescent analogues: visualizing subcellular localization to mitochondria[J]. Journal of Medicinal Chemistry, 2016, 59(10): 5022-5034. DOI:10.1021/acs.jmedchem.6b00408.
[29] LI D H, HAN T, XU S T, et al. Antitumor and antibacterial derivatives of oridonin: a main composition of Dong-Ling-Cao[J]. Molecules, 2016, 21(5): 575. DOI:10.3390/molecules21050575.
[30] ZHOU G B, KANG H, WANG L, et al. Oridonin, a diterpenoid extracted from medicinal herbs, targets AML1-ETO fusion protein and shows potent antitumor activity with low adverse effects on t(8;21) leukemia in vitro and in vivo[J]. Blood, 2007, 109(8): 3441-3450. DOI:10.1182/blood-2006-06-032250.
Oridonin-Induced Quinone Reductase Activity and Its Mechanism in Mouse Hepatoma Hepa1c1c7 Cells
WANG Zuo, WANG Lu, CHEN Zhongzheng*, LAO Yang, LIU Xingyi, GAO Xiong, YAN Ni, LIN Xiaorong, ZHANG Yuanguan, LI Bin*
(College of Food Science, South China Agricultural University, Guangzhou 510642, China)
To screen and identify the anticancer components of Rabdosia serra (Maxim) Hara, the effects of the crude ethyl acetate extract of Rabdosia serra (Maxim) Hara and its purif i ed fractions obtained by silica gel column chromatography and semi-preparative chromatography on cell viability and quinone reductase (QR/NQO1) activity were evaluated using mouse hepatoma Hepa1c1c7 cells. The purif i ed fractions were identif i ed by mass spectrometry (MS),1H-nuclear magnetic renonsance (1H-NMR) and13C-NMR. Furthermore, mouse hepatoma cells were pretreated with specific protein kinase inhibitors including phosphatidylinositol 3-kinase (PI3K) inhibitor, extracellular signal-regulated kinase (ERK) inhibitor, mitogen activated protein kinases(MAPK) p38 inhibitor, protein kinase C (PKC) inhibitor and c-Jun N-terminal kinase (JNK) inhibitor to determine the signal transduction pathways leading to the induction of QR activity. The mRNA and protein expression levels of NQO1 were measured by quantitative PCR and Western blot, respectively. Our results suggested as follows: 1) oridonin was identif i ed as a potential anticancer component of this extract; 2) oridonin at a concentration of 0.94 μg/mL exhibited a remarkable potency in inducing QR; 3)PI3K inhibitor signif i cantly inhibited the induction of QR activity by oridonin, while ERK inhibitor showed an opposite effect. Moreover, p38, PKC and JNK inhibitors did not signif i cantly affect the induction effect of oridonin on QR; 4)oridonin markedly increased the expression of both mRNA and protein of NQO1. In conclusion, oridonin from Rabdosia serra (Maxim) Hara can induce QR activity in cultured Hepa1c1c7cells by activating the PI3K signal transduction pathway and inhibiting the ERK signal transduction pathway, and it also can signif i cantly induce the transcription and translation of NQO1. These results would provid a preliminary theoretical basis for cancer chemoprevention with Rabdosia serra (Maxim) Hara and oridonin.
Rabdosia serra (Maxim) Hara; oridonin; quinone reductase; Hepa1c1c7 cell line; signal transduction pathway
10.7506/spkx1002-6630-201707031
Q257
A
1002-6630(2017)07-0193-08
2016-04-06
国家现代农业产业技术体系建设专项(CARS-23)
王佐(1990—),男,硕士研究生,研究方向为食品化学与营养。E-mail:937024730@qq.com
*通信作者:陈忠正(1974—),男,副教授,博士,研究方向为食品生物技术。E-mail:Zhongzhengch@scau.edu.cn李斌(1960—),女,教授,博士,研究方向为食品化学与营养。E-mail:bli@scau.edu.cn
王佐, 王璐, 陈忠正, 等. 冬凌草甲素诱导小鼠肝癌细胞醌还原酶活性及其机理研究[J]. 食品科学, 2017, 38(7): 193-200. DOI:10.7506/spkx1002-6630-201707031. http://www.spkx.net.cn
WANG Zuo, WANG Lu, CHEN Zhongzheng, et al. Oridonin-induced quinone reductase activity and its mechanism in mouse hepatoma Hepa1c1c7 cells[J]. Food Science, 2017, 38(7): 193-200. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201707031. http://www.spkx.net.cn
