超高压改性大豆蛋白与可溶性多糖复合物对乳液形成及稳定性的影响
2017-04-25马文君齐宝坤王中江隋晓楠江连洲
丁 俭,马文君,毕 爽,齐宝坤,王中江,隋晓楠,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
超高压改性大豆蛋白与可溶性多糖复合物对乳液形成及稳定性的影响
丁 俭,马文君,毕 爽,齐宝坤,王中江,隋晓楠,江连洲*
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
通过研究超高压处理改性的柔性大豆蛋白与可溶性多糖复合物对乳液形成的影响,揭示复合物结构变化与乳状液稳定性的关系,采用激光共聚焦、动态激光散射、接触角测量仪和圆二色谱研究不同超高压处理改性大豆蛋白与可溶性多糖复合物形成乳液的微观结构、流体动力学半径、界面吸附特性和大豆蛋白超高压改性的空间结构变化。实验表明:随着压力的增加乳液粒径变小,乳滴形状规则、分布均匀,乳液表面负电荷增加;400 MPa处理的蛋白所形成复合物的乳化活性和乳化稳定性最大分别为18.33 m2/g和30.2 min;不同超高压处理改变了大豆蛋白二级结构,影响了与可溶性多糖分子的键合,进而影响复合物在油-水界面吸附特性和乳液的界面压,结果证明超高压改性大豆蛋白与可溶性多糖复合物形成乳液的稳定性机制与乳液界面层分子结构的变化有关。
超高压处理;柔性蛋白;可溶性多糖;稳定性
大豆蛋白作为天然大分子物质具有一定空间结构和分子柔性,这些特殊的空间构象对食品加工有重要影响。在蛋白质的空间结构中一般将易于发生改变的蛋白质结构称为柔性区间,而结构稳定固化不易改变的部分称为刚性区间,其中,蛋白质柔性结构与蛋白质的功能密切相关[1]。大豆蛋白常用作乳化剂、起泡剂、凝胶剂等,但由于对pH值、离子强度和温度等环境压力非常敏感[2-3],其稳定性易受到影响,在加工中受到限制。然而,这些特性很大程度上取决于蛋白质特殊结构、空间结构区段的相对位置关系及蛋白质侧链构象。目前研究通过多种方式如加热、超声、微波、超高压等技术改变蛋白质的空间结构和功能特性[4-7],使其表现出更好的功能特性。大豆蛋白在食品乳液中常作为乳化剂,所稳定的油包水(O/W)乳状液是一种热力学不稳定体系,目前有研究通过改变蛋白质构象、增强界面蛋白质柔性,利于蛋白质在油-水界面吸附[8]。也有通过加入多糖改变连续相的流变特性、界面膜结构,增强体系的稳定性[9-11]。Pawlowsky等[12]研究表明多糖连接到蛋白质表面,部分结构可以伸入两相中形成有效的乳液保护层,降低界面张力,增强液滴间静电排斥或空间位阻。但目前对蛋白-多糖复合乳液的稳定机制尚不明确,因此,本研究通过超高压处理改变蛋白质构象、促进柔性结构展开、刚柔性区域重排、非极性基团暴露,同时改变蛋白质三、四级结构,促进多糖与蛋白质分子的键合,使蛋白-多糖复合物有效提高乳液界面活性、构象稳定性和乳化稳定性。通过构建蛋白与多糖的界面络合物,增加在油滴表面吸附,使其作为一种乳液绿色加工手段在制备复合乳液、药物载体、胶囊等食品行业领域具有广阔的发展前景。
通过研究改性大豆蛋白与可溶性多糖的协同作用,揭示大豆蛋白分子柔性结构、分子特性与多糖交互对乳液结构形成的影响。利用超高压技术改变大豆蛋白固有的刚性结构使其柔性化,增加与可溶性多糖的键合位点。本实验分析超高压改性大豆蛋白柔性结构与可溶性多糖复合物的乳化性能、界面吸附性和乳化体系的稳定性,对复合物形成乳液的粒径、Zeta电位、乳液的微观结构研究,证明乳液界面层分子结构的变化与乳状液稳定性之间的内在联系,探讨超高压改性大豆蛋白柔性结构与可溶性多糖复合乳液的稳定机制,以期为不同乳状液的制备提供理论指导。
1 材料与方法
1.1 材料与试剂
大豆 东北农业大学大豆研究所;商品级大豆多糖(纯度99%) 郑州荔诺生物有限公司;低温脱脂豆粕山东禹王公司;金龙鱼大豆油 市售。
氢氧化钠 天津市光复精细化工研究所;盐酸北京新光化工试剂厂;磷酸二氢钠、磷酸氢二钠 天津市东丽区天大化学试剂厂;其他试剂最低纯度为国产分析纯。
1.2 仪器与设备
UHTF-750MPA型高压设备 包头科发高压科技有限责任公司;均质机 上海标本模型有限公司;LGR20-W台式高速冷冻离心机 北京京立离心机有限公司;Mastersizer2000激光粒度仪、电位及纳米粒度分析仪 英国马尔文仪器有限公司;激光共聚焦扫描显微镜 德国徕卡公司;OCA20视频接触角测量仪德国DATA PHYSICS仪器股份有限公司;JASCO J-810圆二色光谱仪 上海中科新生命生物科技有限公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
大豆分离蛋白采用自制的方法获得,参考Wolf[13]的方法。称取新鲜大豆磨粉并过60 目筛,所得豆粉与正己烷以1∶3(m/V)的比例混合,在40 ℃条件下搅拌2 h脱脂3 次。将脱脂豆粉按1∶10(m/V)的比例与水混合,然后用2 mol/L的NaOH调节溶液的pH值至8.5,45 ℃条件下搅拌2 h后,将其悬浮液在4 ℃条件下10 000×g离心20 min,取上清液再用2 mol/L HCl调节pH值至4.5。静置后在4 ℃条件下6 000×g离心20 min,得蛋白沉淀水洗2 次,最后用2 mol/L NaOH调节蛋白质pH值至7.0。将此蛋白溶液冷冻干燥后研磨即得粉末状大豆分离蛋白。
1.3.2 大豆分离蛋白的超高压处理
将大豆蛋白溶液分成6 组,密封后将其中5 组放入聚乙烯袋内,置于高压容器中。在25 ℃常温条件下,对每组溶液分别对应进行200、300、400、500、600 MPa加压处理,每种压力条件下的连续加压时间为10 min。每组测量3 次,取平均值。
1.3.3 乳液的制备
将未处理的大豆蛋白和超高压改性后的大豆蛋白(10 mg/mL)与可溶性多糖(20 mg/mL)溶解于去离子水中,调节pH 3.0,磁力搅拌3 h,加入0.02%的叠氮化钠。
将处理后的大豆蛋白溶液向可溶性多糖的溶液中边滴加,边磁力搅拌,在pH 3.0条件下形成复合物搅拌30 min后,加入质量分数5%的大豆油,在10 000 r/min条件下均质3 min,制备出不同类型的乳液,4 ℃条件下贮藏。
1.3.4 乳液微观结构分析
通过观察乳液的微观结构来评定乳液的稳定特性,将新制的大豆蛋白乳液、未处理大豆蛋白-可溶性多糖乳液和经超高压处理大豆蛋白-可溶性多糖乳液分别分散到pH 7.0的磷酸盐缓冲液中配制成10 mg/mL,将尼罗红(0.01 g/100 mL)溶解在异丙醇里,制成染色液。取1 mL乳液样品加入40 μL染色液,混合均匀,染色30 min,取染色的乳液样品一滴放在带凹槽的载玻片上,盖上盖玻片并用甘油密封。激发光488 nm进行激光共聚焦扫描。采用油镜进行图像采集,分辨率为1 024×1 024,可避免玻片上污染物对图像的影响。
1.3.5 乳液Zeta电位和平均粒径的测定
将制备的乳液分散到pH 7.0的磷酸盐缓冲液中,质量分数为0.005%,在常温条件下测定其Zeta电位,测定时的温度为25 ℃,每个样品平行测定3 次。同样将3 种乳液分散到pH 7.0的磷酸盐缓冲液中质量分数为0.1%,用Mastersizer2000激光粒度仪测定其平均粒径(D4,3),达到相应的遮光度后进行测定,每个样品平行测定3 次。
1.3.6 乳化活性和乳化稳定性的测定
大豆蛋白-可溶性多糖复合物的乳化活性(emulsification activity index,EAI)和乳化稳定性(emulsification stability index,ESI)参考文献[14]的方法测定:取30 mL大豆蛋白-可溶性多糖复合物,分别加入10 mL大豆油进行均质,取50 μL乳液加入5 mL 0.1 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液稀释,在500 nm波长处测吸光度A0。静置30 min后,再次从底部各取50 μL样品,测定吸光度A30。乳化活性EAI和乳化稳定性ESI计算公式如(1)、(2)所示。

式中:N为稀释倍数(250);ρ为乳化液形成前蛋白质水溶液中蛋白质质量浓度/(g/mL);φ为乳化液中油相体积分数/%;A0为0 min时的吸光度;A30为30 min时的吸光度。
1.3.7 复合物吸附界面压的测定
利用OCA20视频光学接触角测量仪来测定复合物吸附的界面压,进行实验时,将连接在毛细管上的不锈钢针插入盛有油相的玻璃槽内,将不同处理的大豆柔性蛋白与可溶性多糖复合物样品均质后置于注射器中,静止处理后使温度平衡,利用电动注射单元将样品推到不锈钢针的尖端形成15 μL的液滴,立即启动视频摄像系统连续采集液滴的外形图像,检测复合物界面张力γ随吸附时间t的变化。实验在室温条件下进行,维持180 min。然后,根据Young-Laplace方程,利用SCA20软件对液滴外形图象进行分析,计算出界面张力γ,动态界面张力为表面压力π随吸附时间的变化[15]如公式(3)所示。

式中:γ0为缓冲液的界面张力;γ为蛋白-多糖作为乳化剂时的界面张力。
1.3.8 圆二色谱分析
采用远紫外区域圆二色光谱仪检测天然大豆蛋白和超高压处理对大豆蛋白二级结构的变化。准确称取一定量超高压处理的蛋白样品,溶于pH 7.0的磷酸盐缓冲液中,蛋白质量浓度为0.4 mg/mL。圆二色光谱仪在190~250 nm之间扫描,实验温度为20 ℃,样品池光程为1 mm,灵敏度为100 mdeg/cm,扫描速率为100 nm/min,分辨率0.1 nm。蛋白二级结构组成采用CD Pro曲线拟合软件包,使用的算法为CONTIN/LL,使用的参考蛋白为SMP56,取蛋白平均残基摩尔质量为115 g/mol,计算波长范围为200~240 nm,每个样品重复3 次测定。
1.4 统计分析
2 结果与分析
2.1 乳液的微观结构分析

图1 大豆蛋白、不同超高压改性大豆蛋白与可溶性多糖复合物乳液的微观结构Fig. 1 Microstructure of soy protein and different ultra-high pressure modif i ed soy protein-soluble polysaccharide emulsions
激光共聚焦显微镜经常用于分析乳液微观结构,能够直观地反映出乳液颗粒大小、分散状况及产生的不稳定现象。图1是不同复合物所形成乳液的微观结构,由图1a可知,大豆蛋白稳定的乳液液滴粒径较大且分布不均匀,出现了乳滴聚集,这主要是由于此时乳液表面蛋白的乳化性较差,形成的乳滴不均匀,而且单独的大豆蛋白所形成乳液的界面膜不够稳定,发生了油滴之间的絮凝或聚集。图1b是未经超高压处理的大豆蛋白与可溶性多糖复合物形成的乳液,可以看到部分乳滴较大,同时也存在较小的乳滴分布,这主要是由于蛋白和多糖发生分离,没有较好地复合,使油滴部分由单独多糖稳定。图1c~g是由不同超高压处理的大豆蛋白与可溶性多糖复合物稳定的乳液,而由超高压处理的大豆蛋白与可溶性多糖复合物稳定的乳液粒径相对较小且呈球形。并且复合物稳定的乳液随压力的增加乳滴变小、分布均匀。这可能是由于复合物在油-水界面形成更加致密的膜结构[16-17],蛋白经超高压处理后柔韧性和乳化性较好,形成乳滴结构更加均匀,抵抗了油滴絮凝,说明超高压处理得到的蛋白与可溶性多糖复合物能更好地稳定乳液。
2.2 乳液Zeta电位变化

图2 大豆蛋白、不同超高压改性大豆蛋白与可溶性多糖电位变化Fig. 2 Zeta-potential of soy protein and different ultra-high pressure modif i ed soy protein-soluble polysaccharide emulsions复合物乳液的Zeta
复合物的表面电荷密度能有效反映乳滴之间的静电相互作用。乳液的Zeta电位变化如图2所示,在pH 7.0的缓冲溶液中天然大豆蛋白乳液的Zeta电位为-25.29 mV,加入可溶性大豆多糖后电位变为-36.8 mV,随着压力的增加电位的绝对值先升高后降低,经超高压处理的大豆蛋白-可溶性多糖复合物乳液的Zeta电位在400 MPa时为-42 mV,表面电荷密度最大复合物。而可溶性多糖作为一种阴离子多糖,它的加入相比于未加多糖的蛋白质乳液负电性增加,这与Wang Yong等[18]的研究结果是一致的。其他复合乳液的Zeta电位相对较低,说明不同的超高压处理使蛋白质结合可溶性多糖的分子个数不同,使表面所带的电荷不同,主要由于不同超高压处理蛋白的柔性区域、构象的不同,这样通过静电相互作用所结合大分子多糖的能力不同[19-20]。另外,可溶性多糖的复合也可以通过空间位阻和静电斥力改善乳液的稳定性。
2.3 乳液粒径分布

图3 大豆蛋白、不同超高压改性大豆蛋白与可溶性多糖复合物乳液的粒径变化Fig. 3 Mean droplet diameters (D4,3) of soy protein and different ultra-high pressure modif i ed soy protein-soluble polysaccharide emulsions
由图3可以看出,大豆蛋白-可溶性多糖复合物乳液的粒径与复合物的特性有关,经不同超高压处理后的大豆蛋白与可溶性多糖复合乳液的体积平均粒径(D4,3)的变化趋势如图3所示,未添加可溶性多糖大豆乳液的D4,3值大部分分布在100 μm左右,乳液的粒径较大,而添加可溶性多糖与未经超高压处理的大豆蛋白复合的乳液粒径分布出现双峰现象。可能是由于蛋白质与多糖大分子的结合不够紧密稳定较差,造成蛋白和多糖组分分离形成两种乳液粒径。经过超高压处理的大豆蛋白与可溶性多糖复合的乳液粒径分布较为均一且分布范围较窄,400 MPa处理的柔性蛋白与可溶性多糖复合物的乳液粒径几乎都分布在50 μm左右,而且随着压力的逐渐增加粒径分布的主峰稍有右移,但变化并不明显。说明不同超高压条件处理大豆蛋白对乳液的粒径影响差异不明显。结合共聚焦图和电位变化可知400 MPa处理的大豆蛋白与可溶性多糖形成复合物的乳液形状规则稳定,表面净电荷较多,这主要是由于在不同压力下蛋白质的空间构象发生变化,同时大豆可溶性多糖可以改变乳液表面电荷以及增加界面层厚度,增强乳滴间的空间排斥力和亲水性,改善了复合物形成乳液的稳定性[21]。
2.4 乳化性分析
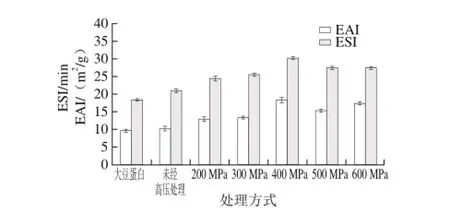
图4 大豆蛋白、不同超高压改性大豆蛋白与可溶性多糖复合物乳化活性和乳化稳定性Fig. 4 EAI and ESI of soy protein and different ultra-high pressure modif i ed soy protein-soluble polysaccharide emulsions
不同超高压处理的大豆蛋白与可溶性多糖复合物乳化活性和乳化稳定性如图4所示,可以看出经超高压处理后的大豆蛋白与可溶性多糖复合物的乳化活性增加,对比与其他复合物特性,经400 MPa处理的大豆蛋白与可溶性多糖复合乳化活性和乳化稳定性分别为:18.33 m2/ g和30.2 min。500、600 MPa时复合物的乳化稳定性逐渐降低,可能是由于过高的压力使蛋白质空间构象不稳定,造成了乳化性的降低。相比于大豆蛋白乳液,蛋白质与多糖非共价键的连接,改善了蛋白质的界面性质[22]。超高压处理影响了大豆蛋白的乳化活性与溶解性,使大豆蛋白柔性增加,使较多的蛋白质分子溶于水,具有更好的迁移率,提高吸附到油-水界面的几率,从而使蛋白质-多糖复合物乳化性提高。另外,蛋白质在吸附油滴表面是一个物理吸附过程,蛋白质经不同的压力处理后蛋白质颗粒表面积、蛋白质结构及表面疏水性的差异影响了蛋白质吸附油脂表面的能力,经适当的超高压处理后柔性结构舒张,有助于在油-水界面的分布,进而影响了复合物的乳化活性和乳化稳定性[23]。
2.5 复合物吸附的界面压动态变化

图5 大豆蛋白与不同高压处理大豆柔性蛋白-可溶性多糖复合物在)的变化Fig. 5 Square root of time (θ1/2) dependence of surface pressure (π) at the oil-water interface for soy protein and different ultra-high pressure modif i ed soy protein-soluble polysaccharide adsorbed layers油-水界面表面压(π)随吸附时间(θ1/2
界面张力和界面压性质是反映乳液界面膜抵抗外界形变的能力,蛋白质和多糖之间通过相互作用形成复合物,乳液的界面层厚度、界面压大小、黏弹性和电荷密度等都会受到影响,进而影响乳状液的稳定性。图5为大豆蛋白与不同超高压处理大豆蛋白-可溶性多糖复合物在油-水界面的界面压(π),随吸附时间(θ1/2)的变化。由图5可以知,界面压π随着吸附时间的延长逐渐增加,后逐渐平缓。主要由于大豆蛋白、大豆蛋白多糖复合物在油-水界面上吸附,不同超高压处理的蛋白与可溶性多糖复合后吸附动力学明显不同。天然大豆蛋白与未经处理的大豆蛋白复合物形成乳液界面压相对较低,在13.0~13.8 mN/m之间,而且初期的吸附速率较慢;超高压处理后的大豆蛋白与可溶性多糖复合物可以快速到达油-水界面,形成界面压,400 MPa超高压处理后的蛋白与可溶性多糖复合乳液的平衡压力在16.3 mN/m。说明超高压处理蛋白和多糖的复合可以增加界面活性,同时增强了界面强度[24]。可能400 MPa处理诱导大豆蛋白产生更加柔性的构象,可以使蛋白与多糖复合后在界面上更易伸展,分子间发生较好的相互作用,快速地吸附到油-水界面。从复合物在油-水界面吸附的能垒角度考虑[25],超高压处理使大豆蛋白发生去折叠引起疏水基团的暴露降低了复合物吸附能垒,提高了吸附效率。因此说明界面层物质的结构特性对吸附动力学有重要影响。
2.6 圆二色谱分析

表1 不同超高压处理大豆蛋白的二级结构含量Table 1 Secondary structure contents of different ultra-high pressure treatments of soy protein
通过圆二色谱拟合软件CD Pro对得到的图谱进行分析计算,得到超高压处理改性大豆蛋白和天然大豆蛋白的二级结构含量变化如表1所示。由此可知,大豆蛋白在超高压处理时α-螺旋结构含量先增加后降低,β-折叠含量下降,β-转角、无规卷曲含量先降低后又逐渐增加,Li Huijing等[26]也发现超高压处理将改变大豆分离蛋白的空间结构,从而改变蛋白质的构象和乳化特性。超高压处理明显改变蛋白质的二级结构,这些二级结构就会相应改变蛋白质整体构象的柔韧性,蛋白质的二级结构的空间构象使蛋白质结构不同的区域具有不同程度的柔性。蛋白质内部肽链结构的改变和伸展,会影响蛋白质分子与多糖分子的键合作用,从而影响复合物的功能特性,而压力过高时反而使蛋白质发生聚集无法伸展,因此选择适当压力可以改变蛋白质的柔性提高复合物的功能特性[27-28]。
综上所述,实验结果表明超高压处理后蛋白质的构象及网络结构改变,柔性区域不同,使蛋白质结构能有效地促进与多糖分子之间的键合,复合界面行为更强,这种界面上的相互作用随着蛋白构象的变化而发生改变,进而影响复合物对乳液的稳定性。
3 结 论
经超高压处理的大豆蛋白与可溶性多糖复合物所形成乳液粒径均匀稳定,乳滴的形状规则,表现较好的界面稳定特性。
400 MPa改性的柔性大豆蛋白与可溶性多糖复合后表现出较好的乳化活性和乳化稳定性,相对于未经超高压处理的大豆蛋白与可溶性多糖复合物均明显提高;且复合物在油-水界面吸附速率较快,表现较高的界面压π值为16.3 mN/m。
超高压处理改善了大豆蛋白柔性、二级构象,随着压力的增加α-螺旋含量先升高后降低,β-折叠结构含量降低,β-转角、无规卷曲结构含量先降低再升高;400 MPa时α-螺旋、β-折叠结构含量最高,大豆蛋白构象发生转变,此时大豆蛋白有序构象的组成、柔性结构的展开影响蛋白质整体构象的柔韧性,更易与可溶性多糖形成功能特性较好的复合物,增加乳液稳定性;超过400 MPa时大豆蛋白α-螺旋、β-折叠结构含量降低,β-转角、无规卷曲结构含量增加,复合物乳化活性和乳化稳定性降低,过高的压力使蛋白质的结构组成不利于形成稳定性好的复合物,进而影响乳液特性。
通过研究超高压改性大豆蛋白柔性结构与可溶性多糖形成复合物乳液稳定性的关系,证明乳液界面层蛋白分子结构的变化影响可溶性多糖的键合作用,其复合物形成乳液的稳定性机制与乳液界面层分子结构的变化有关。
[1] SCHLESSINGER A, ROST B. Protein fl exibility and rigidity predicted from sequence[J]. Proteins, 2005, 61(1): 115-126. DOI:10.1002/ prot.20587.
[2] PONGSAWATMANIT R, HARNSILAWAT T, MCCLEMENTS D J. Influence of alginate, pH and ultrasound treatment on palm oil-inwater emulsions stabilized by β-lactoglobulin[J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2006, 287(1/2/3): 59-67. DOI:10.1016/j.colsurfa.2006.03.022.
[3] LEDWARD D A. Protein-polysaccharide interactions[J]. Current Opinion in Colloid & Interface Science, 2000, 5(3/4): 202-214. DOI:10.1016/S1359-0294(00)00054-6.
[4] KNORR D, HEINZ V, BUCKOW R. High pressure application for food biopolymers[J]. Biochimica et Biophysica Acta-Proteins & Proteomics, 2006, 1764(3): 619-631. DOI:10.1016/ j.bbapap.2006.01.017.
[5] FLOURY J, DESRUMAUX A, LEGRAND J. Effect of ultra-highpressure homogenization on structure and on rheological properties of soy protein-stabilized emulsions[J]. Journal of Food Science, 2002, 67(9): 3388-3395. DOI:10.1111/j.1365-2621.2002.tb09595.x.
[6] 李汴生. 超高压处理蛋白质和多糖胶体特性的变化及其机理研究[D].广州: 华南理工大学, 1997: 59-61.
[7] DICKINSON E. Hydrocolloids as emulsifiers and emulsion stabilizers[J]. Food Hydrocolloids, 2009, 23(6): 1473-1482. DOI:10.1016/j.foodhyd.2008.08.005.
[8] YANN D, ARNAUD S J, ANNIINA S, et al. Strong improvement of interfacial properties can result from slight structural modifications of proteins: the case of native and dry-heated lysozyme[J]. Langmuir, 2011, 27(24): 14947-14957. DOI:10.1021/la203485y.
[9] 刘丽娅. 酪蛋白酸钠-多糖界面相互作用及其对乳状液稳定性的影响[D]. 广州: 华南理工大学, 2011: 77-78.
[10] 赵谋明, 龙肇, 赵强忠. 蛋白质用量和比例对淡奶油理化性质的影响[J]. 吉林大学学报(工学版), 2014(5): 1531-1536.
[11] 许慧, 郑环宇, 朱秀清, 等. 大豆浓缩蛋白改性及应用前景分析[J].食品科学, 2012, 33(9): 331-334.
[12] PAWLOWSKY, DICKINSON E. Inf l uence of protein-polysaccharide interactions on the rheology of emulsions[J]. Food Colloids, 2004, 20(9): 258-265. DOI:10.1533/9781845698263.4.258.
[13] WOLF W J. Soybean proteins. their functional, chemical, and physical propertie[J]. Journal of Agricultural and Food Chemistry, 1970, 18(6): 969-976. DOI:10.1021/jf60172a025.
[14] NAKAMURA A, TAKAHASHI T, YOSHIDA R, et al. Emulsifying properties of soybean soluble polysaccharide[J]. Food Hydrocolloids, 2004, 18(5): 795-803. DOI:10.1021/jf60172a025.
[15] 周春霞. 大豆蛋白在空气-水和油-水界面上的流变学研究[D]. 广州:华南理工大学, 2006: 80-82.
[16] PATINO J M R, PILOSOF A M R. Protein-polysaccharide interactions at fluid interfaces[J]. Food Hydrocolloids, 2011, 25(8): 1925-1937. DOI:10.1016/j.foodhyd.2011.02.023.
[17] DICKINSON E. Protein-polysaccharide interactions in food colloids[J]. Food Colloids & Polymers, 2005: 77-93. DOI:10.1533/9781845698270.77.
[18] WANG Y, LI D, WANG L J, et al. The effect of addition of fl axseed gum on the emulsion properties of soy protein isolate (SPI)[J]. Journal of Food Engineering, 2011, 104(1): 56-62. DOI:10.1016/ j.jfoodeng.2010.11.027.
[19] ROPERS M H, NOVALES B, BOUE F, et al. Polysaccharide/ Surfactant complexes at the air-water interface-effect of the charge density on interfacial and foaming behaviors[J]. Langmuir, 2010, 24(22): 12849-12857. DOI:10.1021/la802357m.
[20] DALGLEISH D G, MORRIS E R. Interactions between carrageenans and casein micelles: electrophoretic and hydrodynamic properties of the particles[J]. Food Hydrocolloids, 1988, 2(4): 311-320. DOI:10.1016/S0268-005X(88)80028-6.
[21] CHANG Y G, MCCLEMENTS D J. Interfacial deposition of an anionic polysaccharide (fucoidan) on protein-coated lipid droplets: impact on the stability of fi sh oil-in-water emulsions[J]. Food Hydrocolloids, 2015, 51: 252-260. DOI:10.1016/j.foodhyd.2015.05.014.
[22] EASTOE J, DALTON J S. Dynamic surface tension and adsorption mechanisms of surfactants at the air-water interface[J]. Advances in Colloid & Interface Science, 2000, 85(2/3): 103-144. DOI:10.1016/ S0001-8686(99)00017-2.
[23] BARZILAY A, KOREN-LICHTIG H. Bioactive compounds protection method and compositions containing the same: EP, US8877232 B2[P]. 2014-11-04.
[24] KHALLOUFI S, CORREDIG M, GOFF H D, et al. Flaxseed gums and their adsorption on whey protein-stabilized oil-inwater emulsions[J]. Food Hydrocolloids, 2009, 23(3): 611-618. DOI:10.1016/j.foodhyd.2008.04.004.
[25] MAHMOUDI N, AXELOS M A V, RIAUBLANC A. Interfacial properties of fractal and spherical whey protein aggregates[J]. Soft Matter, 2011, 7: 7643-7654. DOI:10.1039/C1SM05262D.
[26] LI H J, ZHU K X, ZHOU H M, et al. Effects of high hydrostatic pressure treatment on allergenicity and structural properties of soy protein isolate for infant formula[J]. Food Chemistry, 2012, 132(2): 808-814. DOI:10.1016/j.foodchem.2011.11.040.
[27] ZHANG J B, WU N N, YANG X Q, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28(2): 301-312. DOI:10.1016/j.foodhyd.2012.01.006.
[28] MARTINEZ K, SANCHEZ C C. Ultrasound as a method to control protein-polysaccharide foam stability by microscopic parameter alteration[J]. Journal of Food Processing & Preservation, 2014, 39(6): 1272-1277. DOI:10.1111/jfpp.12345.
Effect of Ultra-High Pressure Processing on the Formation and Stability of Emulsions Containing Soy Protein and Soluble Polysaccharide Complexes
DING Jian, MA Wenjun, BI Shuang, QI Baokun, WANG Zhongjiang, SUI Xiaonan, JIANG Lianzhou*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The present study was undertaken to explore the effect of ultra-high pressure (UHP) processing the formation of emulsions containing soy protein and soluble polysaccharide complexes and to reveal the relationship between the structural change and emulsion stability of the complexes. For this purpose, the changes in the microstructure, particle size distribution, interfacial adsorption properties and spatial structure of soy protein after UHP modif i cation were studied using confocal laser technology, dynamic laser light scattering, contact angle measurement and circular dichroism. The experimental data showed that the droplet size of the emulsion became smaller, more regular in shape and more evenly distributed with increased pressure and the negative surface charge increased. UHP treatment at 400 MPa provided the maximum emulsifying activity and emulsion stability, which were 18.33 m2/g and 30.2 min, respectively. The secondary structure of soy protein changed after UHP treatments, thereby inf l uencing its bonding with soluble polysaccharides and the adsorption properties of protein at the oil-water interface and the interface pressure of the emulsion. These results uncovered that the stability mechanism of emulsions containing ultra-high pressure-modif i ed soy protein and soluble polysaccharides may related to the change in the molecular structure of the interfacial layer in emulsions.
ultra-high pressure treatment; fl exible protein; soluble polysaccharide; stability
10.7506/spkx1002-6630-201707016
TS214.2
A
1002-6630(2017)07-0096-06
丁俭, 马文君, 毕爽, 等. 超高压改性大豆蛋白与可溶性多糖复合物对乳液形成及稳定性的影响[J]. 食品科学, 2017, 38(7): 96-101. DOI:10.7506/spkx1002-6630-201707016. http://www.spkx.net.cn
DING Jian, MA Wenjun, BI Shuang, et al. Effect of ultra-high pressure processing on the formation and stability of emulsions containing soy protein and soluble polysaccharide complexes[J]. Food Science, 2017, 38(7): 96-101. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707016. http://www.spkx.net.cn
2016-04-13
“十二五”国家科技支撑计划项目(2014BAD22B01);国家高技术研究发展计划(863计划)项目(2013AA102101);黑龙江省自然科学基金重点项目(ZD201302);高等学校博士学科点专项科研基金项目(20132325110013)
丁俭(1989—),男,硕士研究生,研究方向为粮食、油脂及植物蛋白工程。E-mail:18845619206@163.com
*通信作者:江连洲(1960—),男,教授,博士,研究方向为粮食、油脂及植物蛋白工程。E-mail:jlzname@163.com
