蟾毒灵对大鼠吗啡成瘾消退及其重建的影响
2017-04-25陈宇涵赖莉丽陈爱贞蒋元杰陈爱琴
陈宇涵, 赖莉丽, 陈爱贞, 蒋元杰, 宋 夏, 杨 芳, 陈爱琴
蟾毒灵对大鼠吗啡成瘾消退及其重建的影响
陈宇涵1, 赖莉丽2, 陈爱贞1, 蒋元杰1, 宋 夏1, 杨 芳1, 陈爱琴2
目的 研究蟾毒灵在吗啡成瘾消退和重建中的药理作用。 方法 大鼠随机分为溶酶组和蟾毒灵组,每组各12只。腹腔注射盐酸吗啡并通过条件性位置偏爱装置建立吗啡成瘾模型后,2组分别注射溶酶和蟾毒灵(0.6 mg/kg)并检测其偏爱分值变化。 结果 蟾毒灵组在注射蟾毒灵后,偏爱分值降低,与后测值比较,差别有统计学意义(P<0.05),而且效应持续3 d以上;溶酶组的偏爱分值与后测值比较,差别无统计学意义(P>0.05)。成瘾消退后采用半剂量吗啡注射重建吗啡成瘾,蟾毒灵组和溶酶组的偏爱分值比较,差别无统计学意义(P>0.05)。 结论 蟾毒灵可促进大鼠吗啡成瘾的消退,但不影响成瘾消退后的重建。
肿瘤/*病理学; 肿瘤/*治疗; 吗啡依赖; 疾病模型,动物
药物成瘾的本质是一种慢性复发性脑病,形成机制复杂,目前的治疗方法只能减轻躯体依赖,但不能解除心理依赖,而且疗程结束后仍有相当高的复吸率。因此,探寻促进成瘾消退、抑制复吸的药物意义重大[1-2]。中药提取物蟾毒灵目前多用于抗肿瘤领域。研究表明其是有效的Na+,K+-ATP酶抑制剂以及强效稳定的麻醉镇痛剂[3-4]。本研究拟探讨药物成瘾时蟾毒灵在戒毒领域的运用机制,为临床用药提供新的参考。
1 材料与方法
1.1 材料
1.1.1 动物 健康雄性SD大鼠36只,体质量(200±25)g,清洁级[福建医科大学动物实验中心,许可证号:SCXK(闵)2012-0001]。在光照14 h、黑暗10 h、室温(25±1)℃条件下饲养,实验期间自由饮水和摄食。
1.1.2 药品与试剂 蟾毒灵(批号:P0512,福州市永恒生物技术有限公司),临用前用溶酶二甲基亚砜(DMSO)配成所需浓度;盐酸吗啡注射液(批号:131005-2,浓度10 mg/mL,东北制药集团沈阳第一制药有限公司)。
1.1.3 条件性位置偏爱实验装置 上海移数信息科技有限公司生产的条件位置偏爱系统(穿梭箱)。穿梭箱为三箱式,由2个隔板分为大小相同的2个条件训练箱70 cm×30 cm×34 cm(长×宽×高)和一个中间箱(13 cm×22 cm×27 cm),隔板放入时可将动物限制在某一个箱内,隔板取出时动物在整个穿梭箱内可以自由跑动。各箱的颜色和底板不同。一侧的训练箱四壁白色、底板为光滑的杆状,另一侧训练箱四壁黑色,底板为网格状,中间箱四壁灰色,底板为灰色树脂玻璃,底板和箱内的光线可调。箱内装有工业高清晰CCD摄像头,清晰度为600线,视频摄像系统既可在光亮条件下、也可在星光条件下,对动物进行连续的黑白摄像和分析。
1.2 方法
1.2.1 适应环境 将大鼠放入CPP箱体中让其在各箱体中自由活动15 min,连续3 d,以减少实验动物暴露于实验装置的新奇感与应激作用。
1.2.2 前测阶段 记录大鼠在每侧箱体停留的时间,测定其自然偏爱侧,非自然偏爱侧为伴药箱,结果所有大鼠均显示对黑箱的偏爱,故选择白箱为伴药箱。以前测阶段最后1天的偏爱分值作为前测值:

1.2.3 建立吗啡成瘾模型 选取前侧阶段偏爱暗箱的SD大鼠,前测试后的第1天开始为期5 d的条件训练。采取counterbalance设计方式,即将SD大鼠中的一半与药物搭配黑箱,另一半与药物搭配白箱。吗啡剂量为1 mL/kg(浓度10 mg/mL),生理盐水1 mL/kg,腹腔注射。每天上午半数大鼠注射吗啡,半数注射生理盐水,各自一半放白箱一半放黑箱,时间为45 min;上午注射吗啡的大鼠晚上注射生理盐水,上午注射生理盐水的大鼠晚上注射吗啡,上午放白箱的晚上放置于黑箱,上午放黑箱的晚上放置于白箱,时间均为45 min。上午和晚上2次注射时间间隔8 h以上。末次条件性训练24 h后,把大鼠放在中间箱体中,15 min内允许其在2个侧箱内自由活动,记录动物在两侧箱体内分别停留的时间。测定其偏爱分值并与前测值比较。若大鼠表现出对伴药侧的偏爱且有显著性差别,则确定已建立CPP吗啡成瘾模型。将未表现成瘾的大鼠剔除。
1.2.4 分组并给药 选取建立吗啡成瘾模型后的大鼠24只,随机分为2组(n=12)。 蟾毒灵组:单次腹腔注射0.6 mg/kg蟾毒灵(溶酶为DMSO);溶酶组:单次腹腔注射等剂量DMSO。给药后的大鼠每天检测1次偏爱分值。当溶酶组、蟾毒灵组大鼠的偏爱分值连续3 d和前测值比较,差别无统计学意义;与后侧值比较,差别有统计学意义时,则判定大鼠进入成瘾消退期,停止测试偏爱分值。
1.2.5 CPP模型重现测试 大鼠进入成瘾消退期后,用药物进行点燃测试(半剂量吗啡腹腔单次注射),5 min后把大鼠放在中间箱体中,15 min内允许其在两个侧箱内自由活动,由计算机自动记录动物在两个侧箱体内分别停留的时间,计算偏爱分值,如果偏爱分值显著高于消退期,而且差别有统计学意义则证明CPP模型重现。
1.3 统计学处理 结果以AV±SE表示,采用SPSS统计软件处理,采用t检验及ANOVA法进行显著性检验,P<0.05为差别具有统计学意义,并利用Graphpad prism软件绘制图表。
2 结 果
2.1 吗啡诱导大鼠CPP效应的表达 注射吗啡前,24只大鼠的偏爱分值前测值为(0.278 3±0.013 3);经过5 d的吗啡诱导训练,偏爱分值为(0.690 8±0.013 3),与前测值比较,差别有统计学意义(P<0.01),提示吗啡条件性位置偏爱成功建立,大鼠形成成瘾记忆(图1)。
2.2 蟾毒灵对大鼠吗啡成瘾消退的作用 蟾毒灵组大鼠偏爱分值显著降低为(0.355 8±0.069 7),而溶酶组偏爱分值为(0.648 3±0.046 5),注射蟾毒灵后偏爱分值与前测值比较,差别有统计学意义(P<0.05),而注射溶酶后偏爱分值与前测值比较差别无统计学意义(P>0.05),提示蟾毒灵可抑制大鼠的成瘾记忆(图2)。
为观测药物效应,持续3 d检测偏爱分值,蟾毒灵组大鼠偏爱分值分别为[(0.455 0±0.052 8),(0.430 8±0.065 8),(0.435 0±0.059 3)],与后测值比较差别有统计学意义(P<0.05,图3);溶酶组大鼠的偏爱分值分别为[(0.624 2±0.050 8),(0.631 7±0.047 1),(0.640 8±0.051 5)],与后测值比较差别无统计学意义(P>0.05,图4)。连续3 d蟾毒灵组偏爱分值均减低,提示蟾毒灵可促进大鼠吗啡成瘾记忆的消退。

与前测值比较,☆:P<0.01.图1 吗啡诱导大鼠位置偏爱效应的表达Fig 1 Expression of morphine-induced conditioned place preference
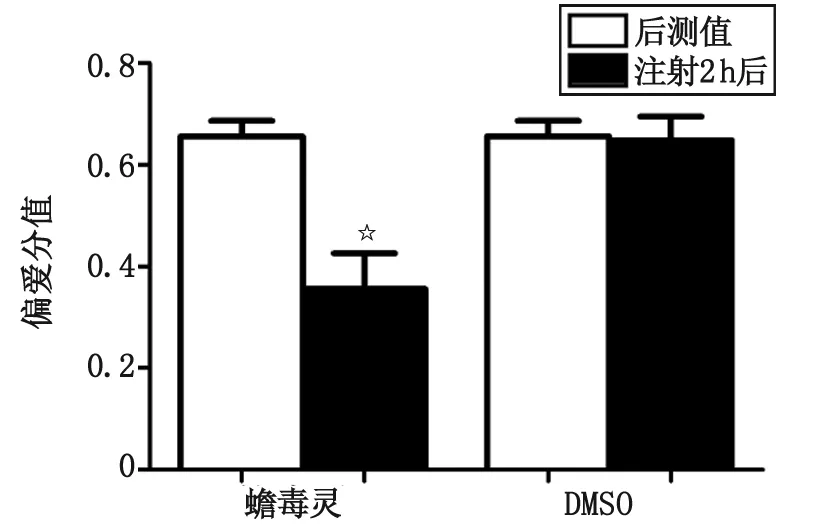
DMSO:二甲基亚砜. 与前测值比较,☆:P<0.05.图2 蟾毒灵对大鼠位置偏爱消退的影响Fig 2 The effects of Bufalin to extinction of morphine-induced conditioned place preference
2.3 蟾毒灵组和溶酶组大鼠吗啡成瘾的消退 溶酶组大鼠在注射DMSO 11,12,13 d后,其偏爱分值分别为[(0.308 3±0.028 0),(0.320 0±0.022 5),(0.318 3±0.030 8)],与前测值比较差别无统计学意义(P>0.05),与后测值比较差别有统计学意义(P<0.05),提示吗啡成瘾已消退;蟾毒灵组的偏爱分值一直维持在较低的水平,注射蟾毒灵10,11,12 d后,其偏爱分值分别为[(0.455 8±0.059 6),(0.345 0±0.065 8),(0.355 0±0.059 2)],与前测值比较差别均无统计学意义(P>0.05),与后测值比较差别有统计学意义(P<0.05),提示蟾毒灵组与溶酶组大鼠吗啡成瘾均已完全消退(表1)。
2.4 蟾毒灵对半剂量吗啡诱导大鼠CPP复燃的影响 大鼠CPP效应消退后,以半剂量吗啡和伴药箱作为引燃刺激,以探讨蟾毒灵是否影响成瘾消退后的重建。无论是蟾毒灵组还是溶酶组,半剂量注射吗啡后,偏爱分值明显增加[(0.560 8±0.040 4),(0.699 2±0.031 9)],与注射前的偏爱分值比较,差别有统计学意义(P<0.05),提示2组半剂量吗啡均成功重建吗啡成瘾。此外,点燃后2组之间的偏爱分值比较,差别无统计学意义(P>0.05),提示蟾毒灵对吗啡成瘾消退后的重建无明显抑制作用(图5)。
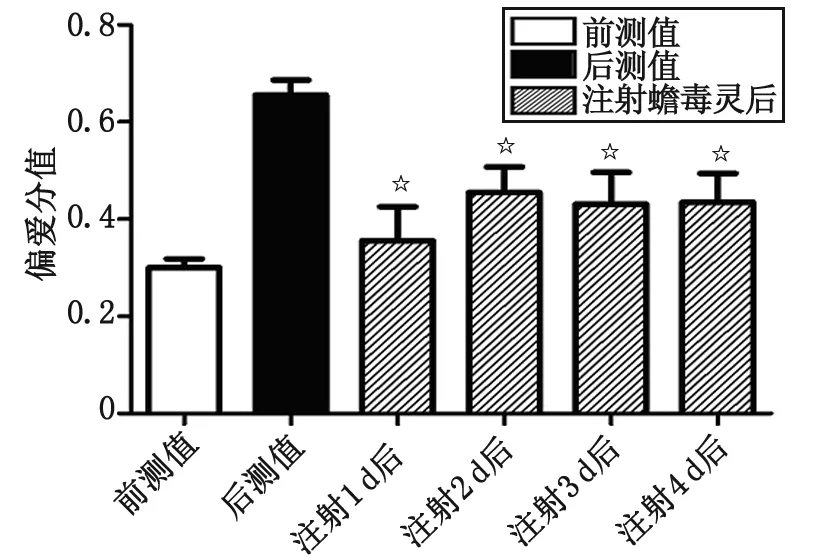
与后测值比较,☆:P<0.05.图3 蟾毒灵促进大鼠吗啡成瘾消退的持续时间Fig 3 The duration of Bufalin facilitates extinction of morphine-induced conditioned place preference
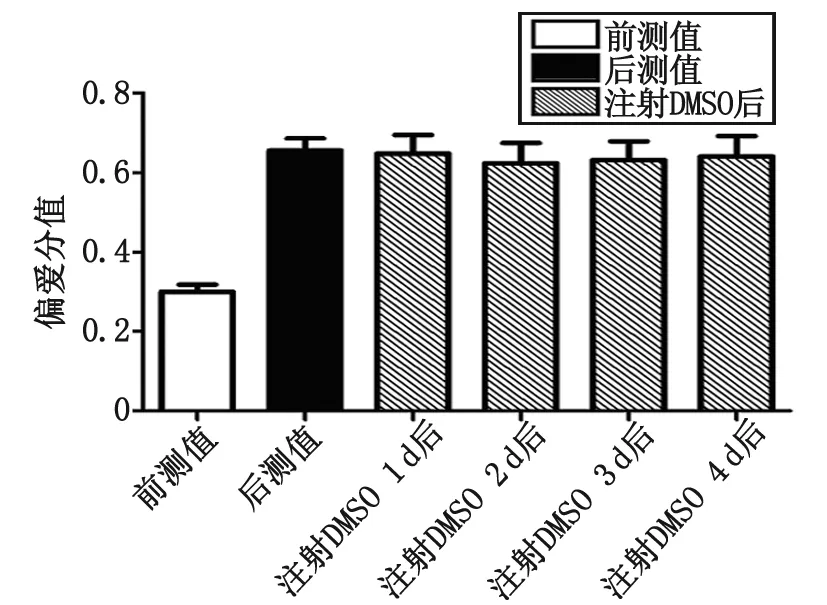
DMSO:二甲基亚砜.图4 注射溶酶后大鼠偏爱分值的变化Fig 4 The changes of preference value after injection DMSO
表1 蟾毒灵组和溶酶组大鼠在吗啡成瘾消退阶段的偏爱分值
Tab 1 The preference value of group bufalin and group DMSO in morphine-induced conditioned place preference extinction phase

时 间偏爱分值蟾毒灵DMSO前测值0.2783±0.01330.2783±0.0133后侧值0.6908±0.01330.6908±0.0133注射10d后0.4558±0.0596☆0.5752±0.0327注射11d后0.3450±0.0658☆0.3083±0.0280☆注射12d后0.3550±0.0592☆0.3200±0.0225☆注射13d后0.3183±0.0308☆
DMSO:二甲基亚砜. 与后测值比较,☆:P<0.05.
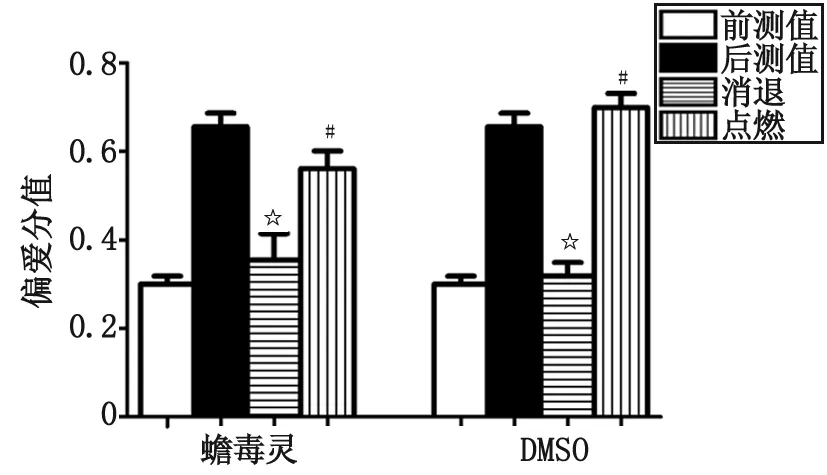
DMSO:二甲基亚砜. 与后测值比较,☆:P<0.05;与消退期偏爱分值比较,#:P<0.05.图5 蟾毒灵对大鼠吗啡成瘾消退后重建的影响Fig 5 The effects of Bufalin to the reinstatement of morphine-induced conditioned place preference
3 讨 论
本实验以CPP建立大鼠吗啡成瘾模型,以半剂量吗啡腹腔注射点燃,研究蟾毒灵对大鼠吗啡成瘾消退和重建的影响。蟾毒灵组单次腹腔注射蟾毒灵(0.6 mg/kg),对照组单次注射同等剂量的DMSO,比较偏爱分值的变化。结果表明,蟾毒灵可促进大鼠吗啡成瘾的消退,但不影响消退后吗啡成瘾的重建。
在药物成瘾的研究中,CPP模型是应用巴甫洛夫条件反射的原理,把药物与环境刺激反复结合后,动物会表现出对伴药环境(伴药箱)的偏爱,把药物的奖赏效应与伴药箱联系起来,表明大鼠形成了成瘾记忆。成瘾记忆是药物成瘾牢固性和持续性及高复吸率的关键机制[5]。
本研究观察到大鼠吗啡成瘾后腹腔内单次注射蟾毒灵,可降低大鼠CPP的偏爱分值,促进成瘾记忆的消退。蟾毒灵是中药蟾酥的药理成分之一,目前多用于抗肿瘤领域,有研究表明其是有效的Na+,K+-ATP酶抑制剂[3]。Hazelwood等发现,Na+,K+-ATP酶影响中枢DA系统的功能[6]。药物成瘾的机制研究表明,中脑腹侧被盖区(ventral tegmental area,VTA)脑内多巴胺(dopamine,DA)的增多是致使吗啡成瘾的原因之一,药物通过激活中脑边缘的多巴胺系统促进DA的释放,从而产生奖赏效应,致使药物成瘾[7-8]。因而,笔者推测蟾毒灵可能通过抑制Na+,K+-ATP酶的活性,影响到大脑奖赏通路多巴胺的功能,促进吗啡成瘾的消退。
研究表明,蟾毒灵具有平稳的镇痛麻醉作用,其镇痛效果是可卡因的30~60倍,且无局部刺激作用,其作用机理与肌细胞缓慢释放乙酰胆碱有关[4]。现有的中枢乙酰胆碱和药物成瘾的研究进展表明,乙酰胆碱对VTA投射到伏隔核的奖赏投射通路具有调节作用,胆碱能神经参与了药物的奖赏和自身给药行为[9]。Rezayof等发现,脑内微量注射胆碱能抑制剂能显著抑制吗啡或可卡因诱导的CPP及自发活动[10]。故蟾毒灵对大鼠吗啡成瘾消退的促进作用也可能是通过作用于中枢胆碱能神经,影响乙酰胆碱的释放,从而实现对药物奖赏和自身给药行为的调节。当然,由于阿片类药物成瘾机制非常复杂,涉及多系统多靶点的变化,蟾毒灵是否通过多个靶点发挥抗吗啡依赖与促进成瘾消退的作用及主要的作用靶点有哪些,尚需进一步的实验研究。
药物成瘾后复吸率居高不下,可能与成瘾记忆的牢固持久有关。实验大鼠成瘾记忆一旦形成后,将失去对药物的控制,药物戒除后,成瘾记忆仍处于潜伏状态;当重新暴露于药物或其他相关环境后,成瘾记忆很容易被唤起[11]。蟾毒灵可促进吗啡成瘾记忆的消退,然而本研究未观察到其对吗啡成瘾消退后重建的抑制,提示成瘾记忆并未被蟾毒灵完全擦除。下一阶段笔者拟通过多次注射蟾毒灵来进一步探究其对药物成瘾复吸的影响。
综上所述,蟾毒灵可以促进大鼠吗啡成瘾的消退,为今后精神药物及毒品戒断研究提供理论依据。由于蟾毒灵还具有强效的镇痛作用,理论上支持与吗啡等具有依赖性的镇痛药物临床联合使用,在优化镇痛效应的同时预防药物成瘾,这也为临床用药提供了新的思路。
[1] 张 乐,朱永平.不同分型的钙通道阻滞剂在吗啡成瘾中的作用[J].中国药理学通报,2011,27(2):152-155.
[2] 吴彬彬,葛仁山,连庆泉.应激对机体药物成瘾行为的影响和机制研究[J].中国药物滥用防治杂志,2015,21(1):40-43.
[3] Sweadner K J.Isozymes of the Na+,K+-ATPase[J].BiochimBiophysActa,1989,988(2):185-220.
[4] 高艳蓉,张 莉,张 磊.蟾酥及其有效成分的药理作用及机制研究进展[J].武警医学院学报,2003,12(5):406-408.
[5] Berke J D,Hyman S E.Addiction,dopamine,and the review momecular mechanisms of memory[J].Neuron,2000,25:515-532.
[6] Schmitz Y, Schmsuss C,Sulzer D.Altered dopamine release and uptake kinetics in mice lacking D2 receptors[J].JNeurosci,2002,22(18):8002-8009.
[7] 梁建辉,韩 容.行为敏化动物模型在药物依赖性评价中的应用[J].中国药理学通报,2004,20(7):726-730.
[8] Giros B,Jaber M,Jones S R,etal.Hyperlocomotion and indifference to cocaine and enphetamine in mice lacking the dopamine transporter[J].Nature,1996,379(6566):606-612.
[9] 马宝苗,周文华.中枢乙酰胆碱与药物成瘾的研究进展[J].中华行为医学与脑科学杂志,2009,18(12):1139-1140.
[10] Rezayof A,Nazari-Serenjeh F,Zarrindast M R. Morphine-induced place preference: Involvement of cholinergic receptors of the ventral tegmental area[J].EuropeanJPharmacology,2007,562(1):92-102.
[11] 王浩然,高祥荣,张开镐,等.药物成瘾及药物成瘾记忆的研究现状[J].生理学进展,2003,34(3):203-206.
(编辑:张慧茹)
The Effects of Bufalin on Extinction and Reinstatement of Morphine Addictive Rats
CHEN Yuhan1, LAI Lili2, CHEN Aizhen1, JIANG Yuanjie1, SONG Xia1, YANG Fang1, CHEN Aiqin2
1. Department of Clinical Medicine, Fujian Medical University, Fuzhou 350122,China; 2. Department of Physiology and Pathology Physiology, Basic Medical Sciences, Fujian Medical University, Fuzhou 350122,China
Objective To study the pharmacological actions of bufalin on extinction and relapse of morphine addictive rats. Methods We established the rat models of morphine addiction by using conditioned place preference. To explore the effects of bufalin on extinction and reinstatement of morphine addictive rats, the rats in the experimental group were given a single peritoneal injection of bufalin (0.6 mg/kg) after addiction while the control group only received an injection of same amount of DMSO. Results The preference value decreased significantly compared with the post-test value(P<0.05) after bufalin injection and the effects lasted at least 3 days. However, the preference value of the control group didn’t change significantly after injection of DMSO. Then half-dose of morphine was injected to reinstate conditioned place preferences after extinction. The results indicted both groups produced reinstatement and there was no significant difference between the bufalin group and the DMSO group. Conclusion Bufalin promotes the extinction of morphine addictive rats, while it does not affect half-dose of morphine reinstatement.
neoplasms/*pathology;neoplasms/*therapy;morphine dependence;disease models, animal
2016-09-13
国家自然科学青年基金(81100998);福建省自然科学基金(2016J01364);国家级大学生创新创业训练计划项目(201510392008)
福建医科大学,福州 350122 1.临床医学部;2.基础医学院 生理学与病理生理学系
陈宇涵,男,福建医科大学2013级临床医学专业学生
陈爱琴. Email:jesseaqc@163.com
R332; R730.1; R730.2; R730.5
A
1672-4194(2017)01-0006-04
