毛细管电泳—电感耦合等离子体质谱联用测定海藻中铅形态化合物
2017-04-25李景喜孙承君郑立蒋凤华尹晓斐陈
李景喜 孙承君+郑立 蒋凤华 尹晓斐 陈军辉 王小如


摘要 建立了毛细管电泳(CE)与电感耦合等离子体质谱(ICPMS)联用技术测定铅离子(Pb)、三甲基铅(TML)和三乙基铅(TEL)3种不同形态铅化合物的方法,以及海藻中不同形态铅化合物的提取技术,实现了海藻中3种铅形态化合物的定性定量分析。结果表明:以70mmol/LH3BO317.5mmol/LNa2B4O7(pH8.90)为缓冲溶液,在最佳CEICPMS條件下3种铅化合物20min内可实现有效分离,重现性较好,迁移时间RSD<4%,峰面积的RSD<5%;在10~200μg/L范围内3种铅化合物线性较好,相关系数大于090;Pb、TML和TEL的CEICPMS检出限(3S/N,以Pb计)分别为0091,0023和0030μg/L;采用分步提取海藻中Pb元素,提取率高达80%以上,以藻体为基底Pb,TML和TEL回收率分别为103.6%,95.7%和906%;通过检测紫菜和海带中铅含量,结果显示藻体内Pb主要以Pb形式存在。本方法具有简单、高效、样品消耗量少等优点,可为海藻及其它海产品的质量控制提供技术支撑。
关键词铅形态分析;毛细管电泳;电感耦合等离子体质谱;铅;藻类
1引言
铅元素分布广泛,能够在生物体内蓄积且排除缓慢,生物半衰期长,是具有高毒性的重金属环境污染物[1,2\];长期摄入微量铅化合物,会对神经系统、消化系统、生殖系统和造血系统等多个系统造成损伤,具有一定致突变效应和致癌性。随着工业的快速发展,汽车尾气的排放、煤的燃烧、涂料、电池和工业“三废”的排放都是环境中重要的铅来源[3\],尽管目前含铅汽油、焊料和涂料的使用越来越少,但铅化合物具有高稳定性,可在环境中滞留很长时间,且不易降解。近年发现,重金属元素的毒性取决其化学形态[4\],通常有机铅化合物的毒性大于无机铅化合物[5\],研究表明,四乙基铅和三乙基铅对人体的毒性最强,其毒性是无机铅的10~100倍[6\]。然而,藻类是海洋中的初级生产者,作为自养生物需从环境中吸取足够的无机盐,来进行同化作用[7\],当藻类从海洋环境中吸收铅,会在体内积累,不易代谢与降解。海洋中多种鱼和贝类以藻类为食,通过食物链的逐级浓缩,最终将重金属铅传递进入人体,对人类健康构成一种潜在的危险。因此,建立一种能够快速、准确地检测海藻和其它生物样品中有机铅和无机铅的方法尤为必要。
目前,根据形态分析的特点及试样的复杂性,许多研究者已尝试将离子色谱(IC)、高效液相色谱(HPLC)等现代分离技术,与电感耦合等离子体质谱(ICPMS)或原子荧光光谱(AFS)[8~12\]等元素选择性检测仪器结合来测定金属元素化合物的不同形态[13~16\],但大部分联用技术都存在分析时间长、操作复杂、灵敏度或准确性低等问题[17\]。与之相比,毛细管电泳(CE)则具有消耗样品少、分析速度快、高分离效率等优点[18\],而ICPMS在元素检测方面具有灵敏度高、元素选择性高、干扰小等优点,两者联用可成为一种强有力的元素形态分析工具[19~21\],自1995年Olesik等[22\]首次发表了CEICPMS联用技术的报道以来,此联用技术逐渐得到广泛关注及应用[19,23\]。
本研究通过优化流动相、分离电压及样品处理等条件,建立了CEICPMS联用技术测定海藻中重金属铅不同形态分析方法,此方法准确、可靠,不同铅形态化合物能有效分离,可为海产品安全评价和质量控制提供技术支撑。
2实验部分
2.1仪器与试剂
CEiSP20毛细管电泳仪(中国Reeko公司);Agilent7500a电感耦合等离子体质谱(ICPMS,美国Agilent公司);未涂层熔融石英毛细管(85cm,内径75μm,外径365μm,永年县锐沣色谱器件有限公司);MARS密闭微波消解仪(美国CEM公司);TTLDC氮吹仪(北京同泰联科技发展有限公司);FE20实验室pH计(梅特勒托利多仪器有限公司,上海);MilliQ超纯水处理系统(美国Milipore公司);真空冷冻干燥机(美国Labconco公司);AL104型电子天平(瑞士MettlerToledo公司)。
PbCl2(美国StremChemicials公司);氯化三甲基铅(TML)和氯化三乙基铅(TEL)(德国Dr.Ehrenstorfer公司);硼砂(分析纯,天津市天河化学试剂厂);硼酸(分析纯,上海亨达精细化工有限公司);NaOH(分析纯,天津市恒兴化学试剂制造有限公司);CTAB(美国Sigma公司);EDTA(华盛化工试剂公司);甲醇(色谱纯,上海化学试剂有限公司);浓HNO3、H2O2(优级纯,德国Merck公司);液氩(纯度99.999%);10mg/LLi,Co,Y,Tl和Ce的调谐溶液(美国Agilent公司);实验用水均为MIlliQ超纯水(18.2MΩ·cm)等。
2.2实验方法
2.2.1样品前处理采集新鲜海藻样品(如紫菜和海带等),洗净泥沙,取其可食部分作为样品, 20℃冷冻过夜后,冷冻干燥,再用粉碎机粉碎并过80目筛,密封保存备用。(1)HTK微波消解预处理准确称取约02000g干燥样品于100mL消解罐中,依次加入6mLHNO3和2mLH2O2,密封,常温下预消解约30min,放气,然后按表1消解程序进行微波消解,消解完全冷却后,用超纯水定重至25.0g,利用ICPMS测定样品中重金属铅的含量。(2)HTK不同铅形态提取有机铅:首先准确称量05000g样品于100mL圆底烧瓶中,加入10mL50%甲醇溶液,插上球形冷凝管,接上冷凝水管,进行微波辅助萃取,在搅拌转速为300r/min、温度为70~80℃、功率为400W下,每次加热5min,加热3次,每次间隔2min,冷却至室温,收集提取液,然后用022μm聚丙烯微孔滤膜过滤分离,重复上述提取步骤一次,收集两次过滤液得到有机铅提取液。无机铅:将以上剩余的残留物用10mL05mol/mL乙酸微波辅助萃取,搅拌转速为300r/min、温度为70~80℃、功率为400W下,每次加热5min,加热3次,每次间隔2min;冷却室温,提取液用022μm聚丙烯微孔滤膜过滤,重复上述提取步骤一次,收集两次过滤液得到无机铅提取液。将两种萃取液混合到一起,氮吹至近干,用少量运行缓冲稀释,待测,取20μL样品,加入适量EDTA螯合10min,最后稀释至400μL,进行CEICPMS检测。
2.2.2测定条件HTK(1)ICPMS条件射频功率ZH(1350W;采样锥为铂锥;采样深度6.5mm;等离子体气流速15.0L/min;载气流速1.2L/min;辅助气流速1.0L/min;雾化室温度2.0℃;JP积分时间1.0s。(2)HTKCE条件分离电压 13kV;毛细管柱(未涂层熔融石英毛细管)85cm×75μmi.d.;缓冲溶液70mmol/LH3BO317.5mmol/LNa2B4O7(pH8.90);电动ZH)进样时间为12s;泵速100μL/min;分离时间20min。每次测试前,分别用超纯水、1mol/LNaOH、0.1mol/LNaOH、运行缓冲溶液冲洗毛细管15min,每两次进样之间,分别用超纯水与运行缓冲溶液冲洗毛细管2min。所有溶液进样之前,均需用045μm滤膜过滤。
2.2.3标准溶液配置分别用超纯水将3种铅的标准贮备溶液逐级稀释,分别配制成浓度为10,20,50,100和200μg/L的混合标准溶液系列,超纯水作为标准空白。采用等离子体色谱软件计算各色谱峰的积分面积并绘制校准曲线。
3结果与讨论
3.1CE条件的优化
3.1.1分离电压与泵速的优化考察了分离电压( 10~ 15kV)对3种形态铅化合物的分离效果,实验结果表明,负电压较高時有利于提高雾化效率、缩短迁移时间,但负电压过高会增加毛细管的电场强度,产生大量的焦耳热,使分离峰逐渐变宽。综合考虑重现性、分离度和峰型,选择
13kV作为分离电压。同时,考察了CE泵速对分离效果的影响,结果表明,适当增大泵速有利于缩短迁移时间,提高灵敏度,但泵速增大到一定程度后,各种铅化合物会出现拖尾,重现性变差。最终选择泵速为40μL/min,Pb、TML和TEL的分离效果较好。另外,此泵速下通过三通接口实现了CEJP与ICPMS的高效连接(图1),通过负极支管泵入5%甲醇溶液,大大提高ICPMS的进样量和雾化效率,克服了CE进样量低的缺陷。
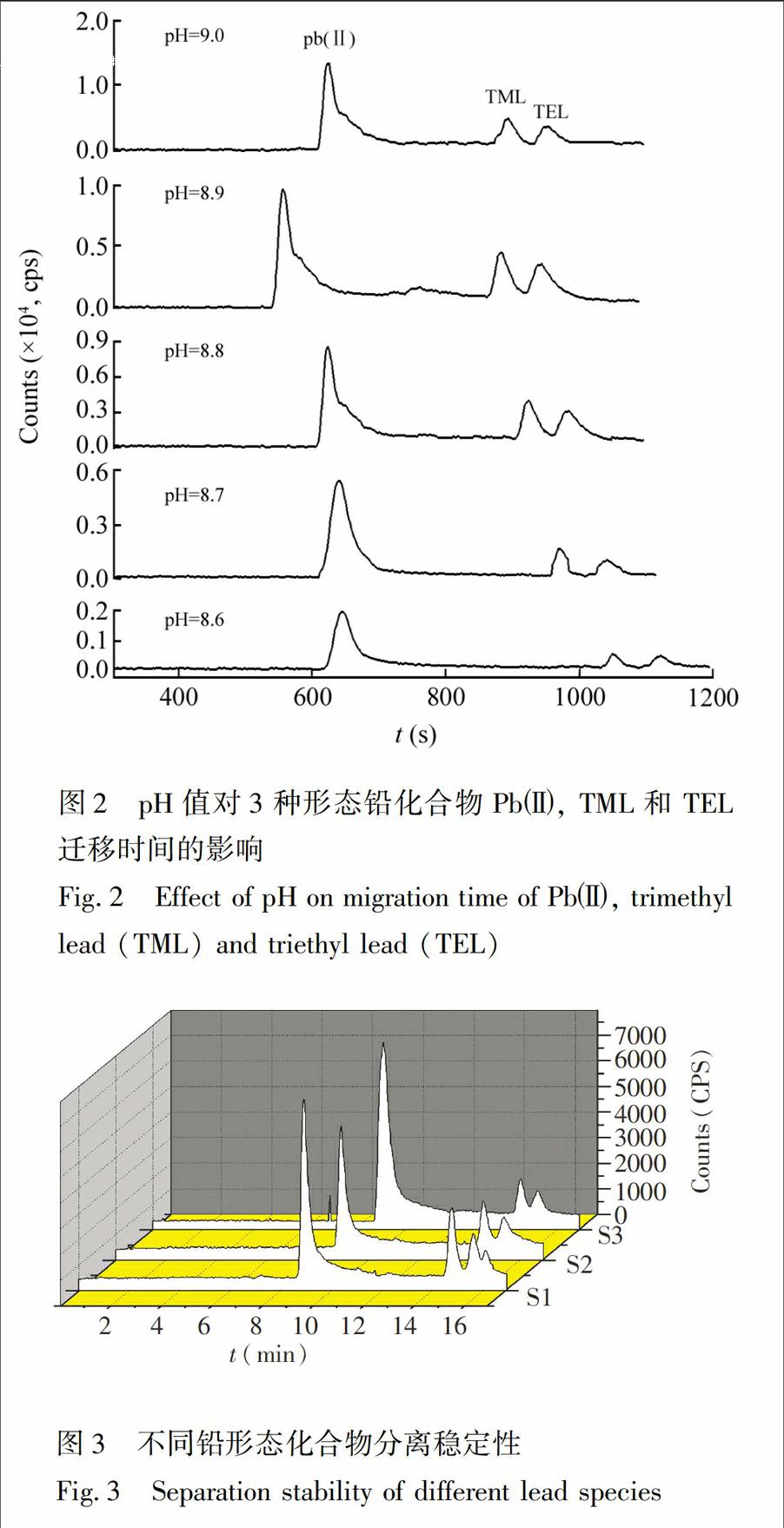
3.1.2缓冲液pH值的优化实验考察了H3BO3Na2B4O7缓冲溶液pH值在8.60~9.10范围内对3种形态铅化合物分离效果的影响,随着缓冲溶液pH值的改变,各峰的分离度、迁移时间、峰形、灵敏度均会发生变化(图2)。当pH﹥9.10时,Pb、TML与TEL虽能分离,但TML与TEL的分离效果较差;
当pH<9.00时,Pb、TML与TEL可以实现基线分离;当pH=8.90时,Pb、TML与TEL的分离效果、迁移时间、灵敏度均较理想;当pH<8.90时,Pb、TML与TEL均能完全分离,但各峰迁移时间延长,随pH值减小,TML与TEL迁移时间显著延长,综合考虑分离度和迁移时间,选择最佳pH=8.90。
3.2方法学考察
3.2.1稳定性分析在最佳CEICPMS条件下,考察了方法的重现性,重复测定3次100μg/L铅形态化合物标准溶液。3种形态铅化合物迁移时间的RSD<4%,峰面积的RSD<5%(图3),表明方法的稳定性和重现性较好。
3.2.2铅形态标准曲线及检出限最佳CEICPMS条件下,测定(10,20,50,100和200μg/L)的铅混合标准溶液(表2和图4),在10~200μg/L的浓度范围内,3种形态铅化合物的信号强度(峰面积)与浓度之间的线性相关系数均大于090;在连续进样模式下,Pb、TML和TEL的CEICPMS仪器检出限(3S/N)以铅计分别为0091,0023和0030μg/L。
3.2.3海藻中铅提取率为了考察提取方法的可靠性,研究中选取海带、海苔和紫菜样品(干样),采用微波消解和分步提取(合并提取液)法处理样品,利用ICPMS测定样品中分步提取铅化合物含量和微波消解后铅含量,结果表明,使用分步提取法提取铅化合物,提取率较高(表3)。
同时利用海带样品为基底,分别加入4μg/L3种铅形态化合物,提取后测定铅形态化合物,结果表CM(44明(表4):在海带藻类基质环境下铅形态化合物提取率较高,Pb,TML和TEL回收率分别为103.6%,CM)JP
3.3海藻中铅化合物测定
分别选择紫菜和海带2种海藻,利用加标回ZH(收方法,定性定量分析了海藻中铅形态化合物的存在形式和含量,将所得的铅化合物积分计算。
从图5和图6可见,紫菜和海带样品中铅化合物主要以Pb形态存在,浓度分别约为3.0μg/g(以Pb计,紫菜干重)和2.5μg/g(以Pb计,海带干重),基本不含有机铅形态TML和TEL,进一步证明了藻类细胞壁上含有大量与无ZH)机铅Pb结合的官能团,可与无机铅Pb充分接触,造成Pb2+络合吸收[24\];而有机铅大部分来源于环境中的尾气的排放和一些有机铅的脱烷基作用,然而海藻对其富集和机体内Pb转化甚少,实验说明藻类更容易积累无机铅化合物,可利用大型海藻进行海洋环境中Pb污染的净化修复。
4结论
建立了CEICPMS联用技术同时测定3种形态铅化合物Pb,TML和TEL的方法,样品消耗量少,3种形态的铅化合物能够较好分离,重现性较好,且灵敏度高,采用ICPMS检测器实现了较少进样量中Pb的测定;采用分步法提取海藻中铅形态化合物,方法简单、高效,回收率较好。在紫菜和海带样品中均只检测到无机铅Pb,未检测到TML和TEL。本方法通过优化分步提取前处理方法,采用CEICPMS联用技术,实现了海藻中铅形态的定性与定量分析,为海产品安全评价和质量控制提供了一种实用方法。
References
1(#FANGYong,YANGWenJian,CHENYue,MANing,HUQiuHui.J.ChineseCerealsOilsAssoc,2013,28(6):123-128JP
方勇,杨文建,陈悦,马宁,胡秋辉.HTK中国粮油学报,2013,28(6):123-128
2CHUBinBin,LUOLiQiang,XUTao,YUANJing,SUNJianLing,ZENGYuan,MAYanHong,YIShan.SpectroscopyandSpectralAnalysis,2012,32(7):1975-1978
储彬彬,罗立强,许涛,袁静,孙建伶,曾远,马艳红,易杉.HTK光谱学与光谱分析,2012,32(7):1975-1978
3DAIJie,QUJianGuo.Mod.Sci.Instru.,2008:76-82
戴洁,瞿建国.HTK现代科学仪器,2008:76-82
4FlorenceTM,CHENZheng.Res.Environ.Sci.,2008,2:8-12
FlorenceTM,陈铮.HTK环境科学研究,2008,2:8-12
5YUJingHua,ZHAOGuoQiang.ChineseJ.Anal.Lab.,2000,19(5):50-52
于京华,赵国强.HTK分析试验室,2000,19(5):50-52
6CHENWei,ZHOUYaoMing,ZHANGQianQian,YANGXiaoDi.JChangshuInstit.Technol.,2005,19(2):45-51
陈维,周耀明,张倩倩,杨小弟.HTK常熟理工学院学报,2005,19(2):45-51
7KongFX.Geol.Geochem.,1993,21(1):71-73
8KohlmeyerU,JantzenE,KuballaJ,JakubikS.Anal.Bioanal.Chem.,2003,377(1):6-13
9WANGZhenHua,HEBin,SHIJianBo,YINYongGuang,JIANGGuiBin.ChineseJournalofChromatography,2009,27(5):711-716
王振华,何滨,史建波,阴永光,江桂斌.HTK色谱,2009,27(5):711-716
10SchmeisserE,GoesslerW,KienzlN,FrancesconiKA.Anal.Chem.,2004,76(2):418-423
11YehCF,JiangSJ.Electrophoresis,2005,26(78):1615-1624.
12MatosReyesMN,CerveraML,CamposRC,GuardiaMDL.Spectrochim.ActaPartB,2007,62(9):1078-1082
13TaC,ReithF,BruggerJ,PringA,LenehanCE.Environ.Sci.Technol.,2014,48(10):5737-5744
14WUYaYing,GUIRenYi,TANGYun,CHENGJianZhong,YANGPing.ActaNutri.Sin.,2014,36(05):494-498
吴雅颖,桂仁意,汤鋆,程建中,杨萍.HTK营养学报,2014,36(05):494498
15JagtapR,MaherW,KrikowaF.Microchem.J.,2016,128:248-257
16KotrebaiM,BirringerM,TysonJF,BlockE,UdenPC.Analyst,2000,125(1):71-78
17CHENFaRong,ZHENGLi,WANGZhiGuang,SUNJie,HANLiHui,WANGXiaoRu.SpectroscopyandSpectralAnalysis,2014,17(2):42-50
陈发荣,郑立,王志广,孙杰,韩力挥,王小如.HTK光谱学与光谱分析,2014,17(2):42-50
18TimerbaevAR.Talanta,2000,52(4):57-606
19CHENYuHong,MIJianQiu,XULuZheng,ZHANGZhiXu,LIDeRen.Environ.Chem.,2011,30(7):1374-1377
陈玉红,米健秋,徐陆正,张之旭,李德仁.HTK环境化学,2011,30(7):1374-1377
20LIJinYing,LUShengHui,SHILei,ZHAOZhiJun,WUTao.J.Chin.Mass.Spectro.Soc.,2012,33(4):193-201
李金英,鲁盛会,石磊,赵志军,伍涛.HTK质谱学报,2012,33(4):193201
21ZHENGJinPing,ZHAOYunQiang,YANGMingWei,FUFengFu.ChineseJournalofChromatography,2011,29(2):111-114
鄭进平,赵云强,杨明伟,付凤富.HTK色谱,2011,29(2):111-114
22OlesikJW,KinzerJA,OlesikSV.Anal.Chem.,1995,67:1-12
23YangGD,XuJH,ZhengJP,XuXQ,WangW,XuLJ,ChenGN,FuFF.Talanta,2009,78:471-476
24ZHANGHuanLing,LIWenJun,LITie,ZHUMaoXu,YANGGuiPeng.MarineScienceBulletin,2013,32(2):214-220JP
張焕玲,李文君,李铁,朱茂旭,杨桂朋.HTK海洋通报,2013,32(2):214-220)
AbstractAmethodofcapillaryelectrophoresis(CE)combinedwithinductivelycoupledplasmamassspectrometry(ICPMS)wasestablishedforthedeterminationofleadion(Pb),trimethyllead(TML)andtriethyllead(TEL).Meanwhile,theextractiontechnologyofdifferentspeciesofleadinalgaewasestablishedandoptimizedforthequalitativeandquantitativeanalysis.Theresultsshowedthatthreekindsofleadcompoundscouldbeeffectivelyseparatedwithin20minbyCEICPMSwith70mmol/LH3BO317.5mmol/LNa2B4O7(pH8.90)asabuffersolution.Therewasagoodreproducibilityofmigrationtime(RSD<4%)andpeakarea(RSD<5%).Threekindsofleadcompoundshadgoodlinearrelationshipwithin10-200μg/Lwiththecorrelationcoefficientlargerthan090ThedetectionlimitsofPb,TMLandTEL(S/N=3,Pb)were0091,0023and0030μg/L,respectively.TheextractionrateofPbreachedmorethan80%byusingfractionalextraction,andtherecoveryratesofPb,TMLandTELwere103.6%,95.7%and906%,respectively,withalgaeasthesubstrate.TheleadcontentdetectionoflaverandkelpshowedthatPbinalgaemainlyexistedintheformofPb.Themethodhadtheadvantagesofsiplicity,highefficiencyandlowsampleconsumption,whichcouldprovidetechnicalsupportforthequalitycontrolofmarinealgaeandothermarineproducts.
KeywordsLeadspeciesanalysis;Capillaryelectrophoresis;Inductivelycoupledplasmamassspectrometry;Lead;Marinealgae
HQWT6JY(Received6July2016;accepted1September2016)
