小硅藻光合作用脂13KG—4C稳定同位素定量标记分析
2017-04-25宗春光李双徐继林李艳荣钟莺莺俞
宗春光 李双 徐继林 李艳荣 钟莺莺 俞雪钧 周成旭 严小军

摘要 以小硅藻(Nitzschiaclosteriumf.minutissima)作为研究對象,利用超高压液相色谱联用四极杆静电场轨道阱高分辨质谱技术,研究了处于平台期的小硅藻中的光合作用脂被13C标记的程度和速度。结果显示:在平台期13C人工标记的10天内,所有4类光合作用脂均被13C明显标记,其中二酰甘油双半乳糖脂(DGDG)、磷脂酰甘油(PG)、二酰甘油硫代糖脂(SQDG)被13C标记的总量,从刚进入平台期到平台期第8天逐渐增加,此后出现下降趋势,在第8天分别达到最大值(173±24)ng/mg,(473±41)ng/mg及(1224±21)ng/mg,标记率分别达到56.3%,38.4%和62.6%;而二酰甘油单半乳糖脂(MGDG)被13C标记的总量在整个平台期呈现持续上升趋势,并在第10天达到(956±51)ng/mg,标记率为87.3%。可见,不同脂质在藻体内合成的先后时间有差别,为了清晰地了解生物摄食过程中对微藻中特定脂类的同化机理,需要藻体内被13C标记的每类脂质含量的最大化,针对DGDG、PG、SQDG,应选取标记了8天的微藻来投喂生物,而针对MGDG,则应选取标记了10天的微藻投喂生物。
关键词小硅藻;13C稳定同位素;静电场轨道阱高分辨质谱;定量标记
1引言
微藻作为海洋生态系统的初级生产者,在海洋生物圈的能量流动和物质循环中发挥着极其重要的作用[1\]。有些微藻营养丰富,富含多种不饱和脂肪酸如EPA、DHA等[2,3\],许多研究表明微藻是许多养殖生物特别是养殖贝类的优质饵料[4\]。而微藻对养殖贝类的营养价值跟蛋白质、碳水化合物关系不大,主要体现在其脂类组成上[5\]。与其它生物脂比较,微藻叶绿体的类囊体膜上有独特的脂类成分,其主要是单半乳糖甘油二酯(MGDG),双半乳糖甘油二酯(DGDG),硫代异鼠李糖甘油二酯(SQDG)和磷脂(PG),这些统称为光合作用脂[6\]。研究表明,不同微藻脂类组成不同,从而对养殖生物可能表现出不同的营养价值[7\]。已有许多有关生物对微藻脂类的同化效果的研究报道[4,8\],但这些研究大多是针对微藻中脂肪酸、甾醇组成,有关生物对微藻中光合作用脂同化的研究报道还很少见。
对代谢途径研究,同位素示踪被认为是最明晰的技术手段。早在上世纪70年代,就有学者利用14C放射性同位素示踪研究脂类物质在海洋桡足类中的代谢[9\]。而与放射性同位素相比,13C稳定同位素标记技术灵敏稳定,可用于长时间的示踪实验,又由于没有放射性同位素14C辐射的损伤,不会对所观测的过程带来扰动,近年来,该技术已经广泛应用于揭示物质在食物网中的循环路径和探究消费者之间的营养关系研究[10~12\],但这些研究大多是通过同位素比例质谱检测生物体内标记物同位素总量的变化,无法对特定脂类的同位素标记物进行跟踪监测。高分辨液相色谱质谱联用技术则可以通过多级质谱手段分析每一类脂上的同位素标记特性,近年来研究表明,稳定同位素示踪结合高分辨液质技术可以跟踪生物体内相关脂类合成代谢的变化,比如Li等[13]在含有被13C标记棕榈酸的细胞培养液中培养动物细胞,通过静电场轨道阱高分辨质谱(OrbitrapMS)技术探讨了动物细胞内磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI)和磷脂酰甘油(PG)等脂质分子之间的转化规律,而Elizabeth等在缺氮条件下用无机13C对微藻脂类标记,通过高分辨质谱技术发现藻体内约60%的三酰甘油(TAG)是从头合成的而非藻体内其它成分转化而来,且磷脂酰胆碱(PC)的极性头部来自甜菜碱脂(DGTS)的转化[14\]。
因此,也可通过对微藻进行13C稳定同位素标记后投喂生物的方法,跟踪生物对不同脂类的同化以探究生物体对微藻中不同光合作用脂的代谢机理,这就需要首先考察微藻中不同脂类被13C稳定同位素标记的速度和程度。本实验以小硅藻(Nitzschiaclosteriumf.minutissima)为研究对象,利用13C稳定同位素和超高压液相色谱联用四极杆静电场轨道阱高分辨质谱技术,建立了小硅藻平台期光合作用脂被13C稳定同位素人工标记方法,为探究生物对微藻脂类生物标记物的同化及对微藻体内脂质的富集提供了明晰的技术手段。
2实验部分
2.1仪器和试剂
UltiMate3000超高压液相色谱分析系统,QExactive四极杆静电场轨道阱高分辨质谱仪,HypersileGoldC18色谱柱(100mm×2.1mm,1.9μm),ThermoScientificXcaliber数据分析系统(美国ThermoFisherScientific公司);超纯水系统(法国Millipore公司)。
稳定同位素内标(Glycerol213C,16KG-3∶KG-5216KG-3∶KG-50)MGDG、(Glycerol213C,16KG-3∶KG-5116KG-3∶KG-53)DGDG、(Glycerol213C,18KG-3∶KG-5018KG-3∶KG-51)PG和(Glycerol213C,16KG-3∶KG-50~18KG-3∶KG-51)SQDG(美国AvantiPolarLipids公司);预实验中这4个脂质分子在小硅藻中均未检测到。甲酸(色谱纯,美国SigmaAldrich公司);NaH12CO3和NaH13CO3(13C原子数分数99%,美国Sigma公司);仪器外标校正液(美国SigmaAldrich公司);其它试剂均为色谱纯(美国Tedia公司)。
2.2实验方法
小硅藻种由宁波大学海洋生物实验室藻种室提供,海水经过砂滤后经棉花粗滤,再用045μm醋酸纤维滤膜过滤后加热煮沸灭菌,培养液采用NMB3培养液(KNO3100mg/L、KH2PO410mg/L、Fecitrate·5H2O3mg/L、VB16μg/L、VB12005μg/L)。初始接种量为6×105cell/mL,培养温度为(20±2)℃,光照强度的范围为3000~4000Lux,光暗周期12hKG-3∶KG-512h,每天摇动3次;采用血球计数板每天计数,在硅藻生长进入平台期时,将藻液分装到30个1000mL锥形瓶中,每瓶600mlL藻液,并分成2大组,每组15瓶。第一大组分成A,B,C,D,E5个小组,每组做个3平行;第二大组分成A1,B1,C1,D1,E15个小组,每组做个3平行。因空气中含有12CO2,为了提高13C的标记效率,将每瓶分别充N230min,排净瓶内剩余12CO2,然后,第一大组每瓶分别添加06gNaH13CO3(13C原子数分数99%,美国Sigma公司)进行13C人工标记;第二大组每瓶分别添加06gNaH12CO3作为对照组。藻液摇匀后,将所有的锥形瓶密封,为防止密封效果不佳,持续缓慢通入N2以维持瓶内低12CO2环境。每隔2天收藻1次,第1次收A和A1组,第二次收B和B1组,以此类推,连续收藻5次,将收获的藻液在5000r/min的条件下高速离心获取藻泥,并用超纯水洗3次以去除藻体表残留的NaH13CO3和NaH12CO3,藻样-80℃条件下冷冻干燥后备用。然后称取30mg藻粉,加入1KG-3∶KG-51氯仿/甲醇混合液(V/V)提取总脂,氮气吹干,离心过滤后用甲醇复溶后对总脂进行液相色谱质谱分析。
2.3LCMS分析
色谱条件:使用UltiMate3000液相色谱仪,通過HypersileGoldC18色谱柱进行分离,柱温45℃。流动相A为甲醇水(1KG-3∶KG-52,V/V),并添加001%LiCl作为助离子化电解质;流动相B为甲醇异丙醇溶液(1KG-3∶KG-53,V/V),并添加01%CHOOH作为助离子化电解质。洗脱梯度为:0~3min,90%~50%A;3~10min,50%~0%A;10~20min,0%A;20~201min,0%~90%A;201~25min,90%A。流速为02mL/min,进样量为10μL,样品进样分析前经02μm滤膜过滤(美国Millipore公司)。
质谱条件:采用QExactive四极杆静电场轨道阱高分辨质谱仪,全扫描正/负离子模式下(质量范围:m/z100~1300)调节分辨率为50000,自动增益控制(AGC)目标值10e6;采用加热电喷雾电离源(ESI),喷雾电压为3200V,离子传输管温度为280℃,鞘气压(N2)35arb,辅助气压(N2)15arb,气化室温度350℃;串联二级质谱选择高能量碰撞,碰撞电压70~90V不等。仪器使用前用外标液进行校正,在正离子模式下校正范围为m/z138~1822,主要成分为Caffeine、MRFApeptide(MetArgPheAla)和Ultramark1621(mixture,fluorinatedphosphazines);负离子模式下校正范围为m/z265~1880,主要成分为Sodiumdodecylsulfate、Sodiumtaurocholate和Ultramark1621(mixture,fluorinatedphosphazines)。
2.4数据处理和定量计算方法
通过ThermoScientificXcaliber软件进行数据分析,在正/负离子模式下,根据各种脂类在二级质谱(MS/MS)条件下的特征片段和保留时间进行定性分析。
通过计算13C标记的目标脂类与相应的内标峰面积的比值,得到半定量结果(ng/mg藻粉)。然后通过加和形式得到每类脂的总标记量,进而计算每类脂的标记率(被13C标记上脂分子的量与总量之比)。JP
3结果与讨论
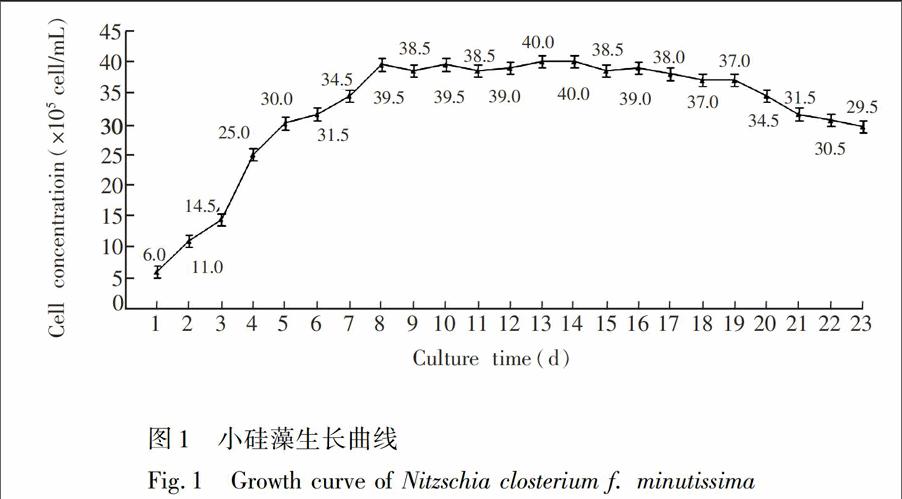
3.1细胞生长时期对小硅藻生物量的影响
细胞生长时期对小硅藻生物量的影响结果见图1。由图1可见,培养约3~9天属于对数期,10~20天属于平台期,从21天开始进入衰败期。为了确保在平台期对细胞内的脂类进行13C标记,本实验选取了第10天分别向实验组和对照组中添加含有13C和12C的NaHCO3。
3.2平台期被13C标记上的光合作用脂的定性与定量分析结果
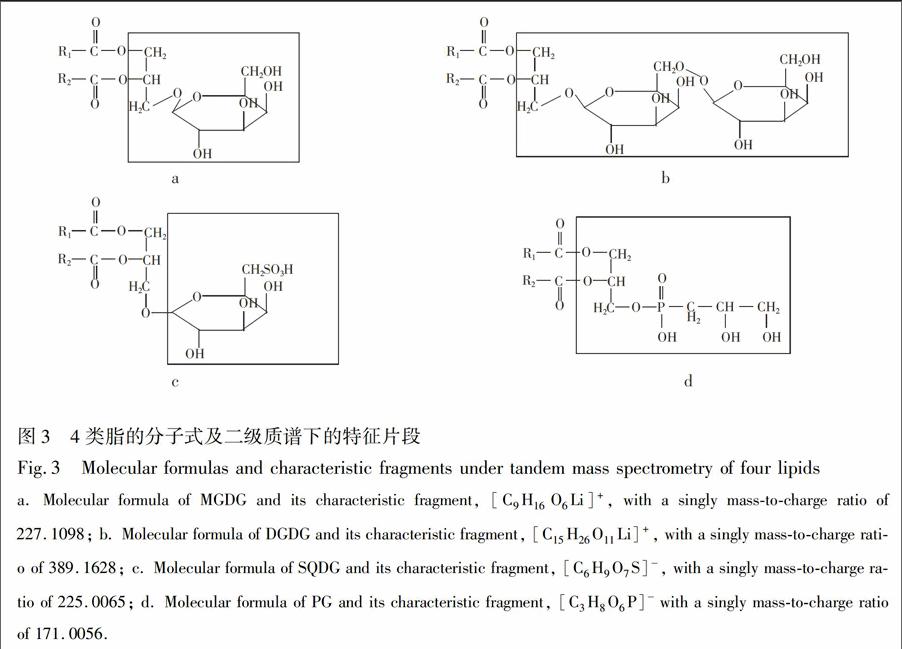
3.2.1平台期被13C标记上的光合作用脂的定性分析结果大量研究表明[15~17\],微藻在平台期由于N和P等营养盐缺乏,将会有更多光合固定的碳进入脂中,故选择此时加入含有13C的无机盐,微藻会利用培养液中的13C和从头合成脂类,从而实现对微藻中光合作用脂的13C稳定同位素标记。对平台期添加12C和13C两组样品分析发现:被13C标记上的脂类与同种利用12C合成的脂类相比,在相同的保留时间,在一级质谱上会出现一簇同位素峰[14\]。从两组样品中都检测出了所有的四类光合作用脂,即单半乳糖甘油二酯(MGDG)、双半乳糖甘油二酯(DGDG)、硫代异鼠李糖甘油二酯(SQDG)、磷脂酰甘油(PG)(表1),且这些脂均被13C明显标记(图2),阴影部分代表被13C标记的结果。另外,这4类极性脂在二级质谱谱图中均有各自的特征片段(图3)。
3.2.2平台期被13C标记上光合作用脂的定量分析结果参考已建立的脂类分析方法[18~21\],由图3可知,在正离子模式下,MGDG的特征离子片段为\[C9H16O6Li\]+其精确离子m/z227.1098,其极性头部含有9个C,可能会有1~9C被13C标记上,出现相应的特征片段JPm/z228.1133,229.1148,2301109,231.1139,232.1268,233.1299,234.1230,235.1367和236.1401;而DGDG的特征片段\[C15H26O11Li\]+,且m/z=389.1628,其极性头部有15C,可能有1~15C被13C标记,出现相应的特征片段m/z3901670,391.1701,392.1745,393.1664,394.1695,395.1732,396.1769,397.1825,398.1854,399.1884,4001941,401.1978,402.2008,403.2036和404.2119。在负离子模式下,SQDG的特征片CM(44段为\[C6H9O7S\] 且m/z=225.0065,极性头部的6C,可能会有1~6C被13C标记上,出现相应的特征CM)
片段m/z226.0095,227.0126,228.0170,229.0196,2300235和231.0267;PG形成特征片段\[C3H8O6P\] 且m/z=171.0056,极性头部含有3C,1~3C可能被13C标记上,出现相应的特征片段如m/z172.0089,173.0124和174.0155。另外研究发现MGDG,DGDG,SQDG和PG的生物合成途径:都是先合成二酰甘油骨架后,在相应酶的作用下,再将整个极性头部添加上去[22~25\]。故可以认为在这4类极性脂中,脂肪酸链优先于极性头部从头合成。因此,可以通过极性脂的特征片段,对被13C明显标记上的各类SQDG,PG,MGMG和DGDG进行定量分析。
在各类脂类化合物中,具有相同特征片段的物质非常多,就需要对检测到的离子准确定性。由于仪器的分辨率高达50000,所以根据碎片离子的精确质量就可以获得该离子可能的元素组成,再结合保留时间,就可以确定同一保留时间的离子是否为质量数相差1D的同一种物质,从而实现对13C同位素标记物的定量分析。以16KG-3∶KG-5016KG-3∶KG-51SQDG为例(图4),在负离子模式下,提取未标记样品的总离子流图(TIC)(图4a),并对保留时间7.72min、m/z791.4960(图4b)的分子离子进行二级质谱分析(图4c),根据该物质产生的特征离子片段(m/z225.0065)和中性丢失而产生的离子\[M-H-R1COOH\] (m/z537.2737)和\[M-H-R2COOH\] (m/z535.2731),鉴定出该物质为16KG-3∶KG-50~16KG-3∶KG-51SQDG,再根据标记样品中的TIC图(图5a)上对应的保留时间的质谱图(图5b),提出各被13C标记过的特征碎片的提取离子图(EIC)(图6),将7个峰面积相叠加即为标记组样品中合成的16KG-3∶KG-5016KG-3∶KG-51SQDG量,总量为6.333×108,将提取离子m/z226.0095,227.0126,228.0170,229.0196,2300235和231.0267的6个峰面积相叠加就是被13C标记上16KG-3∶KG-51~16KG-3∶KG-50SQDG的量,总量为2.703×108,基于此可计算出该脂的标记率约为42.7%。JP
3.3平台期光合作用脂对13C标记的程度和速度
利用上述的定量方法,将检测出的各个被13C标记上的SQDG分子的量叠加,即为SQDG被标记上的总量,这样可很方便计算出不同培养期SQDG标记量的变化(图7)。同样也可以计算出另外3类光合作用脂标记量的变化(图7)。从图7可见,在整个平台期DGDG、PG、SQDG被13C标记的总量呈现出先上升后下降的趋势,并在第8天达到最大值,其含量分别为(173±24)ng/mg藻粉、(473±41)ng/mg藻粉及(1224±21)ng/mg藻粉;而MGDG被13C标记上的总量,随时间的延长呈持续上升趋势,并在第10天达到了(956±51)ng/mg藻粉。
在碳源充足及细胞生理功能正常的条件下,硅藻可以通过细胞膜表面的载体蛋白直接把培养液中的H13CO 3运输到细胞内,然后在碳酸酐酶的作用下转化为13CO2供光合作用需求,最后大量转化为脂类[26,27\],因而被13C标记上的所有光合作用脂的量持续上升。理论上,随着培养时间的延長,被13C标记上的各类脂的含量应该增高,而后期13C对光合作用脂标记的量却下降,可能与培养液中13C的含量、脂类之间转化及细胞衰败等因素有关。另外发现从平台期第4~8天,在相同的时间点都满足SQDG被13C标记的总量>MGDG被13C标记的总量>PG被13C标记的总量>DGDG被13C标记的总量,在第8天被13C标记SQDG约占所有被13C标记光合作用脂的比高达43.4%,结果与某些硅藻中平台期SQDG的含量相似[28\]。Frentzen等[29\]对微藻中磷脂PG研究发现,在不同的生长时期尽管脂酰基组成变化显著,但其含量相对稳定,而本实验中磷脂PG对13C的标记量变化不大,与报道的结果相似。从图8中可知,DGDG,PG,SQDG的标记率都在第8天达到最高,分别为56.3%,38.4%和62.6%,而MGDG的标记率在第10天达到了87.3%。对比图7和图8可知,每类光合作用脂对13C标记的量和相对应的标记率随培养时间的变化趋势相近,说明了实验结果的可靠性。Martin[30\]通过13C将微藻中的脂类标记,再跟踪被13C的标记脂肪酸链,研究了微藻与桡足类之间的同化关系,但被13C被标记的脂肪酸链具体来自哪类脂未能鉴定。此外生物同化微藻体内的脂类主要以甘油酯为活性单元,而非游离的脂肪酸链。硅藻细胞内的DGDG、MGDG、SQDG都有典型的环型头部,理论上通过跟踪被13C标记环形头部的转移来研究微藻和养殖生物之间的同化关系,更加直观、简单。不同脂质在藻体内合成的先后时间有差别,进而导致13C标记情况的差异,为了清晰地了解生物摄食过程中对微藻中特定脂类的吸收、自身脂类的合成、转化、代谢等途径,我们首先要确定在哪个时期藻体内被13C标记的每类脂质含量的最大化,在该时期投喂生物,进而追踪该类脂质在摄食动物体内的动态走向,为后期系统阐明微藻对生物脂类影响机制打下脂类营养学理论基础。因此,对平台期的小硅藻而言,被13C标记的DGDG、PG、SQDG应选取第8天来投喂养殖生物,而被13C标记的MGDG应选取第10天投喂养殖生物。LM
4结论
本研究将13C稳定同位素示踪结合高分辨质谱技术,在精确到实际脂类分子结构和组成的组学水平上,通过高分辨液相色谱质谱联用技术对每一类脂上的同位素标志特性进行分析,并利用二级质谱下脂质形成的特征分子离子,实现13C标记脂质的定量分析,确定在哪个时期藻体内被13C标记的每类脂质含量的最大化.在该时期投喂生物,进而追踪该类脂质在摄食动物体内的动态走向,为后期进一步研究生物脂类风味形成的分子机理打下脂类营养学理论基础。所以,针对DGDG、PG、SQDG,应选取标记了8天的微藻来投喂生物;而如果针对MGDG,应选取标记了10天的微藻投喂生物。
References
1(#NIXueWen.Mar.Fish,2005,27(3):251-255
倪学文.HTK海洋渔业,2005,27(3):251-255
2DunstanGA,VollmanJK,BarrentSM,LeroiJM,JeffreySW.Photochem,1993,35(1):155-161
3LIHeFang,ZHOUHanQiu.OceanologiaLimnologiaSinica,1999,30(1):34-40
李荷芳,周汉秋.HTK海洋与湖沼,1999,30(1):34-40
4YangF,ChenS,MiaoZ,ShengZ,XuJ,WanJ,RanZ,ZhouL,ZhouH,ZhouC,YanX.Aquac.Nutr.,2015,22(4):846-856
5RiveroRodríguezS,BeaumontAR,LoraVilchisMC.Aquaculture,2007,263(1):199-210
6XuJ,ChenD,YanX,ChenJ,ZhouC.Anal.Chim.Acta,2010,663(1):6068
7LiS,XuJ,ChenJ,ChenJJ,ZhouCX,YanXJ.Aquaculture,2014,428429:104-110
8XuJL,ZhouHB,YanXJ,ZhouCX,ZhuP,MaB.J.Agric.FoodChem.,2012,60(15):3973-3980
9LeeRF,NevenzelJC,PaffenhfferGA,BensonAA.PattonS.BBA,1970,202(2):386-388
10RousselJM,PerrierC,ErkinaroJ,NiemelE,CunjakRA,HuteauDandRieraP.Global.Change.Biol.,2014,20(2):523-530
11SotoDX,WassenaarLI,HobsonKA.Functional.Ecol.,2013,27(2):535-543
12ReussNS,HamerlikL,VelleG,MichelsenA,PedersenO,BrodersenKP.Limnol.OceanogMeth.,2013,58(3):440-444
13LiJ,HoeneM,ZhaoX,ChenS,WeiH,LinX,ZengZ,WeigertC,LehmannR,XuG.Anal.Chem.,2013,85(9):4651-4657
14ElizabethHB,NicholasBB,DamianC,JosephLD,AnitaB,MiguelF,StevenNB,PaulGF,DismukesGC.Bioenerg.Res.,2012,5(4):876-885
15XUFang,CAIZhaoLing,CONGWei,OUYANGFan.J.ChongqingInstitute.Technol.,2005,19(1):96-100
徐芳,蔡昭铃,丛威,欧阳藩.HTK重庆工学院学报:自然科学版,2005,19(1):96-100
16WEIDong,ZHANGXueCheng,SUIZhengHong,XUHuaiShu.Mar.Sci,2000,24(7):46-50
魏東,张学成,隋正红,徐怀恕.HTK海洋科学,2000,24(7):46-50
17TANGNing,XINGRongLian,QIANZhenMing,WANGChangHai.J.YantaiUniversity:Nat.Sci.EngineeringEdition,2008,21(2):105-109
汤宁,邢荣莲,钱振明,王长海.HTK烟台大学学报:自然科学与工程版,2008,21(2):105-109
18XuJ,ChenD,YanX,ZhouC.Anal.Chim.Acta,2010,663(1):60-68
19YanX,ChenD,XuJ,ZhouC.J.Appl.Phycol.,2011,23(2):271-282
20LiS,XuJ,ChenJ,ZhouC.RapidCommun.MassSpectrom.,2014,28(3):245-255
21HsuFF,TurkJ.J.Am.Soc.Mass.Spectrom.,1999,10(7):587-599
22HeinzE,SchmidtH,HochM,JungKH,BinderH,SchmidtR.J.Org.Chem,1989,184(2):445-453
23RawylerA,MeylanBettexM,SiegenthalerPA.Biochim.Biophys.Acta,1992,1104(2):331-341
24BenningC.AnnuRev.PlantPhysiol.PlantMol.Biol.,1998,49(49):53-75
25MurphyDJ,WoodrowIE.Biochim.Biophys.Acta,1983,725(1):104-112
26AxelssonL,RybergH,BeerS.PlantCellEnviron.,2006,18(4):439-445
27ElzengaJTM,PrinsHBA,StefelsJ.Limnol.Oceanog.Meth,2000,45(2):372-380
28HarwoodJ.L.MembraneLipidsinAlgae.Berlin:SpringerNetherlands,1988,6:53-64
29FrentzenM.Curr.Opin.Plant.Bio.,2004,7(3):270-276.
30MartinG,CarolaA,GK.J.Exp.Biol.Mar.Ecol.,2005,317(2):109-125)
AbstractThediatomNitzschiaclosteriumf.minutissimawasselectedastheobjecttostudythe13Clabeledextentandspeedofphotosynthesislipidsbyultrahighpressureliquidchromatographycoupledwithquadrupoleorbitraphighresolutionmassspectrometry.Theresultsshowedthatallfourtypesoflipidwerelabeledclearlyby13Cwithin10daysinthestationaryphase.Thetotallabeledamountby13Cofdigalactosyldiacylglycerol(DGDG),phosphatidylglycerol(PG)andsulfoquinovosyldiacylglycerol(SQDG)increasedfromenteringthestationaryphasetotheeighthday,butdeclinedlater.AndthetotallabeledamountofDGDG,PGandSQDGreachedthemaximumof(173±24)ng/mg,(473±41)ng/mgand(1224±21)ng/mgontheeighthdaywiththelabeledrateof56.3%,38.4%and62.6%,respectively.Thetotallabeledamountby13Cofmonogalactosyldiacylglycerol(MGDG)showedacontinuedupwardtrendduringthe10days,andreached(956±51)ng/mgonthetenthday,withmarkedrateof87.3%.Itwassuggestedthatthesynthesizedtimeofdifferentlipidwasdifferent.Therefore,forstudyingassimilationmechanismofmicroalgaelipidsbymarineorganisms,thelipidcontentthatlabeledby13Cshouldreachthemaximum.SoifforDGDG,PGandSQDG,weshouldchoosethediatomlabeled8daysby13Ctofeedthemarineorganisms.MeanwhileifforMGDG,weshouldchoosethediatomlabeled10daysby13Ctofeedthemarineorganisms.
KeywordsNitzschiaclosteriumf.minutissima;13Cstableisotope;Quadrupoleorbitrapwithhighresolutionmassspectrometry;Quantitativemarker
HQWT6JY(Received6May2016;accepted8September2016)
ThisworkwassupportedbytheNationalNaturalScienceFoundationofChina(No.31172448).
