蜂胶中短叶松素的提取分离与含量测定*
2017-04-24文萍刘雯张娣康明陈乐
文萍 刘雯张娣 康明 陈乐
(江西省中医药研究院 南昌 330046)
蜂胶中短叶松素的提取分离与含量测定*
文萍 刘雯张娣 康明 陈乐#
(江西省中医药研究院 南昌 330046)
目的:研究蜂胶中短叶松素的制备工艺及含量测定方法,并测定和比较12个产地蜂胶中短叶松素的含量。方法:采用溶剂提取、大孔树脂吸附及葡聚糖凝胶色谱和重结晶等方法进行分离纯化,根据理化性质和核磁数据对化合物进行结构鉴定为短叶松素;用HPLC法测定蜂胶中短叶松素含量,YMC C18柱(4.6 mm×250 mm,5 μm),流速为1.0 m l·m in-1,甲醇-0.1%磷酸溶液(60∶40),检测波长:292 nm。结果:所得短叶松素的纯度在98.5%以上,短叶松素在8.512~425.6 μg线性关系良好,平均回收率(n=6)为98.60%,RSD为0.97%,12个产地的蜂胶中短叶松素以新疆、云南、陕西三地含量较高。结论:提取分离的短叶松素含量高,可作为含量测定用对照品,含量测定方法稳定、可靠,可作为蜂胶中短叶松素含量测定方法。
蜂胶;短叶松素;提取分离;含量测定
蜂胶具有抗过敏、抗炎、抗氧化、强化血管、抑制病毒、抗肿瘤、增强机体免疫力等保护身体健康、抵御疾病入侵的作用[1~2]。蜂胶中含有丰富的黄酮类[3]等生物活性成分,具有极为丰富的药理活性。短叶松素及其衍生物具有强化血管、抗菌、抗炎、抗氧化作用[4~5],还具防止肝功能损伤、保肝护肝的作用[6],也是发挥蜂胶功效的物质基础之一。蜂胶的分布非常广泛,不同产地的蜂胶中各成分含量参差不齐[7]。本文采用简单有效的方法提取分离出蜂胶中的短叶松素,并采用高效液相色谱法对12个产地的54批蜂胶中短叶松素含量进行了测定和比较,为蜂胶质量标准的制定及资源开发利用提供参考依据。现报告如下:
1 仪器与试药
1.1 仪器旋转蒸发仪(Eyela公司),低温循环水式真空泵(郑州长城科工贸有限公司),Waters 1525-2487-2707型高效液相色谱仪,TU-1810型紫外可见分光光度仪(北京普析通用仪器有限责任公司),中压液相色谱仪(Brucker公司),400 MHz和600 MHz核磁共振仪(Varian公司),M icromass Auto specultima ETOF型质谱仪,CQ-250超声波清洗器(上海船舶电子设备研究所),MettllerTkledoAG135双量程电子天平(十万分之一),SimplicityTM超纯水系统(M illipore公司)。
1.2 药品与试剂蜂胶为课题组收集云南(样品编号16、17)、四川(编号35、37、38)、江西(编号90、99、103、104、106)、湖南(编号110、111、117、118、119)、山东(编号128、129、142、151)、河南(编号27、28、30、43、45、46、47)、山西(编号49、50、52、57)、内蒙(编号130、134、136)、辽宁(编号53、138)、陕西(编号1、2、4、6、9)、甘肃(编号10、15)、新疆(编号31、41)、浙江(编号86、87、88、89)等地48个蜂胶及汪氏蜜蜂园有限公司提供的6批蜂胶,经江西省中医药研究院余良忠研究员鉴定为蜜蜂Apis ceranaFabr.将采自植物的枝条、叶芽及愈伤组织等的分泌物与上腭腺、蜡腺等的分泌物同少量花粉混合后所形成的黏性物质。短叶松素对照品(自制,纯度98.69%),AB-8型大孔吸附树脂(沧州宝恩吸附材料科技有限公司),葡聚糖凝胶Sephadex LH-20、CG161型大孔树脂(美国罗门哈斯公司),甲醇为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 短叶松素的提取分离参考文献[8]称取蜂胶原料约200 g,置于冰箱冷冻层24 h后,用粉碎机粉碎,过1号筛,加入1 000 m l的95%乙醇,振摇提取2次,每次提取4 h,滤过,回收乙醇,浓缩,真空干燥(80℃,-0.1 MPa)12 h,得蜂胶提取物。取蜂胶提取物倒入圆底烧瓶,加入200 m l 95%乙醇回流,至蜂胶提取物全部溶解。将蜂胶提取物乙醇溶解减压浓缩至适宜浓度,湿法上样,上大孔吸附树脂柱。甲醇-水溶剂系统(1∶10、2∶10、3∶10、4∶10、5∶10、10∶0)梯度洗脱,收集各段的洗脱液2 000 m l,按极性大小分为A、B、C、D、E、F。取D洗脱液,浓缩,将浓缩液上Sephadex LH-20葡聚糖凝胶柱。甲醇-水溶剂系统(1∶10、2∶10、3∶10、4∶10、5∶10、10∶0)梯度洗脱,收集各段的洗脱液2 000 m l,按极性大小分为AA、BB、CC、DD、EE、FF。组分CC经硅胶柱(石油醚-丙酮2∶1)及制备液相(40%~70%)得化合物(1 g)。经高效液相色谱归一法测定,其纯度>98.5%。
2.2 短叶松素的结构鉴定淡黄色针状结晶(甲醇)。1H-NMR(600 MHz,DMSO-d6)δ:11.89(1H,s, 5-OH),10.85(1H,s,7-OH),5.85(1H,d,J=6.6 Hz, 3-OH),7.38~7.53(5H,m,B环上的H),5.90(1H,d, J=1.8 Hz,H-6),5.94(1H,d,H-8),4.64(1H,dd,J= 11.4,6.0 Hz,H-3),5.19(1H,d,J=11.4 Hz,H-2)。13C-NMR(150 MHz,DMSO-d6)δ:83.4(C-2),72.0 (C-3),198.1(C-4),163.8(C-5),96.7(C-6),167.4 (C-7),95.6(C-8),163.0(C-9),101.0(C-10),137.8 (C-1′),128.6(C-2′,6′),128.7(C-3′,5′),129.1(C-4′)。以上数据与文献报道[9]一致,故鉴定为短叶松素(pinobaksin)。
2.3 短叶松素的含量测定
2.3.1 色谱条件的选择取对照品短叶松素约10 mg,精密称定,置25 m l量瓶中,加甲醇使溶解并稀释至刻度,摇匀,得浓度为400 μg·m l-1的对照品溶液。精密吸取上述溶液1 m l于10 m l容量瓶中,加甲醇至刻度摇匀。取上述对照品溶液置紫外分光光度计上进行光谱扫描,在292 nm有明显吸收峰。结果见图1。色谱条件选择YMC C18柱(4.6 mm×250 mm,5 μm),流速为1.0 m l·m in-1,检测波长:292 nm,按甲醇-0.1%磷酸溶液(60∶40)进行洗脱,结果蜂胶分离峰型好,分离度满足液相色谱要求。见图2、图3。
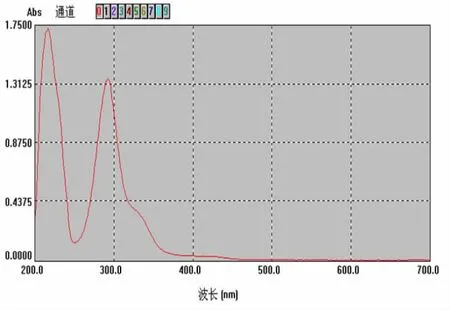
图1 短叶松素紫外光谱图

图2 短叶松素对照品色谱图
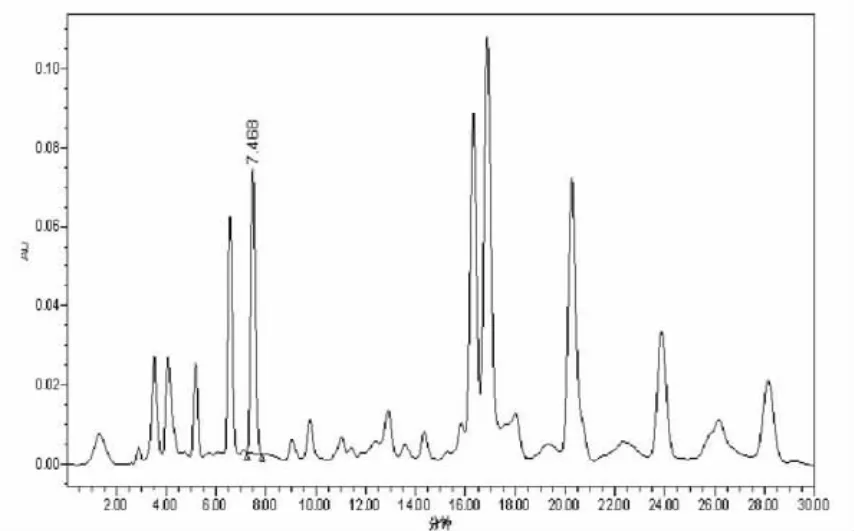
图3 蜂胶供试品色谱图
2.3.2 供试品溶液的制备取蜂胶药材约50 mg,精密称定,至25 m l容量瓶中,加甲醇适量,超声处理15 min取出,放置至室温,加甲醇至刻度,摇匀,用微孔滤膜(0.45 μm)滤过,作为供试品溶液。
2.3.3 线性关系的考察取对照品短叶松素约10.64 mg,精密称定,置25 m l量瓶中,加甲醇使溶解并稀释至刻度,摇匀得浓度为425.6 μg·m l-1的对照品溶液。将此对照品溶液分别稀释至1 m l含8.512、17.024、34.048、42.560、85.120 μg短叶松素的溶液。精密吸取上述短叶松素对照品溶液各10 μl,注入液相色谱仪中,在292 nm波长处测定其峰面积,将浓度对峰面积值进行回归,回归方程为Y=61 451.82X+22 195.95(R2=0.999 9),短叶松素在进样量8.512~425.6 μg,与峰面积值呈良好的线性关系。
2.3.4 精密度试验精密吸取同一供试品溶液10 μl,注入液相色谱仪中,重复进样6次,在292 nm处测定其峰面积,经数据分析,RSD=1.39%。
2.3.5 稳定性试验精密吸取同一供试品溶液10 μl,在不同时间点0、2、4、8、12、24 h注入液相色谱仪中,分别测定短叶松素峰面积,经数据分析,RSD=1.23%,表明供试品溶液在24 h内稳定。
2.3.6 重复性试验取同一批蜂胶药材共6份,测定短叶松素平均含量为0.60%,RSD=0.01%。
2.3.7 回收率试验取蜂胶供试品约25 mg共6份,精密称定,置25 m l量瓶中,分别精密加入短叶松素对照品溶液5 m l(1 m l含短叶松素42.56 μg),加入适量甲醇,超声处理15 m in,取出,放置至室温,加甲醇至刻度,摇匀,微孔滤膜(0.45 μm)滤过,注入液相色谱仪测定短叶松素含量,计算回收率。见表1。

表1 回收率试验结果
2.4 样品中短叶松素和咖啡酸的含量测定取54批蜂胶样品,按上述方法测定其短叶松素含量。见表2。

表2 合格蜂胶中短叶松素测定结果
3 讨论
本文以蜂胶中短叶松素为研究对象,考察其提取分离技术,成功在蜂胶中分离出短叶松素。从本文表2测定结果可知,54批合格蜂胶短叶松素的含量范围为0.95%~3.85%,平均含量为1.85%,结合本项目前期研究测得结果[10],规定蜂胶中短叶松素含量不得低于0.95%。由表2实验结果可以看出各地蜂胶中短叶松素平均含量有显著差异,云南2.42%、四川2.02%、江西1.48%、湖南1.77%、山东1.73%、河南2.30%、山西2.11%、内蒙1.66%、辽宁1.09%、陕西2.42%、甘肃1.63%、新疆2.66%,其中以新疆、云南、陕西三地含量最高。汪氏蜜蜂园有限公司提供的6批蜂胶中短叶松素平均含量为1.69%,也在合格范围内。通过对12省54批蜂胶药材中短叶松素的含量测定和比较,规定了短叶松素含量下限,为以后蜂胶质量和资源开发利用提供参考依据。
[1]孟晓英,王玉华,魏春琴.蜂胶药理作用研究概述[J].中国现代药物应用,2010,4(18):245
[2]蒋春红,吕武清,胡棠洪.蜂胶的药理作用研究概况[J].中国医药指南,2011,9(17):42-43
[3]张翠平,胡福良.蜂胶中的黄酮类化合物[J].天然产物研究与开发, 2009,21(6):1084-1090
[4]王馨.蜂胶黄酮对小鼠N2a细胞缺氧缺糖所致损伤的保护作用及机理研究[D].北京:中国农业科学院.2014.1-10
[5]尹志华.云南蜂胶对四种牙周主要可疑致病菌作用的实验研究[D].昆明:昆明医科大学.2012.24-44
[6]杜夏.蜂胶保肝活性成分的分离及其保肝机制初探[D].北京:中国农业科学院.2013.23-33
[7]吴健全,高蔚娜,韦京豫,等.不同产地蜂胶成分含量的比较[J].中国食物与营养,2013,19(7):62-65
[8]吕武清,文萍,姚剑平,等.蜂胶提取物制备工艺研究[J].中草药, 2014,45(6):791-794
[9]安宁,杨世林,邹忠梅,等.高良姜黄酮类化学成分的研究[J].中草药, 2006,37(5):663-664
[10]文萍,范婷婷,吕武清,等.RP-HPLC测定蜂胶中乔松素、白杨素和高良姜素的含量[J].中国实验方剂学,2013,19(19):108-110
R284.2
B
10.13638/j.issn.1671-4040.2017.01.091
2016-09-27)
江西省科技计划项目(编号:20141BBG70075)
#通讯作者:陈乐,E-mail:76349830@qq.com
