不同小麦品种(系)穗部表皮蜡质的成分及含量分析
2017-04-24杨昊虹夏凌峰王中华李春莲
杨昊虹,史 雪,夏凌峰,汪 勇,王中华,李春莲
(西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
不同小麦品种(系)穗部表皮蜡质的成分及含量分析
杨昊虹,史 雪,夏凌峰,汪 勇,王中华,李春莲
(西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
为了比较分析不同小麦基因型穗部蜡质成分及其含量的差异,以17个小麦品种(系)为材料,利用GC-MS和GC-FID对其穗部蜡质的成分和含量进行定性和定量分析。结果表明,从小麦穗部蜡质中共分离鉴定出24种化合物,其中主要为二酮,其次为烷烃、脂肪醇,还有少量的脂肪酸和醛。不同小麦品种(系)穗部蜡质在成分上并无明显差别,但蜡质总量和各组分含量差异明显。16个表皮具有白霜状的小麦品种(系)穗部表皮蜡质总量远高于无白霜小麦品种(中国春),白霜状小麦品种(系)穗部蜡质中二酮约占81.03%,而中国春穗部蜡质中二酮和烷烃的比例相当,分别占总蜡质的38.36%和38.14%;β-二酮在所有小麦品种(系)的穗部蜡质中都存在,但β-二酮衍生物羟基β-二酮仅存在于有白霜的小麦品种(系)表皮蜡质中。
小麦;穗部蜡质;化学组成;蜡质含量
植物表皮蜡质是附着在植物表层的一类疏水性物质,主要由可溶于有机溶剂的超长链脂肪酸及其衍生物组成[1]。表皮蜡质将植物与外界环境有效地隔开,可以维持植物表面清洁,抵御紫外线辐射,防止病虫、病原菌对植物的侵害,在植物的生长发育中具有重要作用[2-6]。此外,表皮蜡质还可以有效防止植物的非气孔性水分散失[7-9],但水分散失程度与表皮蜡质的含量并无相关性,而蜡质的化学成分是决定表皮水分散失的主要因素[10]。植物表皮蜡质的成分和含量并非固定不变,它会随着植物种类[11]、组织器官[12]、生育时期[13]及外界环境[14]的不同而呈现差异性。
小麦是重要的粮食作物之一,其高产与稳产对国家粮食安全至关重要,但是干旱胁迫严重制约着小麦产量。张正斌等[15]对18个小麦品种的抗旱性研究发现,水分充足时小麦表皮蜡质分泌较少,当受到干旱胁迫时,小麦表皮蜡质的分泌随着干旱程度的加重而越来越多,并且大多数小麦品种在干旱条件下,苗期会表现出明显的蜡质性状。因此,研究小麦蜡质成分和含量,不仅有利于揭示小麦的抗旱机理,也为抗旱新品种选育提供了一条新思路。目前,通过气相色谱-质谱联用技术已经鉴别出小麦叶片蜡质主要是由脂肪醇、烷烃、脂肪酸、醛和二酮组成[3]。Adamski等[16]研究认为,小麦旗叶蜡质成分主要为初级醇、二酮和烷烃。这些研究对于小麦叶表皮蜡质的成分及含量进行了测定,但是缺少对于小麦穗部蜡质的分析。本研究比较分析了不同小麦品种(系)穗部蜡质的成分及含量,以期为进一步揭示小麦抗旱性与蜡质之间的关系提供参考。
1 材料与方法
1.1 小麦材料
本实验主要选取了17个小麦品种(系),其中16个品种(系)的地上部器官表皮均覆盖不同程度的白霜状蜡质,分别为陇麦135、陇麦328、周麦22、鑫禾009、周口6、浚麦35、周1、西农501、西农979、陕垦99、泛麦5号、黄化113、丰德存麦1号、兰麦1号、陕农33和轮选715,而中国春不具有白霜状表型,呈嫩绿色。参试材料于2015年种植于西北农林科技大学标本区,于次年小麦抽穗期采集穗部颖壳,抽提蜡质进行蜡质成分及含量的测定。
1.2 方 法
1.2.1 样品制备
在小麦抽穗期,用镊子采集穗部颖壳作为供试样品,每个品种(系)样品设三个重复。室温环境下于通风橱中用30 mL三氯甲烷浸提样品1 min,提取液中加入20 μL C24烷烃(1 mg·mL-1)作为内标,混匀后用漏斗对提取液进行过滤。待过滤液自然挥发至1 mL时将浓缩液转入GC样品瓶中。用氮气将样品瓶中液体吹干,加入30 μL吡啶,再加入等量的硅烷化试剂BSTFA(N,O-Bis(trimethylsilyl) trifluoroacetamide N,O-双(三甲基硅烷基三氟乙酰胺)),70 ℃衍生反应60 min。使用氮气恒温吹干仪将衍生液吹干后加入1 mL三氯甲烷回溶,供GC分析。另收集浸提完蜡质的颖壳置于烘箱中,烘干水分后称取干重,用于计算蜡质各组分的绝对含量。
1.2.2 蜡质成分分析
蜡质成分采用GC-MS-QP2010(日本岛津公司)进行测定分析。具体分析条件:进样量1 L,进样温度280 ℃,分流比2∶1,检测器温度320 ℃,扫描离子50~600 amu,载气为氦气。升温程序:50 ℃保持2 min;以20 ℃/min升温至200 ℃,保持2 min;再以2 ℃/min升温至320 ℃,保持15 min。蜡质中各组分化合物依据沸点不同得以分离,再根据所得化合物的离子峰图检索质谱数据库,完成各组分化合物的鉴定。
利用气相色谱-火焰离子化检测仪(GC-2010Plus,日本岛津公司)对蜡质各个化合物峰面积进行积分,参照所加内标,完成各组分化合物的定量分析。
2 结果与分析
2.1 小麦穗部表皮蜡质组分的碳链分布
对提取的小麦穗部蜡质进行GC-MS分析,共鉴别出24种化合物,分别为2种二酮、6种烷烃、6种脂肪醇、5种脂肪酸和5种醛。其中,烷烃主要由碳链长度为C23~C33奇数碳原子的饱和烷烃组成;脂肪醇的碳链长度变化范围为C22~C32,主要为偶数碳原子;脂肪酸主要由C16~C28的偶数碳原子酸组成;醛碳链变化范围为C22~C30,并且以偶数碳原子形式存在;二酮主要由碳链长度为C31的β-二酮及其衍生产物羟基-β-二酮组成。
2.2 小麦穗部表皮蜡质的化学成分含量
测定结果(图1)表明,小麦穗部蜡质主要由二酮、烷烃、脂肪醇、脂肪酸和醛组成。16个具有白霜状蜡质的小麦品种(系)的分离总物质中,二酮约占70.68%~88.29%,烷烃占7.00%~23.20%、脂肪醇占1.62%~5.43%,脂肪酸占1.50%~3.96%,醛占0.80%~1.65%。中国春穗部蜡质中这几种化合物分别占分离总物质的38.36%、38.14%、17.94%、4.31%和2.93%。白霜状小麦品种(系)的穗部蜡质总量明显高于中国春,而且在白霜状小麦品种(系)穗部蜡质成分中二酮占绝对主导地位,而中国春的穗部蜡质成分中则以二酮、烷烃占主导地位。
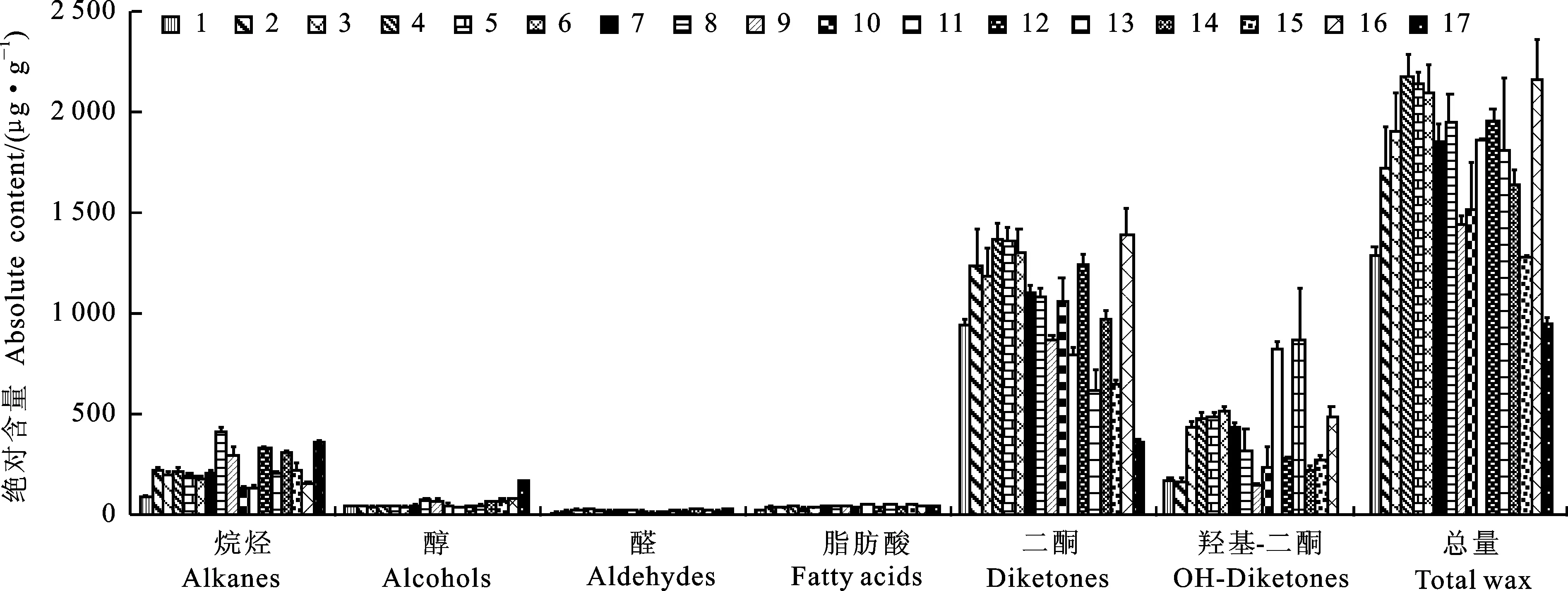
1:陇麦135;2:陇麦328,;3:周麦22;4:鑫禾009;5:周口6;6:浚麦35;7:周1;8:西农501;9:西农979;10:陕垦99;11:泛麦5号;12:黄化113;13:丰德存麦1号;14:兰麦1号;15:陕农33;16:轮选715;17:中国春。下同。
1:Longmai 135; 2:Longmai 328; 3:Zhoumai 22; 4:Xinhe 009; 5:Zhoukou 6; 6:Xunmai 35; 7:Zhou 1; 8:Xinong 501; 9:Xinong 979; 10:Shaanken 99; 11:Fanmai 5; 12:Huanghua 11; 13:Fengde 1; 14:Lanmai 1; 15:Shaannong 33; 16:Lunxuan 715; 17:Chinese Spring. The same below.
图1 不同小麦品种(系)穗部蜡质各组分和总蜡质的绝对含量
Fig.1 Absolute content of each group of wax components and total wax load on spikes of different varieties(lines)
2.3 不同小麦品种(系)穗表皮蜡质成分及含量的比较
经进一步比较分析,17个小麦品种(系)的穗部蜡质中烷烃所占比重仅次于二酮,主要由C23、C25、C27、C29、C31、C33烷烃组成,其中在多数小麦品种(系)中主要以C31烷烃为主,而在陕垦99、陇麦135、陇麦328、轮选715和中国春中则以C29烷烃为主(图2-A)。小麦穗部蜡质中脂肪醇的含量低于二酮和烷烃,并且主要以C24或C28醇为主,与其他小麦品种(系)相比,中国春的脂肪醇含量较高,其中所含的C22、C30、C32醇的含量远高于其他16个小麦品种(系),甚至在部分小麦品种(系)中并未检测到C32醇(图2-B)。脂肪酸和醛在小麦穗部中的含量很少,其中脂肪酸以C16酸为主,而醛以C30醛为主(图2-C,2-D)。
对小麦穗部蜡质中二酮进行比较发现,虽然小麦穗部蜡质的主要成分为二酮,但在不同品种(系)中,二酮的含量存在较大差异(表1)。白霜状小麦品种(系)的穗部蜡质中均积累了大量二酮,其中轮选715的二酮含量最高,中国春穗部蜡质中β-二酮含量远低于白霜状小麦品种(系),说明蜡质组分中二酮含量的差异是造成小麦蜡质表型存在差异的主要原因。另外,β-二酮衍生产物羟基-β-二酮仅存在于16个白霜状小麦品种(系)中,而在中国春穗部蜡质中并不存在,而且在大多数的小麦品种(系)中,β-二酮含量均高于羟基-β-二酮,但在泛麦5号和丰德存麦1号中除外。
3 讨 论
先前的研究结果表明,小麦叶表皮蜡质的主要成分为烷烃、脂肪醇、二酮、脂肪酸和醛[17]。本试验所鉴定的17个小麦品种(系)穗部蜡质的主要成分与此相同,但小麦叶片蜡质中脂肪醇含量最高[3,17-18],而穗部蜡质中则以二酮为主要成分,说明小麦不同组织器官中蜡质组成无太大差异,但各组分含量差异明显。许多研究表明,造成小麦白霜状表型差异的主要原因是蜡质组分中二酮的含量不同所造成的[19]。本研究结果显示,16个白霜状小麦品种(系)穗部蜡质中二酮含量约占总蜡质含量81.03%,而中国春中二酮含量约占总蜡质的38.36%,这一结果验证了小麦白霜状表型与蜡质组分中二酮含量存在直接关系。

图2 不同化合物碳链长度分布及蜡质含量
Table 1 Comparison of diketone content on spikes of different varieties(lines)

品种(系)Variety(line)绝对含量Absolutecontent/(μg·g-1)β⁃二酮β⁃diketones羟基⁃β⁃二酮OH⁃β⁃diketones总二酮Totaldiketones陇麦135 Longmai135945.00±30.58efg167.71±15.33f1112.70±45.91efg陇麦328 Longmai3281238.51±184.85abcd158.01±26.44fg1396.53±211.29cde周麦22 Zhoumai221180.13±147.71bcd433.06±30.47bcde1613.20±178.17abc鑫禾009 Xinhe0091367.90±83.86ab480.94±25.14bcd1848.82±109.00ab周口6 Zhoukou61362.40±65.77ab488.58±16.64bc1851.02±82.42ab浚麦35 Junmai351302.70±117.99abc519.43±17.80b1822.09±135.79ab周1 Zhou11103.60±39.44cde436.68±21.84bcde1540.31±61.28bc西农501 Xinong5011080.3±42.59de316.51±111.35cdef1396.83±153.93cde西农979 Xinong979871.2±17.0fg149.25±7.95fg1020.45±24.96fg陕垦99 Shaanken991056.0±117.69def233.35±91.71f1289.30±219.40cdef泛麦5号 Fanmai5794.6±95.36gh825.78±94.92a1620.36±190.28abc黄化113 Huanghua111247.0±47.17abcd278.78±5.16ef1525.74±52.34bc丰德存麦1号 Fengde1620.5±102.99h869.33±259.49a1489.83±362.49cd兰麦1号 Lanmai1972.4±43.41efg224.38±20.79f1196.82±64.20defg陕农33 Shaannong33646.2±24.41h271.25±20.33ef917.40±44.74g轮选715 Lunxuan7151388.4±135.30a487.58±46.62bc1876.00±181.92a中国春 ChineseSpring364.2±7.06i0.00g364.17±7.06h
同列数据后不同字母分别表示不同品种(系)间在0.05水平上存在显著性差异。
Different letters after the values in same column indicate significant differences among different varieties(lines) at 0.05 level.
目前,通过对拟南芥等植物表皮蜡质合成通路的研究,基本上已阐明植物蜡质合成主要包括脱羰途径和酰基还原两种途径,脱羰途径主要负责醛、烷烃、次级醇以及酮的合成,而酰基还原途径主要形成初级醇和酯[20-21]。在小麦、大麦等小麦族植物中,除了上述两条蜡质合成途径,还包括另一个负责二酮合成的蜡质合成途径[19,22-23]。本研究结果表明,小麦穗部蜡质主要为二酮、初级醇、烷烃以及少量的醛和酸,蜡质组分中初级醇和烷烃的存在可以说明小麦中存在与拟南芥等植物类似的蜡质合成途径,但是由于脱羰途径中仅形成单酮,而小麦穗部蜡质中具有大量的二酮,因此表明小麦中的确还存在一个蜡质合成通路,其主要负责二酮的合成。小麦叶片蜡质中主要以脂肪醇与烷烃为主,而穗部蜡质中最主要成分为二酮,造成这一差异可能是由于在小麦的营养生长阶段,蜡质的合成主要是经由脱羰途径和酰基还原途径来完成,而随着小麦进入生殖生长阶段,蜡质的合成逐渐转向二酮合成途径。
小麦中参与二酮合成的基因为 W1、W2,抑制基因 Iw1、Iw2,W1和 Iw1被定位于2BS, W2和 Iw2则定位在2DS上[19],其中控制二酮合成的 W1基因主要是由一个基因簇构成的,其中 DMP、DMH、DMC分别编码了一个聚酮合酶、一个水解酶和一个细胞色素P450蛋白催化二酮的羟基化[23]。本研究中,不同小麦品种(系)穗部蜡质中二酮的含量存在较大差异,可能说明在不同小麦品种(系)中参与二酮合成的三个基因的表达存在差异,其中β-二酮的衍生产物羟基-β-二酮在泛麦5号和丰德存麦1号中含量高于β-二酮,可能是由于负责催化二酮发生羟基化的酶催化效率较高,但是这三个基因是如何参与调控二酮的合成还有待进一步研究。本研究主要选取了不同小麦品种(系)为材料,这些品种(系)在表型上存在较大差异,比较分析其穗部蜡质成分及含量对于进一步揭示小麦穗部蜡质的合成机理及调控方式有重要作用,也可为小麦抗旱性研究及抗旱品种选育提供参考。
[1] 曾 琼,刘德春,刘 勇.植物角质层蜡质的化学组成研究综述[J].生态学报,2013,33(17):5133.
ZENG Q,LIU D C,LIU Y.The overview and prospect of chemical composition of plant cuticular [J].ActsEcologicaSinica,2013,33(17):5133.
[2] KERSTIENS G.Signaling across the divide:A wider perspective of cuticular structure-function relationships [J].TrendsinPlantScience,1996,1(4):125.
[3] 王美芳,陈巨莲,程登发,等.小麦叶片表面蜡质及其与品种抗蚜性的关系[J].应用与环境生物学报,2008,14(3):341.
WANG M F,CHEN J L,CHENG D F,etal.Epicuticular wax on wheat leaves and its relationship with cultivars resistance to wheat aphids [J].ChineseJournalofAppliedEnvironmentalBiology,2008,14(3):341.
[4] LEE S B,SUH M C.Recent advances in cuticular wax biosynthesis and its regulation inArabidopsis[J].MolecularPlant,2013,6(2):246.
[5] KOSMA D K,BOURDENX B,BERNARD A,etal.The impact of water deficiency on leaf cuticle lipids ofArabidopsis[J].PlantPhysiology,2009,151(4):1918.
[6] YEATS T H,ROSE J K C.The formation and function of plant cuticles [J].PlantPhysiology,2013,163(1):5.
[7] SHEPHERD T,GRIFFITHS D W.The effects of stress on plant cuticular waxes [J].NewPhytologist,2006,171(3):469.
[8] 顾 俊,王 飞,张 鹏,等.植物叶表皮蜡质的生物学功能[J].江苏农业学报,2007,23(2):144.
GU J,WANG F,ZHANG P,etal.Biological function of epicuticular wax [J].JiangsuJournalofAgriculturalSciences,2007,23(2):144.
[9] 黄 玲,张正斌,崔玉亭,等.小麦叶片蜡质含量与水分利用效率和产量的关系[J].麦类作物学报,2003,23(3):41.
HUANG L,ZHANG Z B,CUI Y T,etal.Relationship between wax content and water use efficiency of leaf and yield in wheat [J].JournalofTriticeaeCrops,2003,23(3):41.
[10] 郭彦军,倪 郁,郭芸江,等.水热胁迫对紫花苜蓿叶表皮蜡质组分及生理指标的影响[J].作物学报,2011,37(5):911.
GUO Y J,NI Y,GUO Y J,etal.Effect of soil water deficit and high temperature on leaf cuticular waxes and physiological indices in alfalfa(Medicagosativa) leaf [J].ActaAgronomicaSinica,2011,37(5):911.
[11] OLIVEIRA A F M,MEIRELLES S T,SALATINO A.Epicuticular waxes from caatinga and cerrado species and their efficiency against water loss [J].AnaisDaAcademiaBrasileiraDeCiencias,2003,75(4):431.
[12] JENKS M A,EIGENBRODE S D,LEMIEUX B.Cuticular wax ofArabidopsis[M].TheArabidopsisBook:American Society of Plant Biologists,2002,1:e0016.
[13] ALEXANDER P.Composition on leaf surface waxes ofTriticumspecies:variation with age and tissue [J].Phytochemistry,1973,12:2225.
[14] JETTER R,SCHAFFER S.Chemical composition of thePrunuslaurocerasusleaf surface:Dynamic changes of the epicuticular wax film during leaf development [J].PlantPhysiology,2001,126(4):1725.
[15] 张正斌,山 仑.小麦抗旱生理指标与叶片卷曲度和蜡质关系研究[J].作物学报,1998,24(5):608.
ZHANG Z B,SHAN L.Studies on relationship between drought resistance physiological traits and leaf curl degree and wax of wheat [J].ActaAgronomicaSinica,1998,24(5):608.
[16] ADAMSKI N M,BUSH M S,SIMMONDS J,etal.The inhibitor of wax 1 locus( Iw1) prevents formation of β- and OH-β-diketones in wheat cuticular waxes and maps to a sub-cM interval on chromosome arm 2BS [J].PlantJournal,2013,74(6):989.
[17] WANG Y,WANG J H,CHAI G Q,etal.Developmental changes in composition and morphology of cuticular waxes on leaves and spikes of glossy and glaucous wheat(TriticumaestivumL.) [J].PlosOne,2015,10(10):e0141239.
[18] 张芸芸,李婷婷,孙瑜琳,等.小麦叶片表皮蜡质成分及含量分析[J].麦类作物学报,2014,34(7):963.
ZHANG Y Y,LI T T,SUN Y L,etal.Composition and content of wheat(Triticumaestivum) leaf cuticular waxes [J].JournalofTriticeaeCrops,2014,34(7):963.
[19] ZHANG Z Z,WANG W,LI W L.Genetic interactions underlying the biosynthesis and inhibition of β-diketones in wheat and their impact on glaucousness and cuticle permeability [J].PlosOne,2013,8(1):e54129.
[20] MILLAR A A,CLEMENS S,ZACHGO S,etal.CUT1,anArabidopsisgene required for cuticular wax biosynthesis and pollen fertility,encodes a very-long-chain fatty acid condensing enzyme [J].PlantCell,1999,11(5):825.
[21] MILLAR A A,KUNST L.Very-long-chain fatty acid biosynthesis is controlled through the expression and specificity of the condensing enzyme [J].PlantJournal,1997,12(1):121.
[22] SCHNEIDER L M,ADAMSKII N M,CHRISTENSEN C E,etal.TheCer-cqugene cluster determines three key players in a β-diketone synthase polyketide pathway synthesizing aliphatics in epicuticular waxes [J].JournalofExperimentalBotany,2016,67(9):2715.
[23] HEN-AVIVI S,SAVIN O,RACOVITA R C,etal.A metabolic gene cluster in the wheat W1 and the barleyCer-cquloci determines β-diketone biosynthesis and glaucousness [J].PlantCell,2016,28(6):1440.
Analysis on Composition and Content of Cuticular Waxes on Spikes of Different Wheat Varieties(Lines)
YANG Haohong,SHI Xue,XIA Lingfeng,WANG Yong,WANG Zhonghua,LI Chunlian
(College of Agronomy,Northwest A&F University/State Key Laboratory of Crop Stress Biology for Arid Areas,Yangling,Shaanxi 712100,China)
In order to compare and analyse the composition and content of the epicuticular waxes on spikes from different wheat varieties(lines),the wax component on spikes of 17 varieties(lines) were qualitatively and quantatively analyzed with gas chromatography-mass spectrometry(GC-MS) and gas chromatography-flame ionization detector(GC-FID). The results showed that 24 compounds were isolated and identified from the spikes,mainly including diketones,alkanes,and fatty alcohols,and a small amount of fatty acids and aldehydes. It was shown that there was no obvious difference in composition,but significant variance in the total waxes and the content of each component among the 17 wheat varieties(lines). The total waxes were significant higher in the 16 glaucous varieties(lines) than those in the glossy one(Chinese Spring). The β-diketones were the major component of the epicuticular wax and account for 81.03% in the spikes of the glaucous varieties,while the β-diketones and alkanes were the dominant components in the spike of Chinese Spring(accounting for 38.36% and 38.14%,respectively). The β-diketones can be detected in both glaucous and glossy wheats,but the derivatives OH-β-diketones can only be detected in the glaucous wheat varieties(lines).
Wheat; Wax on spike; Chemical composition; Wax content
时间:2017-03-07
2016-09-27
2016-11-18
国家自然科学基金项目(31471568);陕西省重点科技创新团队项目(2014KCT-25);西北农林科技大学唐仲英育种项目
E-mail:yhaohong@126.com
李春莲(E-mail:lclian@163.com);王中华(E-mail:zhonghuawang@nwsuaf.edu.cn)
S512.1;S312
A
1009-1041(2017)03-0403-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20170307.1639.036.html
