慢性阻塞性肺病及其相关非小细胞肺癌进程与EMT的相关性研究
2017-04-24肖贵华
常 芬 肖贵华 李 琪 杨 进
(武汉市普仁医院呼吸内科,武汉430081)
慢性阻塞性肺病及其相关非小细胞肺癌进程与EMT的相关性研究
常 芬 肖贵华 李 琪 杨 进①
(武汉市普仁医院呼吸内科,武汉430081)
目的:通过对相关数据库数据分析,探究EMT相关调节因子的异常表达与慢性阻塞性肺疾病及其相关非小细胞肺癌的相关性。方法:对NCBI中GEO数据库中的若干数据集数据进行表达量分析、生存分析和相关性分析。结果:①研究分析表明,Snai1等EMT相关调节因子在非小细胞肺癌患者中存在明显的高表达,而E-cadherin(CDH1)等则表现为明显的低表达。②对大量的COPD病例样本进行分析,发现部分EMT相关的分子在COPD患者中也表现出明显的表达异常,且与非小细胞肺癌患者中的变化相一致。结论:EMT指标和在COPD患者中的表达相关性分析表明,EMT调节因子的异常表达可能与COPD患者的疾病发展存在一定的相关性。
慢性阻塞性肺病;非小细胞肺癌;EMT;相关性
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种常见的以持续气流受限为特征的可以预防和治疗的疾病,气流受限进行性发展,与气道和肺脏对有毒颗粒或气体的慢性炎性反应增强有关。其与肺癌是两种与吸烟等后天因素和遗传突变等先天因素都密切相关的疾病[1,2]。但两种疾病之间的联系不仅仅是吸烟,其病理机制联系还包括遗传易感性、炎症反应、细胞损伤、氧化与毒性应激、细胞外基质和蛋白酶的分泌等。其中的一些共性可能成为这两种疾病的化学预防或化学治疗的靶点。最近,大量相关研究表明,COPD患者有极高的肺癌患病风险,每1 000个COPD患者中就有16.7个病例会患肺癌,比例是普通吸烟者患肺癌的3倍[3,4]。也因此,COPD现在被认为是肺癌恶性转化前的中间表型[5,6]。研究表明,COPD可以预防和控制,并且COPD的早期筛查也有助于相关肺癌的检测[7,8]。因此,鉴定与肺癌和 COPD发展相关的基因显得尤为重要,也可据此评估COPD 患者转化为肺癌的风险。
上皮-间质转化(Epithelial-mesenchymal trans-ition,EMT)是一种上皮样细胞向间质样的细胞转分化的过程,这一概念自20多年前首次被提出以来,越来越多的研究表明它与上皮细胞恶性肿瘤的发生和发展关系密切,并且受到了高度的关注[1]。EMT是一种哺乳动物胚胎发育过程中必需的生理现象。造肠运动前期原始中胚层的形成、发育中期神经脊发育成体节、骨和肌肉等组织需要 EMT 的密切参与。由于 EMT 是上皮细胞获得迁移能力的有效方式,在成体中成为占恶性肿瘤 90% 以上的上皮细胞癌浸润转移的一个重要途径。目前体内和体外实验证据都表明,EMT 在乳腺癌、结肠癌、肺癌、前列腺癌、肝癌、胰腺癌等多种癌症的原发性浸润和继发性转移中起着举足轻重的作用。也有研究证明,EMT是一个潜在的COPD 的致病机制,并且很有可能是COPD 向肺癌发展的关键枢纽[2,9]。EMT作为上皮样恶性肿瘤转移的关键过程已被广泛研究[10]。EMT可能通过参与炎症反应而调控肿瘤的早期事件[9,11,12]。在正常肺上皮中,吸烟和氧化压力可以诱导EMT过程,而EMT所诱导的气管重建则是COPD的一种关键的生理变化[13-15]。所以,这也从侧面证明EMT也与COPD的发病机理密切相关。此外,COPD 患者中EMT的发生也并认为是COPD患者肺癌发生率较高的原因[10,14,16]。最近,也有研究表明,EMT相关的基因,如Snai1和Slug的表达和突变与COPD 及相关肺癌的发生发展有着密切的联系[17-20]。
完整的EMT信号网络是由细胞外信号触发,如转化生长因子(Transforming growth factor β,TGF-β)信号[21]。这一信号会导致一些称为EMT调节因子的转录因子活化,这些转录因子会抑制上皮标志物的表达而促进间质标志物的表达,从而促进细胞从上皮样向间质样转化[22]。这些转录因子不仅促进肿瘤的侵袭和转移,而且在肿瘤形成的早期也发挥着重要的作用[25,26]。与此相似,它们同时也参与着COPD的发生发展[9]。这些转录因子在COPD及其相关的非小细胞肺癌中均有明显的表达异常[27-30]。
这些EMT调节因子的异常表达可能影响EMT的过程,从而影响COPD 及其相关非小细胞肺癌的发展。然而,并没有研究直接证明他们之间的联系。因此,在本研究中,我们探究了COPD和非小细胞肺癌病例中相关EMT调节因子的异常表达情况,并以此为基础分析了EMT调节因子的异常表达与COPD及其相关非小细胞肺癌的相关性。本研究对于在EMT调节因子的异常表达与COPD及其相关非小细胞肺癌相关性方面的探讨对于寻找预防及治疗COPD及其相关非小细胞肺癌特别是COPD向非小细胞肺癌发展过程的诊断与治疗的目标靶点有重要意义。
1 材料与方法
1.1 研究材料 本研究所用到的材料均来自于NCBI的GEO数据库,具体信息。见表1。
表1 研究中所用到的GES数据集
Tab.1 GES data sets used in study
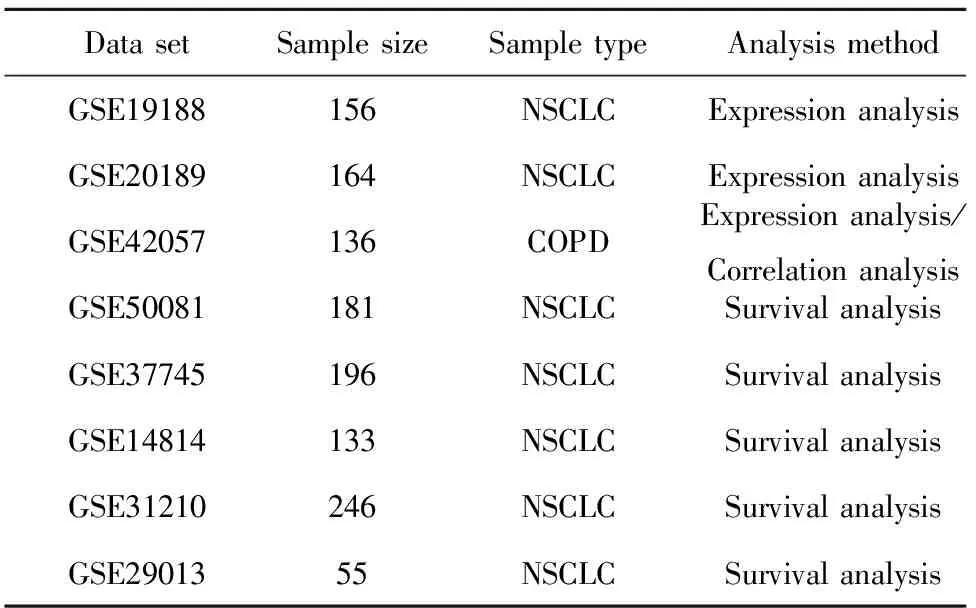
DatasetSamplesizeSampletypeAnalysismethodGSE19188156NSCLCExpressionanalysisGSE20189164NSCLCExpressionanalysisGSE42057136COPDExpressionanalysis/CorrelationanalysisGSE50081181NSCLCSurvivalanalysisGSE37745196NSCLCSurvivalanalysisGSE14814133NSCLCSurvivalanalysisGSE31210246NSCLCSurvivalanalysisGSE2901355NSCLCSurvivalanalysis
1.2 分析方法
1.2.1 表达量分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值进行表达量的分析,所有数据都经过对数转换和中位数中心化处理。根据表达量处理后数据进行聚类和差异分析。文中热图由HemI软件制作,比较差异分析图由GraphPad Prism 5软件制作。P<0.05表示差异有统计学意义。
1.2.2 生存分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值及对应样本的总生存(OS)和无疾病生存(DFS)信息进行生存分析,所有数据都经过对数转换和中位数中心化处理,并采用Kaplan-Meier分析方法进行分析。
1.2.3 相关性分析 基于数据库特定研究样本数据集中特定目标基因的表达量的相对值进行相关性分析,所有数据都经过对数转换和中位数中心化处理。
2 结果
2.1 EMT相关指标在COPD相关肺癌患者中的表达分析 为了评估EMT对于非小细胞肺癌的发生发展的关系,我们选取了10个EMT相关的调节因子,分别为Snai1、Zeb1、Twist1、vimentin(VIM)、N-cadherin(CDH12)、SIP1、 Slug(Snai2)、E-cadherin(CDH1)、ZO-1(TJP1)和occludin(OCLN),据以往的相关研究表明,其中Snai1、Zeb1、Twist1、vimentin(VIM)、N-cadherin(CDH12)、SIP1和 Slug(Snai2)在EMT的过程中表达量上调,而E-cadherin(CDH1)、ZO-1(TJP1)和occludin(OCLN)在EMT的过程中表达量下调。据此,我们对GSE20189数据集中的非小细胞肺癌样本和正常样本的相关基因的表达进行了表达谱的聚类分析,结果表明Snai1、Zeb1、Twist1、vimentin(VIM)、N-cadherin(CDH12)、SIP1和 Slug(Snai2)在非小细胞肺癌样本中均存在高表达,而E-cadherin(CDH1)、ZO-1(TJP1)和occludin(OCLN)在非小细胞肺癌中均表现为低表达(图1),这也与以往的类似研究结果相一致,表明EMT对于非小细胞肺癌的发生发展有着重要的作用。
2.2 EMT相关指标对COPD相关肺癌患者生存及预后的影响 据以往的研究报道,COPD患者的非小细胞肺癌的发生率明显增高,COPD的发展可引发某些肺癌的发生发展。所以,为了进一步探究EMT相关的基因的表达对非小细胞肺癌患者的生存状态的影响,我们对上述部分基因进行了生存分析。结果表明,在791个非小细胞肺癌患者中,Sani1的高表达会导致肺癌患者的总生存率明显降低(P<0.000 1,Hr=0.639 9),并且在499个非小细胞肺癌患者中,Sani1的高表达也同样会导致肺癌患者的无疾病生存率明显降低(P<0.000 1,Hr=0.478 7);与此类似,我们也在同样的数据集中对Twist1的高表达对非小细胞肺癌患者的总生存率和无疾病生存率进行了分析,结果表明,Twist1的高表达同样会导致肺癌患者的总生存率和无疾病生存率明显降低(P<0.000 1,Hr=0.581 0;P<0.000 1,Hr=0.502 1)(图2)。
2.3 EMT相关指标在COPD患者中的表达分析 在上述的研究中,我们分析了EMT相关指标在非小细胞肺癌患者中的表达异常情况,以及部分基因的高表达对非小细胞肺癌患者总生存率和无疾病生存率的影响。为了研究EMT相关指标与COPD发生发展的关系,我们在相关数据集中对部分上述高表达(VIM和SIP1)和低表达(CDH1和TJP1)的基因进行了表达量的比较分析。结果表明,与在非小细胞肺癌患者中的表达情况相似,VIM和SIP1在COPD患者中也有明显的高表达情况(VIM,P<0.001;SIP1,P<0.001),而CDH1和TJP1在COPD患者中则同样表现为低表达 (CDH1,P<0.001;
TJP1,P<0.001)(图3)。这一结果说明,EMT过程不仅对非小细胞肺癌的发生发展有着重要的影响,而且其在COPD患者中也表现出同样差异表达情况,暗示其在COPD的发生发展甚至是向非小细胞肺癌转化的过程中也发挥着同样重要的作用。
2.4 EMT相关指标与COPD的相关性分析 为了进一步探究,EMT的相关基因的差异表达与COPD的相关性,我们在COPD患者样本中进行了EMT的相关基因的表达的相关性分析。结果表明,VIM和SIP1在COPD患者中的表达情况呈正相关(P=0.000 9,r=0.338 3);而其与TJP1的相关性分析显示呈负相关(P=0.043 5,r=-0.173 1)(图4)。这一结果进一步说明,EMT的相关基因在COPD患者中的差异表达是有关联的,而且这一关联与COPD的发生和发展也有着密切的关系,很可能EMT就是COPD向非小细胞肺癌发展的关键性步骤,通过EMT来促进非小细胞肺癌的发展恶化,并影响患者的生存及预后。
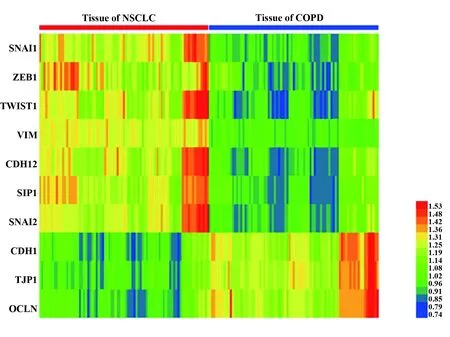
图1 GSE20189数据集中EMT标志基因的表达谱分析Fig.1 EMT marker gene expression profile analysis in GSE20189 data set

图2 EMT相关基因的表达量与非小细胞肺癌患者生存状态的分析Fig.2 EMT-related gene expression and NSCLC patients survival status analysis

图3 EMT相关指标在COPD患者中的表达差异比较Fig.3 Comparison of EMT-related indicators in patients with COPD
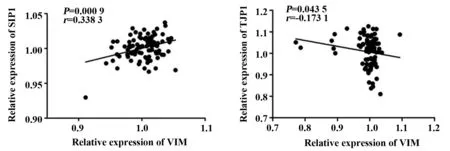
图4 EMT相关指标在COPD患者中的相关性分析Fig.4 Correlation analysis of EMT-related indicators in patients with COPD
3 结论
EMT 是肿瘤发生发展过程中的重要现象,也是肿瘤细胞发生浸润迁移和继发性转移的重要机制之一[31-33]。目前关于 EMT 的研究逐渐深入,其在肺癌中发挥的作用不断地被发现,EMT 发生的分子机制也不断地被揭示[34]。随着研究的深入,除癌症以外,在一些其他疾病的发生发展过程中 EMT也可能发挥着重要的作用。有研究表明,EMT也可能与COPD的发生和发展密切相关,尤其是在COPD向肺癌转化的过程中更是有着重要的作用[14,33]。
我们的研究分析表明,Snai1、Zeb1、Twist1、vimentin(VIM)、N-cadherin(CDH12)、SIP1和 Slug(Snai2)在非小细胞肺癌患者中存在明显的高表达,而E-cadherin(CDH1)、ZO-1(TJP1)和occludin(OCLN)则表现为明显的低表达,且这些基因的表达异常与肺癌患者的生存及预后有着密切的关系,这一结果也与以往的一些研究结果相一致。基于此,我们又对大量的COPD病例样本进行分析,发现部分EMT相关的基因在COPD患者中也表现出明显的表达异常,且与非小细胞肺癌患者中的变化相一致,该结果证明我们所熟知的EMT过程,不仅对于肺癌的发生发展有着重要的促进作用,而且对于COPD的发展也发挥着相似的作用,抑或是其在COPD向非小细胞肺癌发展的过程中发挥着重要的作用。最后,通过对EMT指标和COPD患者指标的相关性分析表明,EMT调节因子的异常表达与COPD患者的疾病发展存在明显的相关性,某些促进EMT进程的调节因子的高表达同时也促进了COPD疾病的发展或是向非小细胞肺癌的转化,而某些抑制EMT进程的调节因子的低表达对于COPD患者也发挥这同样的作用。
通过对本研究结果的分析讨论,我们提出了EMT与COPD及其相关非小细胞肺癌存在密切的相关性,更或是对于COPD向非小细胞肺癌的发展有着一定的调控作用。这就为预防及治疗COPD及其相关非小细胞肺癌特别是COPD向非小细胞肺癌发展过程的诊断与治疗提供了一个新的切入点。
[1] Xiao D,He J.Epithelial mesenchymal transition and lung cancer[J].J Thorac Dis,2010,2:154-159.
[2] Kalluri R,Weinberg RA.The basics of epithelial-mesenchymal transition[J].J Clin Invest,2009,119:1420-1428.
[3] Shi Y,Wu H,Zhang M,etal.Expression of the epithelial-mesenchymal transition-related proteins and their clinical significance in lung adenocarcinoma[J].Diagn Pathol,2013,8:89.
[4] Gupta GP,Massagué J.Cancer metastasis:Building a framework[J].Cell,2006,127:679-695.
[5] Lee JM,Dedhar S,Kalluri R,etal.The epithelialmesenchymal transition:New insights in signaling,development,and disease[J].J Cell Biol,2006,172:973-981.
[6] Klymkowsky MW,Savagner P.Epithelial-mesenchymal transition:A cancer researcher′s conceptual friend and foe[J].Am J Pathol,2009,174:1588-1593.
[7] Morel AP,Lièvre M,Thomas C,etal.Generation of breast cancer stem cells through epithelial-mesenchymal transition[J].PLoS One,2008,3:e2888.
[8] Battula VL,Evans KW,Hollier BG,etal.Epithelial-mesenchymal transition-derived cells exhibit multilineage differentiation potential similar to mesenchymal stem cells[J].Stem Cells,2010,28:1435-1445.
[9] Thiery JP,Acloque H,Huang RY,etal.Epithelialmesenchymal transitions in development and disease[J].Cell,2009,139:871-890.
[10] Shien K,Toyooka S,Yamamoto H,etal.Acquired resistance to EGFR inhibitors is associated with a manifestation of stem cell-like properties in cancer cells[J].Cancer Res,2013,73:3051-3061.
[11] Koren A,Motaln H,Cufer T.Lung cancer stem cells:A biological and clinical perspective[J].Cell Oncol,2013,36:265-275.
[12] Kim CF,Jackson EL,Woolfenden AE,etal.Identification of bronchioalveolar stem cells in normal lung and lung cancer[J].Cell,2005,121:823-835.
[13] Willis BC,Borok Z.TGF-beta-induced EMT:Mechanisms and implications for fibrotic lung disease[J].Am J Physiol Lung Cell Mol Physiol,2007,293:L525-L534.
[14] Wu Y,Deng J,Rychahou PG,etal.Stabilization of snail by NF-kappaB is required for inflammation induced cell migration and invasion[J].Cancer Cell,2009,15:416-428.
[15] De Wever O,Mareel M.Role of tissue stroma in cancer cell invasion[J].J Pathol,2003,200:429-447.
[16] Kalluri R,Zeisberg M.Fibroblasts in cancer[J]. Nat Rev Cancer,2006,6:392-401.
[17] Heinrich EL,Walser TC,Krysan K,etal.The inflammatory tumor microenvironment,epithelial mesenchymal transition and lung carcinogenesis[J].Cancer Microenviron,2012,5:5-18.
[18] Nizet V,Johnson RS.Interdependence of hypoxic and innate immune responses[J].Nat Rev Immunol,2009,9:609-617.
[19] Fitzpatrick SF,Tambuwala MM,Bruning U,etal.An intact canonical NF-κB pathway is required for inflammatory gene expression in response to hypoxia[J].J Immunol,2011,186:1091-1096.
[20] Semenza GL.Defining the role of hypoxia-inducible factor 1 in cancer biology and therapeutics[J].Oncogene,2010,29:625-634.
[21] Harris AL.Hypoxia-a key regulatory factor in tumour growth[J].Nat Rev Cancer,2002,2:38-47.
[22] Giatromanolaki A,Sivridis E,Koukourakis MI.The pathology of tumor stromatogenesis[J].Cancer Biol Ther,2007,6:639-645.
[23] Bonde AK,Tischler V,Kumar S,etal.Intratumoral macrophages contribute to epithelial-mesenchymal transition in solid tumors[J].BMC Cancer,2012,12:35.
[24] Reya T,Morrison SJ,Clarke MF,etal.Stem cells,cancer,and cancer stem cells[J].Nature,2001,414:105-111.
[25] Liu WH,You N,Zhang N,etal.Interpretation of interlocking key issues of cancer stem cells in malignant solid tumors[J].Cell Oncol,2012,35:397-409.
[26] Visvader JE,Lindeman GJ.Cancer stem cells in solid tumours:Accumulating evidence and unresolved questions[J].Nat Rev Cancer,2008,8:755-768.
[27] Hanahan D,Weinberg RA.Hallmarks of cancer:The next generation[J].Cell,2011,144:646-674.
[28] Sullivan JP,Minna JD,Shay JW.Evidence for self-renewing lung cancer stem cells and their implications in tumor initiation,progression,and targeted therapy[J].Cancer Metastasis Rev,2010,29:61-72.
[29] Kitamura H,Okudela K,Yazawa T,etal.Cancer stem cell:Implications in cancer biology and therapy with special reference to lung cancer[J].Lung Cancer,2009,66:275-281.
[30] Sullivan JP,Spinola M,Dodge M,etal.Aldehyde dehydrogenase activity selects for lung adenocarcinoma stem cells dependent on notch signaling[J].Cancer Res,2010,70:9937-9948.
[31] Hogg JC,Chu F,Utokaparch S,etal.The nature of small-airway obstruction in chronic obstructive pulmonary disease[J].N Engl J Med,2004,350:2645-2653.
[32] Alsaeedi A,Sin DD,McAlister FA.The effects of inhaled corticosteroids in chronic obstructive pulmonary disease:a systematic review of randomized placebo-controlled trials[J].Am J Med,2002,113:59-65.
[32] Barnes P,Hansel T.Prospects for new drugs for chronic obstructive pulmonary disease[J].Lancet,2004,364:985-996.
[34] Spira A,Beane J,Pinto-Plata V,etal.Gene expression profiling of human lung tissue from smokers with severe emphysema[J].Am J Respir Cell Mol Biol,2004,31:601-610.
[收稿2016-08-04]
(编辑 张晓舟)
Correlation analysis between EMT and progression of chronic obstructive pulmonary disease (COPD) and its related non-small cell lung cancer (NSCLC)
CHANGFen,XIAOGui-Hua,LIQi,YANGJin.
DepartmentofRespiratoryMedicineofWuhanPurenHospital,Wuhan430081,China
Objective:Based on relevant database data analysis,to explore the correlation of the abnormal expression of EMT related factors and chronic obstructive pulmonary disease and its related non-small cell lung cancer. Methods: Based on some data sets of GEO in the NCBI database,to perform express analysis,survival analysis and correlation analysis.Results: ①Snai1 and other EMT related regulatory factors exist significantly higher expression in non-small cell lung cancer patients,and E-cadherin (CDH1) was showed significantly lower expression. ②A large number of COPD patients samples were analyzed,and some EMT-related molecules in patients with COPD also showed significant abnormal expression and consistented with the changes in patients with non-small cell lung cancer.Conclusion: The results showed that dysregulation expression of EMT related regulatory factors may have some correlation with disease progression of COPD patients through the EMT markers and their expression and correlation analysis in COPD patients.
Chronic obstructive pulmonary disease;NSCLC;EMT;Relevance
10.3969/j.issn.1000-484X.2017.04.025
常 芬(1982年-),女,主治医师,主要从事慢性阻塞性肺疾病、重症肺炎、肺癌等方面的研究。
R56
A
1000-484X(2017)04-0598-05
①通讯作者,武汉市武昌医院检验科,武汉430063。
