B细胞易位基因1在脑胶质瘤组织中的表达及意义
2017-04-24韩小辉连亚军
韩小辉 连亚军
郑州大学第一附属医院神经内科 郑州 450052
B细胞易位基因1在脑胶质瘤组织中的表达及意义
韩小辉 连亚军
郑州大学第一附属医院神经内科 郑州 450052
目的 探讨B细胞易位基因1(BTG1)和人10号染色体磷酸酶张力蛋白样同源物(PTEN)在脑胶质瘤组织中的表达及其与肿瘤分级的关系和意义。方法 采用免疫组织化学染色(EnVision法)分别检测80例脑胶质瘤及25例正常脑组织中BTG1和PTEN的表达,并采用Western blot检测随机抽取的4例脑胶质瘤及4例正常脑组织中二者的表达。结果 BTG1在胶质瘤和正常脑组织中的阳性表达率分别为73.8%、96.0%,PTEN在脑胶质瘤的表达率分别为77.5%、100%,差异均具有统计学意义(P<0.05);二者的表达与世界卫生组织(WHO)胶质瘤组织学分级呈负相关(P<0.05),但与患者性别及肿瘤直径无关(P>0.05)。结论 BTG1和PTEN在胶质瘤的发生及发展过程中起重要作用,二者表达检测可为肿瘤的组织学分级提供参考,也提示BTG1和PTEN作为新型抑癌基因可能成为胶质瘤基因治疗的新靶点。
BTG1;PTEN;胶质瘤
脑胶质瘤是最常见的中枢神经系统恶性肿瘤,占所有成人原发恶性脑肿瘤的50%[1]。WHO(2007)将其划分为Ⅰ~Ⅳ级:低级别胶质瘤(Ⅰ级和Ⅱ级)常见于儿童和年轻人,高级别胶质瘤(Ⅲ级和Ⅳ级)常见于中老年人[2]。其中Ⅳ级胶质瘤即胶质母细胞瘤(glioblastoma multiforme,GBM)恶性程度最高,尽管在过去数十年中新的检测和治疗手段不断出现,GBM患者的中位生存期仍变化不大,仅限于12~15个月[1]。近年来分子生物学的快速发展也推动胶质瘤治疗的不断进步,分子靶向治疗成为脑胶质瘤治疗的研究热点。因此,从基因水平分析脑胶质瘤的生物学特性,探索其诊疗技术成为新的研究方向。研究发现,B细胞易位基因1(B-cell translocation gene 1,BTG1)在多种恶性肿瘤中具有抑制肿瘤细胞增殖的作用[3-7],由此推测BTG1可能也在脑胶质瘤的形成和发展中具有重要作用。人10号染色体磷酸酶张力蛋白样同源物(PTEN)也与脑胶质瘤的发生发展有密切关系,并成为新的治疗靶点的研究热点。本研究采用免疫组化和Western blot方法检测并分析BTG1和PTEN在脑胶质瘤中的表达及其与临床病理参数的关系,以期为脑胶质瘤的临床治疗找到新的基因靶点。
1 材料与方法
1.1 一般资料 收集郑州大学第一附属医院2013-12—2016-04行肿瘤全切的80例胶质瘤组织标本,并选取25例颅脑减压所得正常脑组织作对照。80例胶质瘤患者年龄1~70岁,平均37.2岁,其中≤20岁21例,>20岁59例;男45 例,女35例;肿瘤平均直径4.5 cm,直径≤3 cm 11例,>3 cm 69例;组织学分级Ⅰ~Ⅳ级各20例。患者术前均未接受放、化疗,新鲜胶质瘤标本及正常脑组织标本各4例,部分用于病理学分析,部分冻存于液氮中用于后续的Western blot分析。
1.2 免疫组织化学染色 标本经10%甲醛固定,常规石蜡包埋,切片4 μm。BTG1兔抗人多克隆抗体购自美国Abcam公司(ab197376);PTEN兔抗人多克隆抗体购自北京中杉金桥生物技术公司(ZA-0251);免疫组化二抗试剂盒购自北京中杉金桥生物技术公司。免疫组织化学染色采用EnVision法,按照说明书进行。结果判定:每张切片随机选择5个视野,每个标本计数3张切片。BTG1表达以阳性细胞百分比与细胞染色强度得分之和进行判定。阳性细胞百分比分为:≤5%计0分,6%~25%计1分,26%~50%计2分,51%~75%计2分,>75%计4分;细胞染色强度:无染色记0分,弱染色(浅黄色)计1分,中等染色(黄褐色)计2分,强染色(棕黄色)计3分。两项评分相加:0~1分为阴性(-),2~7分为阳性,其中2~3分为弱阳性(+),4~5分为中等阳性(++),6~7分为强阳性(+++)。BTG1以肺癌组织为阳性对照,PTEN以前列腺癌组织为阳性对照;PBS替代一抗作为阴性对照。
1.3 Western blot检测 组织裂解液、SDS-PAGE上样缓冲液及增强型ECL化学发光试剂盒均购自北京中杉金桥生物技术公司。随机选取4例新鲜的脑胶质瘤组织及正常脑组织,用玻璃匀浆器充分匀浆,加入裂解液提取蛋白,BCA试剂盒检测蛋白浓度,按每孔上样量60 μg进行丙烯酰胺凝胶电泳,稳压冰浴电转至硝酸纤维素膜上,5%脱脂牛奶封闭1 h,一抗孵育4 ℃过夜(BTG1 1:500;PTEN 1:1 000;β-action 1:5 000),TBST洗3次/5 min,二抗(羊抗兔1: 5 000)室温孵育1 h,TBST室温摇床洗3次/5 min,ECL化学发光后AI600系统检测。
1.4 统计学分析 应用SPSS 17.0软件进行统计学处理。多组间数据比较采用Kruskal Wallist检验;相关分析采用Spearman秩相关检验;BTG1和PTEN蛋白表达与临床参数之间的关系分析采用Logistic回归分析。所有实验数据均至少重复3次,P<0.05 为差异有统计学意义。
2 结果
2.1 BTG1蛋白在胶质瘤组织中的表达情况 BTG1阳性表达主要定位于细胞浆,呈浅黄色、黄褐色或棕黄色染色。BTG1在正常脑组织中的阳性表达率较高,表达率为96.0% (24/25),且表达较强,而在胶质瘤的阳性表达率降低,表达率为73.8% (59/80),且表达减弱,二者差异有统计学意义(P<0.05)。见图1、表1。
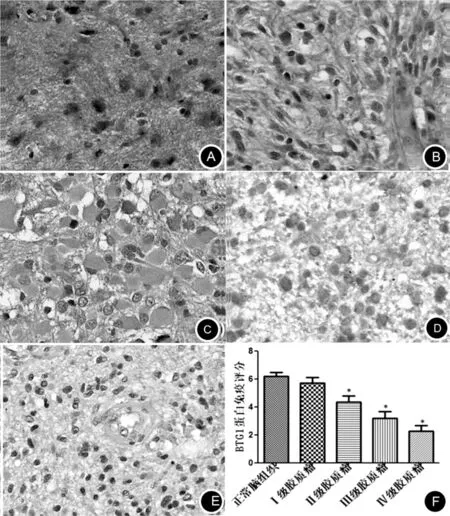
图1 正常脑组织及胶质瘤中BTG1 的表达情况(EnVision 法,细胞质表达,高倍放大) A:正常脑组织 BTG1强阳性表达;B:胶质瘤Ⅰ级(毛细胞星形细胞瘤),BTG1强阳性表达;C:Ⅱ级胶质瘤(肥胖型星形细胞瘤),BTG1阳性表达;D:Ⅲ级胶质瘤(间变型星形细胞瘤),BTG1弱阳性表达;E:Ⅳ级胶质瘤(胶质母细胞瘤),BTG1几乎不表达;F:BTG1在正常脑组织及胶质瘤中的免疫组化表达评分值的比较,与正常组织相比,胶质瘤Ⅰ级无显著差异(P>0.05),胶质瘤Ⅱ~Ⅳ级均有显著差异(P<0.05);胶质瘤Ⅰ~Ⅳ级之间两两相比,Ⅲ级与Ⅳ级质之间无明显差异(P>0.05),其余均有显著差异(P<0.05)
2.2 PTEN蛋白在胶质瘤组织中的表达情况 PTEN阳性表达主要定位于细胞浆,呈浅黄色、黄褐色或棕黄色染色。PTEN在正常组织中的阳性表达率较高,表达率为100% (25/25),且表达较强,而在胶质瘤的阳性表达率降低,表达率为77.5%(62/80),且表达减弱,二者差异有统计学意义(P<0.05)。见图2、表1。
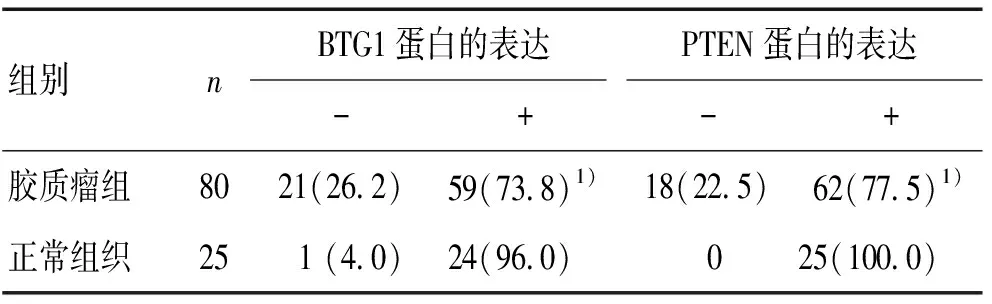
表1 BTG1和 PTEN蛋白在胶质瘤及正常组织中的表达 [n(%)]
注:与正常组织比较,1)P<0.05
2.3 BTG1和PTEN蛋白的表达与胶质瘤临床病理参数的关系 BTG1和PTEN蛋白的表达与脑胶质瘤组织学WHO分级的关系的分析结果显示脑胶质瘤组织中二者的表达与肿瘤组织学WHO分级呈负相关(P<0.05),肿瘤级别越高表达率越低且表达强度下降。各级胶质瘤及正常脑组织之间BTG1和PTEN表达分别两两比较(Kruskal Wallist检验)显示,Ⅰ级胶质瘤与正常脑组织相比无显著差异(P>0.05),Ⅲ级和Ⅳ级相比无显著差异(P>0.05);其余各组之间相比均有显著差异(P<0.05)。BTG1和PTEN之间的相关分析 (Spearman秩相关检验)显示二者表达呈正相关;Logistic回归分析显示BTG1和PTEN蛋白在20岁以上患者比20岁以下患者的表达率及表达强度下降(P<0.05);但二者的表达与肿瘤直径及患者性别无关(P>0.05)。 见表2。

图2 正常脑组织及胶质瘤中PTEN 的表达情况(EnVision法,细胞质表达,高倍放大) A:正常脑组织PTEN强阳性表达;B:胶质瘤Ⅰ级(毛细胞星形细胞瘤),PTEN强阳性表达;C:Ⅱ级胶质瘤(肥胖型星形细胞瘤),PTEN阳性表达;D:Ⅲ级胶质瘤(间变型星形细胞瘤),PTEN弱阳性表达,毛细血管内皮细胞强阳性表达;E:Ⅳ级胶质瘤(胶质母细胞瘤),PTEN几乎不表达;F:PTEN在正常脑组织及胶质瘤中的免疫组化表达评分值比较,与正常组织相比,胶质瘤Ⅰ级无显著差异(P>0.05),胶质瘤Ⅱ~Ⅳ级均有显著差异(P<0.05),胶质瘤Ⅰ~Ⅳ之间两两相比,Ⅲ级与Ⅳ级质之间无明显差异(P>0.05),其余均有显著差异(P<0.05)
2.4 脑胶质瘤和正常脑组织中BTG1和PTEN蛋白的表达分析 Western blot结果显示,胶质瘤组织中BTG1和PTEN蛋白的表达低于正常脑组织(图3),与免疫组织化学的结果一致 (图4)。

表2 BTG1和 PTEN蛋白与胶质瘤患者临床特征的关系 (n)

图3 BTG1在胶质瘤及正常脑组织中表达的Western blot检测结果 1:Ⅳ级胶质瘤;2:Ⅲ级胶质瘤;3、4:Ⅱ级胶质瘤;5、6、7、8:正常脑组织

图4 PTEN在胶质瘤及正常脑组织中表达的Western blot检测结果 1、2:Ⅱ级胶质瘤;3:Ⅲ级胶质瘤;4:Ⅳ级胶质瘤;5、6、7、8:正常脑组织
3 讨论
胶质瘤具有病理形态学及遗传学改变的复杂性特点,常侵犯周围正常脑组织[8],目前多数传统治疗方法无效,高级别肿瘤的病死率较显著[9]。一些更广泛的治疗方法正处在进一步尝试及评估中,包括免疫及基因治疗,但这些方法还未被证明有效[10],因此脑胶质瘤还需更广泛的研究。
BTG1属人类BTG/TOB的家族,至少包括6种不同成员,即BTG1、BTG2/PC3/Tis21、BTG3/Ana、BTG4/PC3B、TOB1和TOB2,参与细胞增殖及生长周期的调控,并介导多种细胞分化[11]。研究表明,BTG1基因对细胞增殖起负调控作用[12]。BTG1在癌组织中表达下降,如卵巢癌、食管癌、胃癌、肝细胞癌、甲状腺癌、乳腺癌及肺癌等[3-7],且其过表达抑制卵巢癌细胞的增殖、转移、浸润和凋亡[13]。以上研究证实BTG1是一种新的抑癌基因,但BTG1基因是否是脑胶质瘤相关抑制基因?在胶质瘤中的表达状况如何?目前国内外尚未见文献报道。
PTEN是位于人类10号染色体的一个抑癌基因,在肿瘤的发生发展中起至关重要的抑制作用,在多种肿瘤,如子宫内膜癌、前列腺癌、肾细胞癌、结肠癌及肺癌等中存在杂合缺失或突变[10,14-17]。有研究[18-20]表明,PTEN具有抑制脑胶质瘤生长的作用,并试图通过抑制脑胶质瘤生长寻找新的治疗靶点。
本研究首次应用免疫组化染色和Western blot技术对脑胶质瘤及正常脑组织中BTG1蛋白进行定位和定量检测,并对PTEN进行检测,结果显示,BTG1和PTEN蛋白在脑胶质瘤组织中的表达水平均低于正常脑组织,且蛋白的表达水平与病理组织学分级有关。以上结果提示,BTG1和PTEN的缺失是脑胶质瘤发生发展的重要促使因素。研究进一步证实,脑胶质瘤组织中BTG1和PTEN的表达水平与病理组织学分级呈负相关,肿瘤级别越高其表达越少。BTG1对脑胶质瘤细胞的生长及凋亡等功能学研究将成为我们新阶段的研究内容。
BTG/TOB家族作用机制的研究不多,Li等[21]提出BTG2可能通过磷酸肌醇3-激酶(PI3K)信号通路而抑制肿瘤细胞的增殖和迁移。Chakravarti等[22]报道,PTEN基因的突变或缺失通常导致PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(mTOR)信号网络的激活,且与胶质瘤患者存活降低相关联。PTEN蛋白剂量水平的变化也与肿瘤的发生发展密切相关[14,23]。Cheng等[24]研究提示,BTG3与PTEN功能极其相似,均是PI3K/AKT信号通路的负性调控因子和P53作用靶点,都对细胞周期检测点激酶1产生影响。但BTG1与PTEN是否在胶质瘤中也具有此相似性尚未见报道,因此,本实验对二者在脑胶质瘤的表达进行了相关性分析,结果显示,二者在胶质瘤和正常脑组织中表达相似,呈正相关关系,且与胶质瘤分级呈负相关关系,与之前研究结果一致[24-25]。
综上所述,脑胶质瘤较正常脑组织中BTG1和PTEN的表达率低,且与胶质瘤的组织学分级呈负相关,二者在胶质瘤的发生发展中发挥重要的作用,但其能否成为新的治疗靶点有待进一步探讨。
[1] Zheng HC,Li J,Shen DF,et al.BTG1 expression correlates with pathogenesis,aggressive behaviors and prognosis of gastric cancer:a potential target for gene therapy[J].Oncotarget,2015,6(23):19 685-19 705.
[2] Appin CL,Brat DJ.Biomarker-driven diagnosis of diff-use gliomas[J].Mol Aspects Med,2015,45:87-96.
[3] Sun GG,Wang YD,Cheng YJ,et al.BTG1 underexpression is an independent prognostic marker in esophageal squamous cell carcinoma[J].Tumour Biol,2014,35(10): 9 707-9 716.
[4] Kanda M,Oya H,Nomoto S,et al.Diversity of clinical implication of B-cell translocation gene 1 expression by histopathologic and anatomic subtypes of gastric cancer[J].Dig Dis Sci,2015,60(5):1 256-1 264.
[5] Lu YF,Sun GG,Liu Q,et al.BTG1 expression in thyr-oid carcinoma:diagnostic indicator and prognostic marker[J].Int J Oncol,2014,45(4):1 574-1 582.
[6] Sheng SH,Zhao CM,Sun GG.BTG1 expression correla-tes with the pathogenesis and progression of breast carcinomas[J].Tumour Biol,2014,35(4):3 317-3 326.
[7] Kanda M,Sugimoto H,Nomoto S,et al.B-cell translocation gene 1 serves as a novel prognostic indicator of hepatocellular carcinoma[J].Int J Oncol,2015,46(2):641-648.
[8] Holland EC.Glioblastoma multiforme:the ter minator[J].Proc Natl Acad Sci U S A,2000,97(12):6 242-6 244.
[9] Van Meir EG,Hadjipanayis CG,Norden AD,et al.Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J].CA Cancer J Clin,2010,60(3):166-193.
[10] Gabriel K,Ingram A,Austin R,et al.Regulation of the tumor suppressor PTEN through exosomes:a diagnostic potential for prostate cancer[J].PLoS One,2013,8(7):e70 047.
[11] Winkler GS.The mammalian anti-proliferative BTG/Tob protein family[J].J Cell Physiol,2010,222(1):66-72.
[12] Rouault JP,Rimokh R,Tessa C,et al.BTG1,a member of a new family of antiproliferative genes[J].EMBO J,1992,11(4):1 663-1 670.
[13] Zhao Y,Gou WF,Chen S,et al.BTG1 expression correlates with the pathogenesis and progression of ovarian carcinomas[J].Int J Mol Sci,2013,14(10):19 670-19 680.
[14] Milella M,Falcone I,Conciatori F,et al.PTEN:Mul-tiple Functions in Human Malignant Tumors[J].Front Oncol,2015,5:24.
[15] Wang H,Zhang P,Lin C,et al.Relevance and therapeu-tic possibility of PTEN-long in renal cell carcinoma[J].PLoS One,2015,10(2):e114 250.
[16] Molinari F,Frattini M.Functions and Regulation of the PTEN Gene in Colorectal Cancer[J].Front Oncol,2013,3:326.
[17] Collaud S,Tischler V,Atanassoff A,et al.Lung neuroendocrine tumors:correlation of ubiquitinylation and sumoylation with nucleo-cytosolic partitioning of PTEN[J].BMC Cancer,2015,15:74.
[18] Furnari FB,Lin H,Huang HS,et al.Growth suppress-ion of glioma cells by PTEN requires a functional phosphatase catalytic domain[J].Proc Natl Acad Sci U S A,1997,94(23):12 479-12 484.
[19] Dasari VR,Kaur K,Velpula KK,et al.Upregulation of PTEN in glioma cells by cord blood mesenchymal stem cells inhibits migration via downregulation of the PI3K/Akt pathway[J].PLoS One,2010,5(4):e10 350.
[20] Wang XR,Luo H,Li HL,et al.Overexpressed let-7a inhibits glioma cell malignancy by directly targeting K-ras,independently of PTEN[J].Neuro Oncol,2013, 15(11):1 491-1 501.
[21] Li YJ,Dong BK,Fan M,et al.BTG2 inhibits the proliferation and metastasis of osteosarcoma cells by suppressing the PI3K/AKT pathway[J].Int J Clin Exp Pathol,2015,8(10):12 410-12 418.
[22] Chakravarti A,Zhai G,Suzuki Y,et al.The prognostic significance of phosphatidylinositol 3-kinase pathway activation in human gliomas[J].J Clin Oncol,2004, 22(10):1 926-1 933.
[23] Davis NM,Sokolosky M,Stadelman K,et al.Deregulation of the EGFR/PI3K/PTEN/Akt/mTORC1 path-way in breast cancer:possibilities for therapeutic intervention[J].Oncotarget,2014,5(13):4 603-4 650.
[24] Cheng YC,Chen PH,Chiang HY,et al.Candidate tumor suppressor B-cell translocation gene 3 impedes neoplas-tic progression by suppression of AKT[J].Cell Death Dis,2015,6:e1 584.
[25] Ou YH,Chung PH,Hsu FF,et al.The candidate tumor suppressor BTG3 is a transcriptional target of p53 that inhibits E2F1[J].EMBO J,2007,26(17):3 968-3 980.
(收稿2017-01-10)
The expression and influence of BTG1 in gliomas tissue
Han Xiaohui,Lian Yajun
Department of Neurology,the First Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Objective To investigate the expressions of BTG1(human B cell translocation 1) and PTEN(phosphatase and tensin homology deleted on chromosome 10) in gliomas tissue,and their relationships with glioma grade.Methods Immunohistochemical staining(EnVision method) was used to detect the expressions of BTG1 protein and PTEN protein in 80 cases with brain gliomas and 25 cases with normal brain tissue;Western blotting was used to test the expressions of BTG1 protein and PTEN protein in 4 cases with brain gliomas and 4 cases with normal brain tissue.Results The positive expression rates of BTG1 protein in brain gliomas and normal brain tissue were 73.8% and 96.0%,respectively,and the difference was statistically significant(P<0.05).The expression of BTG1 protein in glioma tissue was negatively related to glioma grade(P<0.05),but its expression had nothing to do with the patient’s sex and tumor size(P>0.05).The positive rates of PTEN protein in brain gliomas and normal brain tissue were 77.5% and 100%,respectively.It also had a statistically significant difference(P<0.05),and the expression of BTG1 protein in brain glioma tissue was negatively related to glioma grade(P<0.05).Conclusion Both BTG1 protein and PTEN protein play important roles in the development of gliomas,which may provide additional reference for histology grade of glioma and may become new targets of gene therapy.
BTG1;PTEN;Glioma
R739.41
A
1673-5110(2017)08-0005-05
