GnRH拮抗剂方案中雌激素预处理与正常反应患者临床结局的Meta分析
2017-04-21易思思梁新红丘映
易思思,梁新红,丘映
(广西医科大学第三附属医院,南宁市第二人民医院妇产科生殖中心,南宁 530000)
GnRH拮抗剂方案中雌激素预处理与正常反应患者临床结局的Meta分析
易思思,梁新红,丘映*
(广西医科大学第三附属医院,南宁市第二人民医院妇产科生殖中心,南宁 530000)
目的 系统评价GnRH拮抗剂方案中应用口服雌激素预处理对正常反应患者体外受精胚胎移植临床结局的影响。 方法 以“estrogen”、“in vitro fertilization”、“GnRH antagonist”及其对应的中文词系统性检索PubMed/MEDLINE、EMBASE、Cochrane Library、Wiley Library、Web of Science、ScienceDirect databases及中国期刊全文数据库、万方数据库、维普数据库、中国生物医学文献数据库,时间限定为1984~2014,所有拮抗剂周期中雌激素预处理的随机对照实验。 结果 共纳入4篇随机对照实验。雌激素预处理的GnRH拮抗剂方案组与无预处理的GnRH拮抗剂对照组相比,促性腺激素使用时长增加[MD=0.87,95%CI:(0.55,1.19),P<0.01]及总量增加[MD=197.45,95%CI:(164.43,230.47),P<0.01],获卵数升高[MD=1.49,95%CI:(0.44,2.53),P<0.01]。两组患者的继续妊娠率[RR=0.90,95%CI:(0.71,1.16),P=0.43]、临床妊娠率[OR=0.90,95%CI:(0.65,1.25),P=0.54]、活产率[OR=0.8,95%CI:(0.54,1.20),P=0.28]、流产率[OR=0.82,95%CI:(0.42,1.60),P=0.56]均无统计学差异。 结论 雌激素预处理并不影响患者临床妊娠率、活产率、流产率,还能增加获卵数。在体外受精-胚胎移植的临床实践中,雌激素预处理是一种可选的便于生殖中心进行周期调控而不影响患者妊娠结局的方法。
体外受精-胚胎移植; GnRH拮抗剂; 雌激素; 临床结局
(JReprodMed2017,26(4):345-350)
体外受精-胚胎移植技术在全球范围内广泛用于治疗各种不孕症。对于许多不孕患者,IVF助孕是取得妊娠的唯一希望。经过许多学者的探索及实验,促性腺激素释放激素激动剂(GnRH-a)降调节成为IVF一种常规方案。后来,IVF过程中引入口服避孕药预处理进行周期调节及预防早发的LH峰[1]。随后学者发现口服避孕药可以改善卵巢低反应或高反应患者的妊娠结局及预防GnRH-a使用后的卵巢囊肿[2]。2004年左右,促性腺激素释放激素拮抗剂方案被引入IVF治疗中。与GnRH-a长方案相比,拮抗剂方案的特征在于时间短,简单,且有效减少了OHSS的发生率[3]。但是,在长方案中,促性腺激素的启动有灵活性,这恰恰是拮抗剂方案所缺乏的。这个灵活性对患者及生殖中心均有利:能方便患者控制其启动时间和方便生殖中心用于控制其工作量。而拮抗剂方案卵巢刺激须在月经期时启动,所以拮抗剂方案的周期调控较困难。而口服雌激素,可以通过抑制患者体内自发性FSH的升高而实现对患者月经来潮的时间调控,并在整个促排卵(COH)过程中,通过对体内自发性及外源性FSH的调控,实现对卵泡生长的调控[4]。从而雌激素便被广泛应用于调节患者的卵巢刺激启动及取卵时间。我们对拮抗剂方案中应用口服雌激素预处理对体外受精-胚胎移植患者临床结局的影响进行最新一次Meta分析,以期对临床提供参考。
材料与方法
一、检索策略
以“estrogen”、“in vitro fertilization”、“GnRH antagonist”为英文检索词,系统性检索了PubMed/MEDLINE、EMBASE、Cochrane Library、Wiley Library、Web of Science、ScienceDirect databases数据库、欧洲人类辅助生殖及胚胎学学会及美国辅助生殖学会的年会的摘要书籍及中国期刊全文数据库、万方数据库、维普数据库、中国生物医学文献数据库,时间限定为1984~2014年间所有拮抗剂周期中雌激素预处理的随机对照实验,检索策略采用主题词与自由词相结合的方式,并辅以手工检索会议资料和追溯纳入文献的参考文献。
二、纳入标准与排除标准
纳入标准:(1)随机对照实验;(2)实验组及对照组都为拮抗剂方案;(3)实验组为黄体期口服雌激素处理组,雌激素均使用1个周期,用量为4 mg/d;(4)实验需包含充足的实验信息,以方便我们确认该实验是否为真正定义上的随机试验,而实验组与设立的对照组在患者一般特征上是否具有均一性。如两组的基线人口学特征,促性腺激素刺激方案,移植胚胎数及所使用的黄体支持等。若有研究中出现信息不全,必要时邮件联系文章原作者,以完善信息;(5)文献中结局指标包含继续妊娠率、促性腺激素总量、促性腺激素时长等数据。(6)文献中有综合的统计指标:比值比OR或风险比RR。如无明确给出OR值或RR值,根据文中提供数据可计算出OR或RR。(7)文献必须对结果进行详细解释,给出确定结论;(8)实验对象为正常反应患者:年龄≤38岁、月经周期为28~35 d、BMI 18~30 kg/m2、≤2次IVF/ICSI周期。
排除标准:(1)雌激素用于GnRH拮抗剂和GnRH激动剂的比较研究;(2)雌激素用于非IVF-ET的研究;(3)GnRH用于非IVF-ET的研究;(4)与GnRH拮抗剂使用效果无关的研究;(5)失访率超过20%的研究;非随机对照研究;(6)研究数据与其他研究重复;(7)研究数据不全,未报道或无法计算风险效应指标值;(8)雌激素预处理超过一周期的研究,雌激素使用剂量非4 mg/d的研究。(9)基础性激素FSH (>12 U/L)或E2(>293.6 pmol/L),经期第3天窦状卵泡数(AFC)<5个,或上周期获卵数>20或者<5个。
三、文献质量评价与资料提取
RCT的质量评价按照Jüni等[5]的标准进行:随机方法是否正确;是否做到分配隐藏,方法是否正确;是否采用盲法;有无失访、退出,如有失访、退出,是否采用ITT分析。据此将纳人文献质量分为A、B、C三级:完全满足以上条标准,发生各种偏倚的可能性最小,为A级;部分满足以上条标准,发生各种偏倚的可能性为中度,为B级;完全不满足为C级。其它影响研究方法学质量的因素包括:是否为多中心研究、两组间基线是否一致、是否存在混杂因素与交互作用、统计处理方法是否正确。
四、统计分析
采用RevMan 5.1软件进行Meta分析。二分类变量采用RR及其95%CI表示,连续变量则用MD及其95%CI表示,检验水准取α=0.05。不同研究间的异质性检验采用卡方检验,检验水平为P=0.10及I2=50%。无异质性或异质性不大的结果(P<0.10,I2<50%),可采用固定效应模型合并分析;如有较大异质性者(P>0.10,I2>50%),首先分析异质性产生的原因,如无明显临床异质性,可采用随机效应模型合并分析。若纳入研究结果存在明显临床和统计学异质性时,仅采用描述性分析。
结 果
一、纳入研究
1.文献检索及筛选结果:初检到文献45篇,通过阅读文题和摘要,初筛排除33篇;再通过阅读全文,复筛排除7篇不符合纳入标准的文献,进一步排除非随机对照试验和重复发表的研究,最终4项随机对照试验符合我们的标准,被纳入此次分析。这4项试验均于国外开展,其特征被列入表1。
关于黄体期口服雌激素处理的方法,这4篇文献稍有不同:预处理组患者予17β-雌二醇4 mg,1次/日,在月经来潮前连续口服10 d[6-7];或从月经第20天起口服至下周期第2天[8];以及从月经周期的第25天起口服,预处理时长为6~10 d(根据启动预处理的时间是否为工作日)[9]。
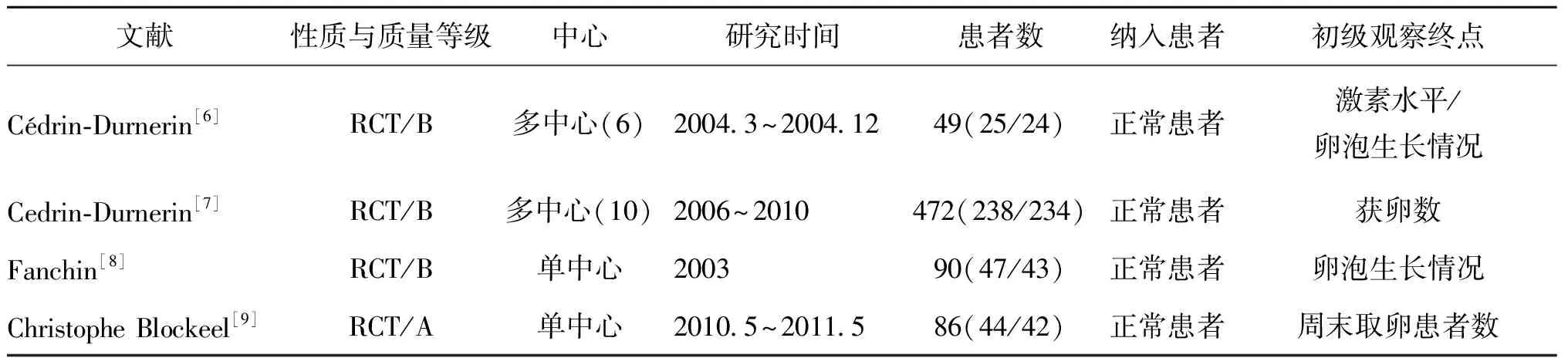
表1 纳入的随机对照实验的特征
二、Meta分析结果
1.继续妊娠率:共有3项实验542例报道了继续妊娠率。各研究同质性较好(P=0.55,I2=0%)(图1),故采用固定效应模型进行Meta分析。我们的研究表明,两组继续妊娠率差异比较无显著意义[RR=0.90,95%CI:(0.71,1.16),P=0.43]。
2.促性腺激素使用时长:共有4项实验633例报道了继续妊娠率。各研究间方差不齐,具有异质性(P=0.02,I2=71%)(图2),故采用随机效应模型进行Meta分析。Meta分析显示,预处理组促性腺激素使用时长显著增长,差异具有统计学意义[MD=0.87,95%CI:(0.55,1.19),P<0.01]。
3.促性腺激素使用总量:共有4项实验633例报道了促性腺激素使用总量。各研究间同质性较好(P=0.36,I2=7%)(图3),故采用固定效应模型进行Meta分析。预处理组促性腺激素使用总量显著增长,差异具有统计学意义[MD=197.45,95%CI:(164.43,230.47),P<0.01]。
4.获卵数:共有4项实验633例报道了获卵数。各研究间有异质性(P=0.07,I2=57%)(图4),故采用随机效应模型进行Meta分析。Meta分析显示,预处理组获卵数显著增长,差异具有统计学意义[MD=1.49,95%CI:(0.44,2.53),P<0.01]。
5.临床妊娠率:共有4项实验633例报道了临床妊娠率。各研究间同质性较好(P=0.11,I2=49%)(图5),故采用固定效应模型进行Meta分析。Meta分析显示,预处理组临床妊娠率与对照组相比较,差异无统计学意义[OR=0.90,95%CI:(0.65,1.25),P=0.54]。
6.流产率:共有3项实验543例报道了流产率。各研究间同质性较好(P=0.15,I2=47%)(图6),故采用固定效应模型进行Meta分析。我们的研究表明,在拮抗剂方案中雌激素预处理患者的流产率与对照组相比,差异无统计学意义[OR=0.82,95%CI:(0.42,1.60),P=0.56]。
7.活产率:共有2项实验467例报道了活产率。各研究间同质性较好(P=0.48,I2=0%)(图7),故采用固定效应模型进行Meta分析。我们的研究表明,在拮抗剂方案中雌激素预处理患者的活产率与对照组相比,差异无统计学意义[OR=0.8,95%CI:(0.54,1.20),P=0.28]。
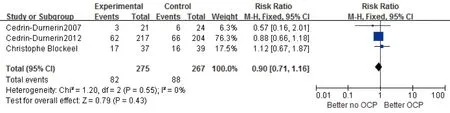
注:R.Fanchin et al.未报道继续妊娠率图1 雌激素预处理组与对照组继续妊娠率Meta结果
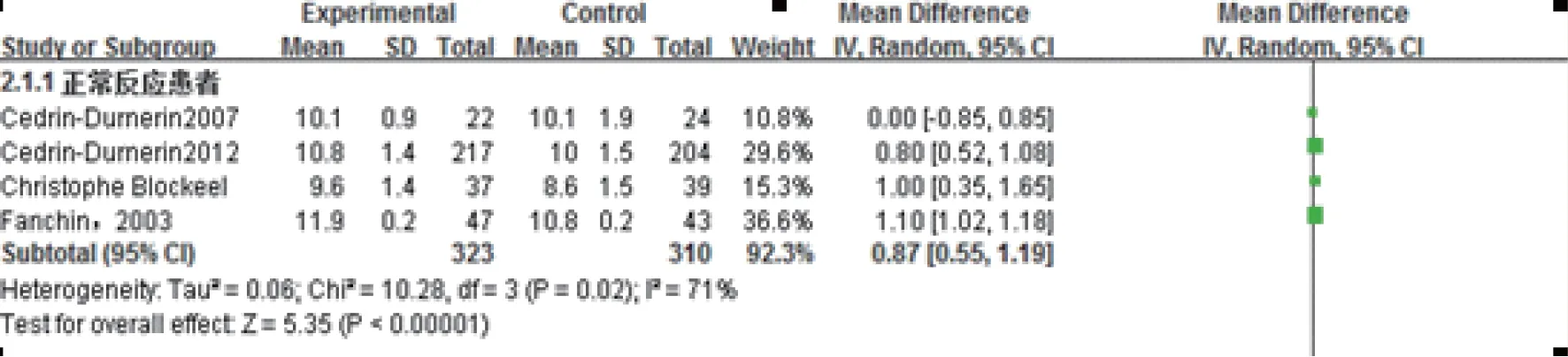
图2 雌激素预处理组与对照组促性腺激素使用时长Meta结果
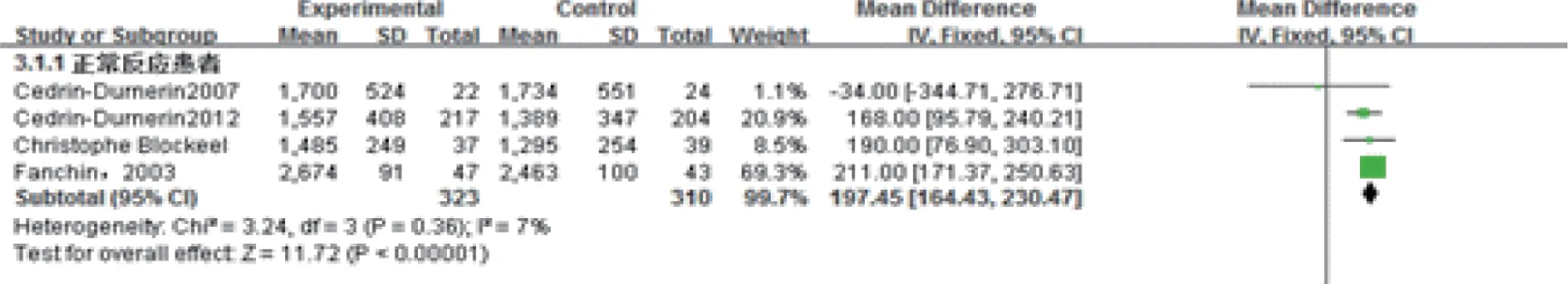
图3 雌激素预处理组与对照组促性腺激素总量Meta结果
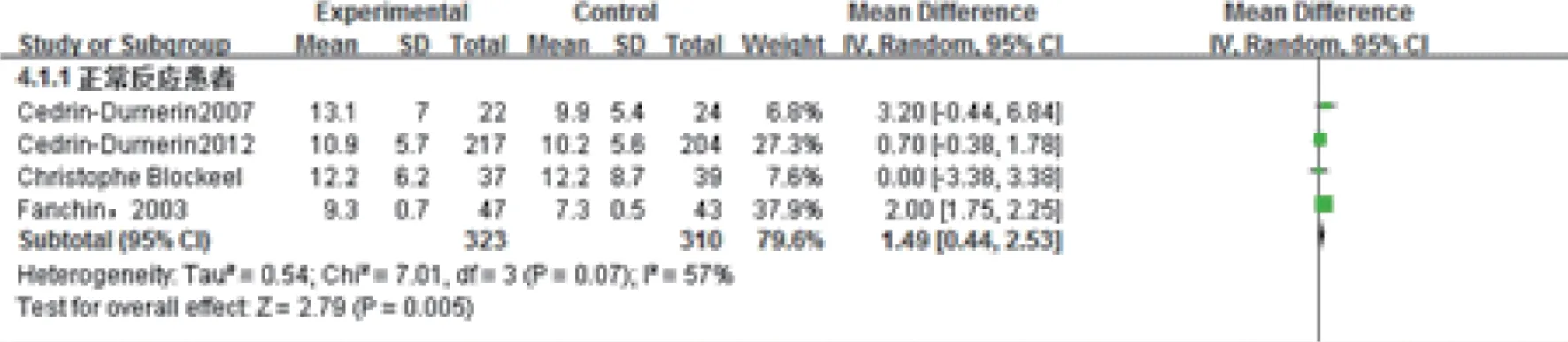
图4 雌激素预处理组与对照组获卵数Meta结果
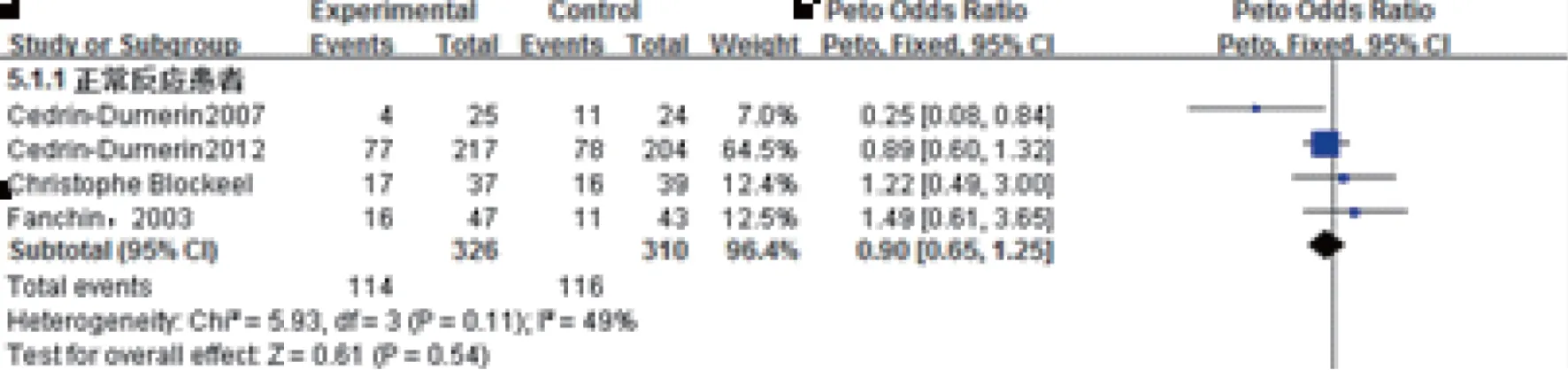
图5 雌激素预处理组与对照组临床妊娠率Meta结果
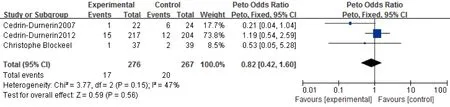
图6 雌激素预处理组与对照组流产率Meta结果
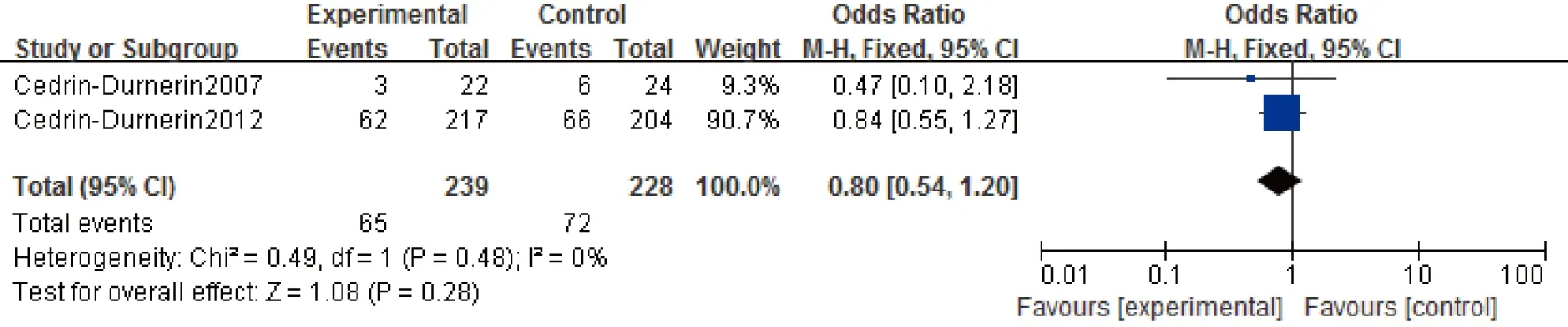
图7 雌激素预处理组与对照组活产率Meta结果
讨 论
许多学者发现黄体期使用雌激素,能补充黄体功能不足引起的雌激素下降,维持足够的雌激素的水平,以对内源性FSH产生抑制作用,防止垂体过早分泌FSH[10-11]。低水平的FSH能防止部分卵泡的提前募集,增加可募集卵泡的反应性,有利于改善卵泡早期卵泡发育的同步化,使得刺激周期产生大小均一、数目更多的成熟卵泡,也能提高卵母细胞质量,增加可移植胚胎数,提高妊娠率。这一作用将在整个促排卵周期中持续存在。而卵泡的协调同步发展,对于GnRH 激动剂方案或是拮抗剂方案,乃至后来的妊娠结局,都是十分有益的。且与经典长方案相比,拮抗剂方案中应用雌激素预处理在临床结局上,两者并无统计学差异,但雌激素预处理为中心工作的安排,提供了十分便利的条件[12]。
我们的研究结果表明,尽管拮抗剂方案中应用雌激素预处理组与对照组相比,患者的促性腺激素使用时长及总量增加,但获卵数也相应增加。Fanchin等[10]的实验也支持这一结论,他们的研究发现,在控制性促排卵黄体中期给予一定量的雌激素,可延缓卵泡生长速度,降低卵泡早期窦卵泡的不均一性,使得更多卵泡生长、成熟,增加获卵数。Hill等[11]发现,给予雌激素预处理后,雌激素峰有显著提高,活产率有升高趋势。Frattarelli等[13]通过自身配对比较,证实了雌激素预处理后,COH中获卵数、成熟卵子数、胚胎数以及采卵后第3天≥7细胞胚胎数/胚胎数(2PN)显著增高。Dragisic等[14]通过自身配对前后对照发现,应用黄体期雌激素及拮抗剂联合皮下注射预处理可以改善卵巢反应性,获卵数、成熟卵数、受精率升高,可移植胚胎数增多。
我们的分析表明,应用雌激素预处理组患者的促性腺激素使用时长及总量增加,如何能既增加卵巢的反应性又不需要增加Gn用量,从而减轻患者的经济负担,是我们下一步需要解决的问题。另外,由于始基卵泡的发育到成熟周期约为3个月,连续应用雌激素预处理3个周期是否将进一步改善卵巢的反应性,提高获卵数,有待证实。也有学者提出口服避孕药中高效孕激素成分可以协助雌激素通过负反馈抑制FSH的上升[15],因此口服避孕药联合雌激素预处理也许可以进一步改善临床妊娠结局[16]。
我们的分析纳入的患者为正常反应患者,事实上,已经有相当一部分学者将雌激素预处理运用到低反应患者的IVF治疗中。如在2013年,Davar等[17]发现对于低反应患者,雌激素预处理方案除了延长促性腺激素的使用时长及总量外,无论在种植率上或临床妊娠率上都与长方案没有统计学差异,但活产率确有升高的趋势,是一种值得考虑的方案,该结论也与Ata等[18]在2011年进行了类似实验结论相同。
综上所述,尽管拮抗剂方案中应用雌激素预处理组与对照组相比,患者的促性腺激素使用时长及总量增加,但获卵数也相应增加。雌激素预处理也并不影响患者临床妊娠率、活产率、流产率及继续妊娠率,所以我们得出结论,在体外受精胚胎移植的临床实践中,雌激素预处理是一种可选的便于生殖中心进行周期调控而不影响患者妊娠结局的方法。
[1] Cohen J,Debache C,Solal P,et al.Results of planned in-vitro fertilization programming through the pre-administration of the estrogen-progesterone combined pill[J]. Hum Reprod,1987,2:7-9.
[2] Barmat LI,Chantilis SJ,Hurst BS,et al.A radomised prospective trail comparing gonaodotrophin-releasing hormone (GnRH) antagonist/recombinant follicle-stimulating hormone (rFSH) versus GnRH-agonist/rFSH in women pretreated with oral contraceptives before in vitro fertilization[J]. Fertil Steril,2005,83:321-330.
[3] Al-Inany HG,Abou-Setta AM,Aboulghar M,et al. Gonadotrophin-releasing hormone antagonists for assisted conception:a Cochrane review[J/OL]. Reprod Biomed Online,2007,14:640-649.
[4] de Ziegler D,Brioschi PA,Benchaa C,et al.Programming ovulation in the menstrual cycle by a simple innovative approach:back to the future of assisted reproduction[J]. Fertil Steril,1999,72:77-82.
[5] Jüni P,Altman DG,Egger M,et al. Systematic reviews in health care:Assessing the quality of controlled clinical trials[J]. BMJ,2001,323:42-46.
[6] Cédrin-Durnerin I,Bständig B,Parneix I,et al. Effects of oral contraceptive,synthetic progestogen or natural estrogen pre-treatments on the hormonal profile and the antral follicle cohort before GnRH antagonist protocol[J].Hum Reprod,2007,22:109-116.
[7] Cédrin-Durnerin I,Guivarc’h-Levêque A,Hugues JN,et al.Pretreatment with estrogen does not affect IVF-ICSI cycle outcome compared with no pretreatment in GnRH antagonist protocol:a prospective randomized trial[J].Fertil Steril,2012,97:1359-1364.
[8] Fanchin R,Salomon L,Castelo-Branco A,et al. Luteal estradiol pre-treatment coordinates follicular growth during controlled ovarian hyperstimulation with GnRH antagonists[J].Hum Reprod,2003,18:2698-2703.
[9] Blockeel C,Engels S,De Vos M,et al.Oestradiol valerate pretreatment in GnRH-antagonist cycles:a randomized controlled trial[J/OL].Reprod Biomed Online,2012,24:272-280.
[10] Fanchin R,Schonäuer LM,Cunha-Filho JS,et al. Coordination of antral follicle growth:basis for innovative concepts of controlled ovarian hyperstimulation[J]. Semin Reprod Med,2005,23:354-362.
[11] Hill MJ,McWilliams GD,Miller KA,et al.A luteal estradiol protocol for anticipated poor-responder patients may improve delivery rates[J]. Fertil Steril,2009,91:739-743.
[12] Garcia-Velasco JA,Bermejo A,Ruiz F,et al.Cycle scheduling with oral contraceptive pills in the GnRH antagonist protocol vs the long protocol:a randomized,controlled trial[J].Fertil Steril,2011,96:590-593.
[13] Frattarelli JL,Lauria-Costab DF,Miller BT,et al.Basal antral follicle number and mean ovarian diameter predict cycle cancellation and ovarian responsiveness in assisted reproductive technology cycles[J]. Fertil Steril,2000,74:512-517.
[14] Dragisic KG,Davis OK,Fasouliotis SJ,et al.Use of a luteal eatradiol patch and a gonaodotrophin-releasing hormone antagonist suppression protocol before gonaodotrophin stimulation for in vitro fertilization in poor responders[J]. Fertil Steril,2005,84:1023-1026.
[15] Kasapoglu T,Polat M,Boynukalin G,et al.Oral contraceptive (OCP) pretreatment is detrimental for pregnancy outcome in poor ovarian responders (PORs) undergoing IVF employing the letrozole/antagonist (L/A) protocol[J]. Fertil Steril,2013,100:105-109.
[16] Vilela M,Marconi M,Zappacosta MP,et al.Oral contraceptive pill (OCP) pretreatment achieves better pregnancy rates in in-vitro fertilization (IVF) antagonists GnRH flexible protocles:a prospective randomized study[J]. Fertil Steril,2011,96:20-26.
[17] Davar R,Rahsepar M,Rahmani E,et al. A comparative study of luteal estradiol pre-treatment in GnRH antagonist protocols and in micro dose flare protocols for poor-responding patients[J]. Arch Gynecol Obstet,2013,287:149-153.
[18] Ata B,Zeng X,Son WY,et al.Follicular synchronization using transdermal estradiol patch and GnRH antagonists in the luteal phase;does it increase oocyte yield in poor responders to gonadotropin stimulation for in vitro fertilization (IVF)? A comparative study with microdose flare-up protocol[J]. Gynecol Endocrinol,2011,27:876-879.
[编辑:罗宏志]
Meta-analysis of estrogen pretreatment in ovarian stimulation with GnRH antagonists for IVF
YISi-si,LIANGXin-hong,QIUYing*
CenterforReproductiveMedicine,DepartmentofObstetrics&Gynecology,NanningSecondPeople’sHospital,ThiedAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530000
Objective:To conducted an updated meta-analysis of the efficacy of oral estrogen pretreatment on pregnancy outcome in GnRH antagonist cycles.Methods:All the estrogen pretreatment in GnRH antagonist regimen of randomized controlled trials from 1984 to 2014 were systematically searched with the terms of “estrogen”,“in vitro fertilization” and “GnRH antagonist” from PubMed/MEDLINE,EMBASE,Cochrane Library,Wiley Library,Web of Science,ScienceDirect database,the Chinese Academic Journal,WanFang DATA,VIP database,Chinese Biomedical Literature Database.Results:Four randomized controlled trials were included. Compared with the GnRH antagonist group without estrogen pretreatment,the duration of gonadotropin [MD0.87,95%CI:(0.55,1.19)],total doses of gonadotropin [MD197.45,95%CI:(164.43,230.47)],and number of oocytes retrieved [MD1.49,95%CI:(0.44,2.53)] were significantly increased (allP<0.01) in the GnRH antagonist with estrogen pretreatment;while the ongoing pregnancy rate [RR=0.90,95%CI:(0.71,1.16),P=0.43],clinical pregnancy rate [OR=0.90,95%CI:(0.65,1.25),P=0.54],live birth rate[OR=0.8,95%CI:(0.54,1.20),P=0.28] and abortion rate [OR=0.82,95%CI:(0.42,1.60),P=0.56] were not significantly different (P>0.05).Conclusions:Estrogen pretreatment does not affect the clinical pregnancy rate,live birth rate and abortion rate,but increase oocytes retrieved. The estrogen pretreatment is an optional method to facilitate cycle control without affecting pregnancy outcome.
IVF-ET; GnRH antagonist; Estrogen; Clinic outcome
10.3969/j.issn.1004-3845.2017.04.011
2016-09-14;
2016-11-06
广西科学研究与技术开发计划项目(桂科攻0993003A-32)
易思思,女,湖南娄底人,博士研究生,妇产科学方向.(*
,Email:qiuying@sina.cn)
