新的囊胚活检方法
——囊胚活检不再纠结和繁琐
2017-04-21吴克良
吴克良
(山东大学附属生殖医院,济南 250001)
新的囊胚活检方法
——囊胚活检不再纠结和繁琐
吴克良
(山东大学附属生殖医院,济南 250001)
囊胚活检目前是进行胚胎植入前遗传学诊断/筛查(PGD/PGS)以及单基因疾病诊断的前提。目前常规使用的提前打孔的囊胚活检方法,会出现囊胚孵出时间不确定、内细胞团处于孵出部位以及囊胚过早孵出等异常现象,给囊胚活检带来了一定的困难,并部分地影响到囊胚最终移植的临床结局。新的非提前打孔囊胚活检法,利用透明带本身的束缚作用减少激光的创面,可以最大程度地减少活检时异常情况的出现,使得活检更加简单并且可控,可以在一定程度上改善移植胚胎的临床结局。
囊胚活检; 透明带打孔; 囊胚孵出; 内细胞团
(JReprodMed2017,26(4):324-327)
胚胎植入前遗传学诊断(PGD)以及胚胎植入前筛查(PGS)是指在体外受精过程中,对具有遗传风险或胚胎异常风险患者的胚胎进行种植前活检和遗传学分析,以选择无遗传学疾病的胚胎植入宫腔,从而获得正常胎儿的诊断方法,可有效地防止有遗传疾病患儿的出生。PGD、PGS技术一方面可以有效地替代传统的产前诊断技术,对异常胚胎进行治疗性流产,避免中期妊娠遗传诊断及终止妊娠所致的危险及痛苦;另外一方面,PGD、PGS技术的产生与完善可以排除遗传病携带者胚胎,阻断致病基因的纵向传递,从而降低人类遗传负荷[1-2]。而且随着二胎政策的实施,目前辅助生殖技术高龄需求者的比例较之前有明显提高,而高龄患者的再生育也伴随着新生儿出生缺陷的风险增加。对高龄孕妇和高危妇女进行PGS可以有效地避免遗传病患儿的出生[3-4]。
胚胎活检以获得少量的胚胎细胞进行遗传学分析是进行PGD、PGS以及单基因疾病诊断的前提。根据实施活检的时期可分为卵裂期活检和囊胚活检。卵裂期胚胎活检大部分情况下活检1~2个卵裂球,对胚胎的发育潜能损伤比较大[5],而且卵裂期胚胎存在嵌合体的比例相对较高,故其产生假阳性或假阴性的比例较高,这在一定程度上给最终的诊断带来较大的风险。因此,卵裂期活检除了少部分采用FISH技术诊断的病例以外,应用越来越少。囊胚活检通常会活检3~6个滋养层细胞,由于囊胚本身的特点以及在一定程度上降低了嵌合体概率[6-7],因此,囊胚活检获得了越来越多的应用。
相关报道证明,通过胚胎培养过程中产生的游离DNA可以比较准确地对胚胎进行遗传学诊断,并且有成功的案例报导[8]。但是该技术目前仍然存在一定的应用缺陷,比如准确率还远远没有达到大量推广的要求、嵌合体问题无法有效解决、无法有效诊断单基因病等。因此,至少在目前的技术条件下,囊胚活检仍然是一项必不可少的实验室常规技术。
目前国际上通用的囊胚活检方法是在胚胎发育至D3时在胚胎透明带上用激光或机械法打一个穿透的小孔,以便胚胎发育成囊胚的时候部分滋养层细胞能够从穿透的小孔中渗透出来,便于滋养层细胞的获取。该方法是目前使用最多的方法,可以比较容易地获得滋养层细胞,并且胚胎发育至相对早期囊胚阶段的时候便有滋养层细胞渗透出透明带。但同时也具有潜在不足。首先,由于透明带打孔时机选择在D3卵裂期,其位置是随机的,当胚胎发育至囊胚期时开孔位置靠近滋养层端还是内细胞团端很难保证,有约1/4的概率是正处或靠近内细胞端(图1),这给滋养层获取带来较大困难并且很难避免激光的热效应对内细胞团的影响;其次,由于提前给透明带打孔,囊胚发育过程中就不会出现囊胚腔完全扩张并使透明带变薄的现象,并且会出现滋养层细胞数目较少、细胞大、提前孵出的情况等等。这些非正常状态下的囊胚发育进程对胚胎植入前后的影响是目前还没有明确的结论,对该类胚胎来源的后代影响目前也缺少系统的追踪;再次,由于缺少透明带压力本身的约束,滋养层细胞数目少、细胞体积大本身也使得在活检过程中激光切割的创面变大,受影响细胞的比例增加,这势必会影响整个囊胚的最终发育潜能[9];最后,透明带打孔后使得胚胎出现部分孵出的现象增加,这样给使得该囊胚在冷冻过程中容易产生胚胎丢失,而且胚胎融解后很难进行再次辅助孵化,可能使得内细胞团部分将来很难孵出导致胚胎着床失败。
另外一种使用相对较少的囊胚活检方法是于囊胚阶段对囊胚进行皱缩并选择合适位置进行打孔,待滋养层部分孵出以后吸取孵出的滋养层细胞部分进行活检。该方法虽然可以避免内细胞团部分的非预期孵出,但是需要等到囊胚再次复张并孵出才能活检,部分情况下当天是无法完成活检的。因此这种活检方法的使用受到极大的限制。
针对目前活检技术所存在的各种缺陷以及不方便,我们中心结合前期大量的实践,探索开发了一种新的非提前打孔式的囊胚活检方法(图2),主要操作流程包括以下几个部分:(1)胚胎自然发育到4期囊胚阶段;(2)用适当的能量对囊胚进行简单皱缩;(3)用较小的激光能量对活检位置的透明带进行开缝;(4)隔着透明带上所开的缝隙,利用负压将所要活检的滋养层细胞吸入活检针中;(5)用激光沿着透明带与活检针的交接处切割滋养层细胞;(6)完全分离所需要的滋养层细胞。
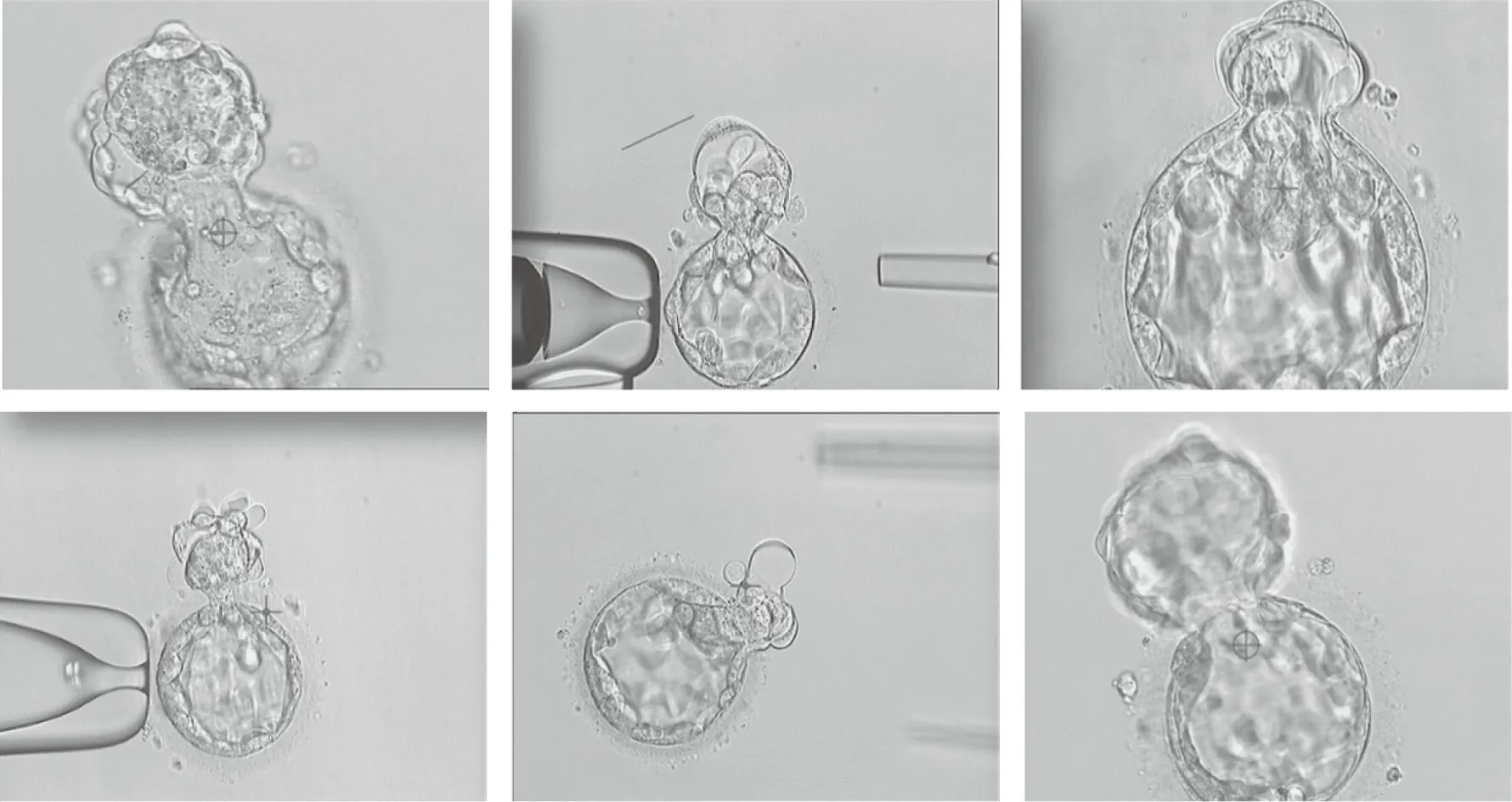
图1 内细胞正处于活检位置或孵出位置
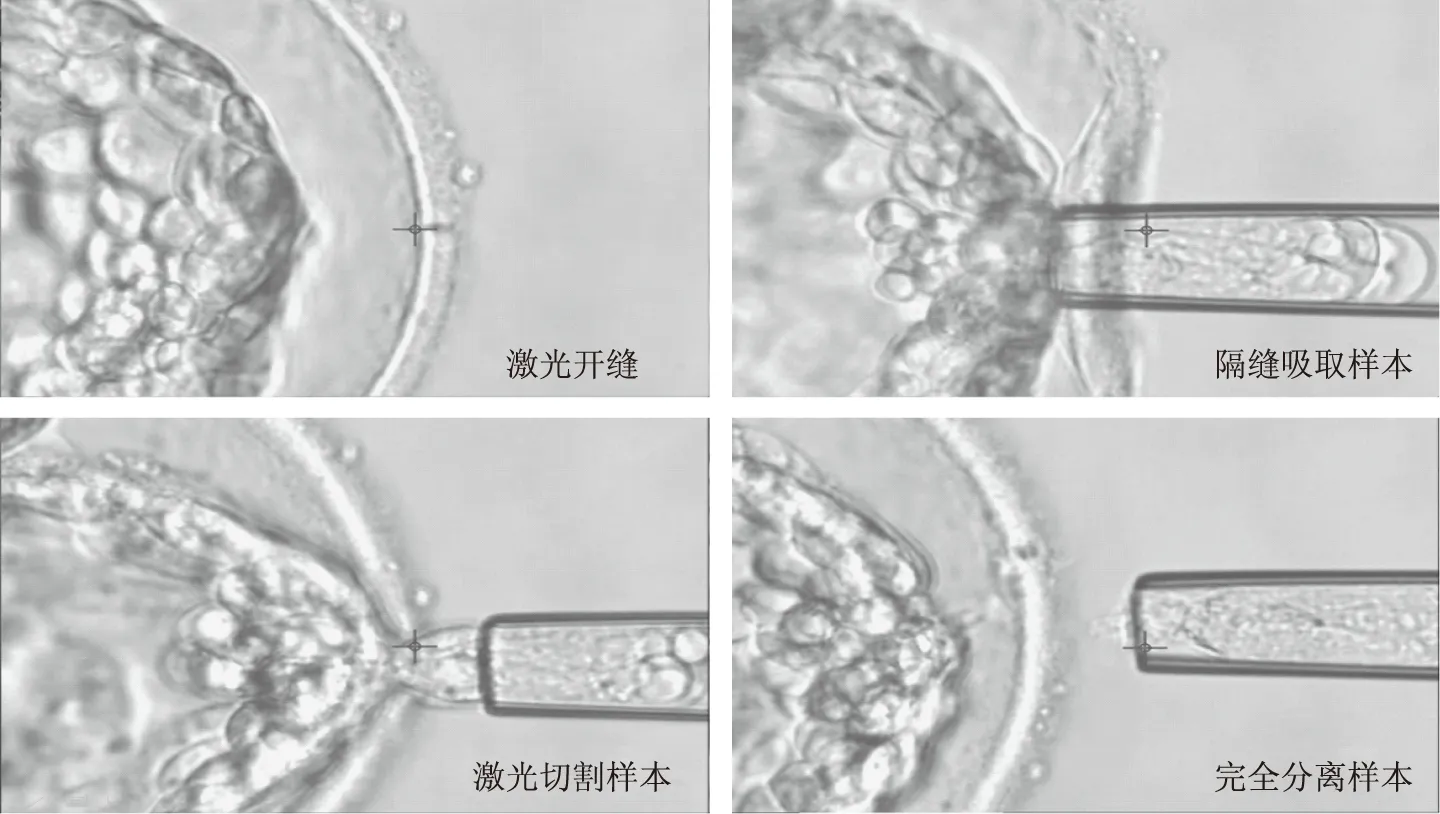
图2 非提前打孔活检的主要步骤
该方法的实施使得我们在活检之前不需要对囊胚做任何操作,每天只要观察一次就能确定囊胚是否需要活检,大大降低了我们对囊胚发育的干预频率,而且可以更好地确保活检后囊胚后期的冷冻和复苏效果。通过简单的随机对照研究发现,采用非提前打孔的方法进行囊胚活检,可以有效避免活检时内细胞团处于活检的位置(0% vs. 16.53%,P=0.0000),显著降低每患者的平均活检次数(1.74 vs. 2.43,P=0.0276),显著降低活检时囊胚处于完全孵出状态的比例(6.11% vs. 20.45%,P=0.0000),活检后胚胎处于透明带内部的比例显著高于常规活检组(89.50% vs. 47.11%,P=0.0000)(表1)。通过移植周期的临床结局简单对比显示,非提前打孔组所获得的临床妊娠率和着床率均显著高于常规活检组(均为79.59% vs. 59.61%,P=0.0296)(表2)。
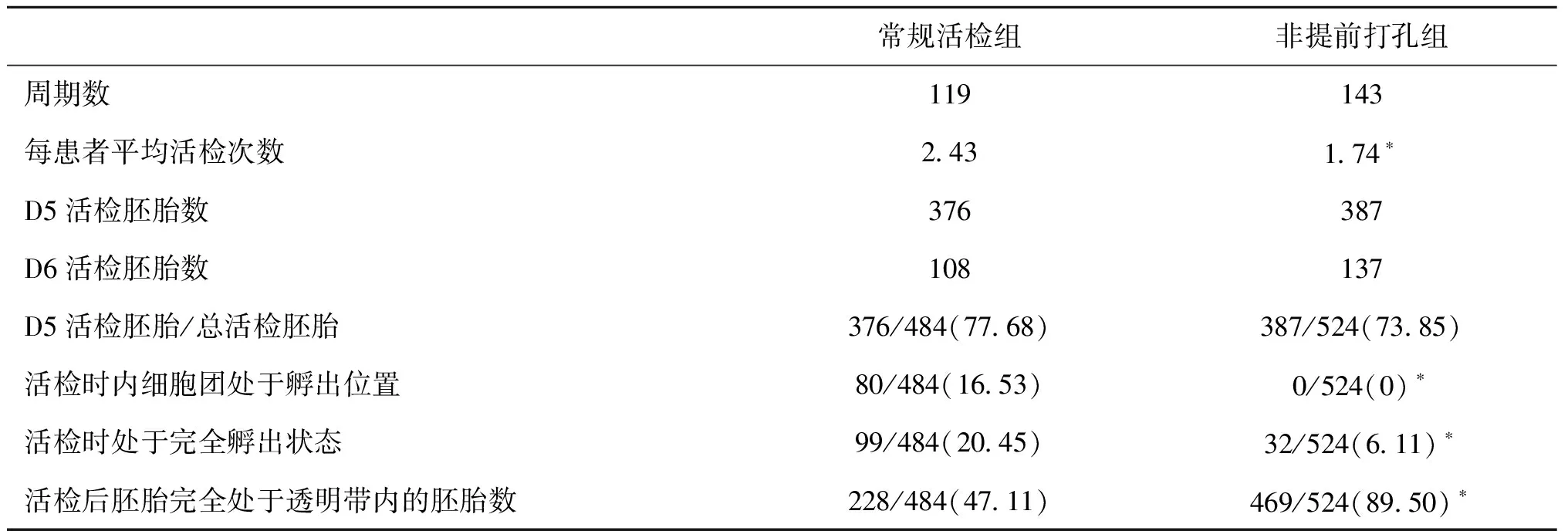
表1 操作效果在常规活检组与非提前打孔组的比较[n(%)]
注:与常规活检组比较,*P<0.05
常规活检方法在活检过程中存在比较多的不确定环节,比如内细胞团处于活检位置、囊胚过早孵出、孵出不充分等等,这些因素也是导致常规活检费时费力的主要原因。而采用新的非提前打孔囊胚活检时,基本不会遇到比较特殊的情况,只需要确定活检时囊胚处于4期阶段即可,大大减少了实验室的操作时间和不确定因素。另外,提前打孔对胚胎的发育本身可能也是一种干扰。在自然状态下,囊胚需要达到足够的细胞数量和足够小的细胞体积才能够完全扩张并孵出。在提前打孔的囊胚活检技术实施过程中,破损的透明带失去了对囊胚的整体束缚作用,使得囊胚在较早阶段时便开始孵出,这也是常规囊胚活检时细胞体积较大、细胞数量整体较少的主要原因,在一定程度上增加了囊胚活检对胚胎的损伤效应[8]。改进的非提前打孔活检法可以使得囊胚在活检之前充分发育,在囊胚扩张与透明带束缚力的反复竞争中,囊胚的数量增加并且体积减小,这也完全符合胚胎的自然发育规律。正是由于提前打孔会导致囊胚的提前孵出,故冷冻时大部分的囊胚可能处于3期阶段,这给临床准备内膜条件带来一定的不确定性,而且细胞体积较大以及部分孵出状态会在一定程度上影响最终的冷冻效果,这可能是临床结局相对较低的主要原因。
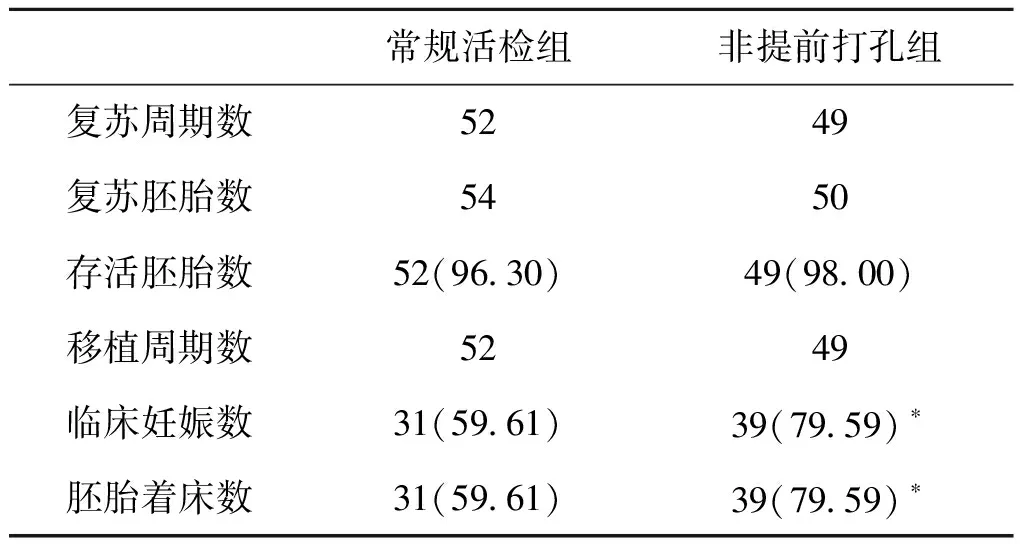
表2 临床结局在常规活检组与非提前打孔组的比较[n(%)]
注:与常规活检组比较,*P<0.05
总之,使用新的囊胚活检方法可以使得囊胚活检变得更加简单,使活检操作人员对活检时机把握得更加明确,并且在一定程度上改善了移植胚胎的临床结局。
[1] Forman EJ,Hong KH,Franasiak JM,et al. Obstetrical and neonatal outcomes from the BEST Trial:single embryo transfer with aneuploidy screening improves outcomes after in vitro fertilization without compromising delivery rates[J].Am J Obstet Gynecol,2014,210:157.e1-6.
[2] Scott RT Jr,Upham KM,Forman EJ,et al. Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates:a randomized controlled trial[J]. Fertil Steril,2013,100:697-703.
[3] Dahdouh EM,Balayla J,García-Velasco JA. Impact of blastocyst biopsy and comprehensive chromosome screening technology on preimplantation genetic screening:a systematic review of randomized controlled trials[J/OL]. Reprod Biomed Online,2015,30:281-289.
[4] Whitney JB,Schiewe MC,Anderson RE. Single center validation of routine blastocyst biopsy implementation[J]. J Assist Reprod Genet,2016,33:1507-1513.
[5] Scott RT Jr,Upham KM,Forman EJ,et al.Cleavage-stage biopsy significantly impairs human embryonic implantation potential while blastocyst biopsy does not:a randomized and paired clinical trial[J]. Fertil Steril,2013,100:624-630.
[6] Greco E,Minasi MG,Fiorentino F. Healthy babies after intrauterine transfer of mosaic aneuploid blastocysts[J].N Engl J Med,2015,373:2089-2090.
[7] Fragouli E,Alfarawati S,Spath K,et al. The developmental potential of mosaic embryos[J]. Hum Reprod,2015,104:e96.
[8] Xu J,Fang R,Chen L,et.al.Noninvasive chromosome screening of human embryos by genome sequencing of embryo culture medium for in vitro fertilization[J]. Proc Natl Acad Sci USA,2016,113:11907-11912.
[9] Bormann CL,Racowsky C. Is universal application of blastocyst biopsy with comprehensive chromosome screening for embryo selection ready for prime time?[J]. Fertil Steril,2013,100:e5-6.
[编辑:罗宏志]
A novel method making blastocyst biopsy simple and controllable
WUKe-liang
ReproductiveHospitalAffiliatedtoShandongUniversity,Jinan250001
Blastocyst biopsy is a prerequisite for PGD & PGS and single gene disorder diagnosis. At present,zona pellucida opening and partially trophectoderm (TE) cell hatching are needed before blastocyst biopsy. It causes that blastocyst hatching time is uncertain,and the inner cell mass is in abnormal position,or blastocyst is hatched prematurely. All these bring the difficulties to blastocyst biopsy,and may also affect the final clinical outcome of biopsied blastocyst transplantation. The new blastocyst biopsy method does not need zona pellucida opening before biopsy,only utilizes the zona pellucida binding force itself to reduce the laser wound,which makes biopsy more simple and controllable,and also improves the clinical outcomes of biopsied blastocyst transfer to some extent.
Blastocyst biopsy; Zona pellucida opening; Blastocyst hatching; Inner cell mass
10.3969/j.issn.1004-3845.2017.04.006
2017-01-18;
2017-02-19
默克雪兰诺中国生殖医学研究基金(2015)
吴克良,男,江苏盐城人,博士,副研究员,发育生物学专业.
