党参对仿刺参免疫和消化功能的影响
2017-04-21李天保于晓清刘恩孚叶海斌
樊 英,李天保,刁 菁,李 乐,于晓清,刘恩孚,叶海斌
(山东省海洋生物研究院,山东省海水养殖病害防治重点实验室,山东青岛266104)
党参对仿刺参免疫和消化功能的影响
樊 英,李天保,刁 菁,李 乐,于晓清,刘恩孚,叶海斌*
(山东省海洋生物研究院,山东省海水养殖病害防治重点实验室,山东青岛266104)
本文探讨了植物源党参对仿刺参机体免疫功能和肠道消化功能的影响。试验过程中党参提取物以微胶囊制剂的形式,按照鼠尾藻粉质量的1%、2%、4%添加到基础饲料中,第14、28、42、56天取样测定体腔液免疫因子和肠道消化酶活性。结果显示:2%党参微胶囊制剂对仿刺参体腔细胞数量、吞噬活性及呼吸爆发活性有显著影响 (P<0.05),第28天活性最高。而且,体腔细胞上清液CLS中超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、一氧化氮合成酶(NOS)活性在第28天最高(P<0.05),分别为67.4 U/mL,2.65 U/100 mL,10.9 U/mL,而酚氧化酶活性(PO)在第42天活性最高(P<0.05),为77.7 U/mL。仿刺参肠道内容物蛋白酶、淀粉酶、褐藻酸梅活性在第28天最高,分别为62.8 U/g·min,57.8 U/100 mL,0.3 U/g·min,与对照组差异显著(P<0.05)。投喂试验结束后,通过致病菌灿烂弧菌攻毒试验进行免疫增强剂党参的效果评价。结果显示:2%党参微胶囊制剂对仿刺参的免疫保护率最强,其累积死亡率仅有21.3%。故党参可通过提高仿刺参机体免疫因子活性和肠道消化酶活性,从而间接提高仿刺参抗病能力。
免疫增强剂;党参;仿刺参;免疫;消化;抗病力
近年来,仿刺参 (Apostichopus japonicus,Se lenka)已成为北方养殖业最大的养殖品种之一,然而,随着养殖规模化、集约化的发展,仿刺参病害的发生频率及程度越来越高,自“腐皮综合征”发生以来,寻求绿色环保、无公害的免疫增强剂便成为预防仿刺参疾病发生的研究热点(马悦欣等,2006;张春云等,2006)。
党参(Codonopsis pilosula)是桔梗科多年生草本植物的根茎,富含多种营养成分,如多糖、酚类、甾醇类、皂甙等。据报道,党参多糖是党参的一种重要的组成成分,具有多种生物学活性,包括增强免疫力、抗肿瘤、抗氧化、降血脂等(樊长征和洪巧瑜,2016;宴永新等,2013)。而且还可作为动物机体的一种营养饲料,加速代谢效率,提高转化速度,从而增强吸收效率。本文在基础饲料中添加不同比例的党参,研究其对仿刺参免疫及消化功能的影响,旨在为党参作为免疫增强剂提供有力的依据。
1 材料与方法
1.1 试验材料 党参提取物纯度高达85%,由西安宝鸡生物有限公司提供,实验室内制备党参微胶囊(锐孔凝固浴方式制备,其包埋率达85%),备用;健康仿刺参,初始体重为(19.00±2.00)g;基础饲料是海泥与鼠尾藻粉按1∶1溶于过滤海水中并煮沸;SOD、ACP、T-NOS等试剂盒均购于南京建成生物工程研究所,其他试剂均为国药集团化学分析纯。
1.2 试验条件 水温16~18℃,pH 7.8~8.2,盐度31‰~32‰,溶解氧>5 mg/L;仿刺参饲养于圆形玻璃钢桶(直径65 cm,高65 cm)内,16头/桶,足量投喂,暂养7 d后用于试验;试验中连续充气,每日吸除粪便,换水50%;隔日倒池,自然光照(室内)。
1.3 试验设计 试验分5个处理组,对照组投喂海泥和鼠尾藻粉基础饲料,微胶囊空白对照组投喂1%空白微胶囊,试验组按照鼠尾藻粉质量的1%、2%、4%进行党参微胶囊添加。设平行组和重复试验。
试验投喂周期8周,每天下午3∶00进行饱食投喂,每天上午9∶00进行粪便吸除、换水。
试验期间第14、28、42、56天取样,检测体腔液相关免疫指标及肠道内容物消化酶活性。
投喂试验结束后进行致病菌灿烂弧菌攻毒感染试验,通过累积死亡率检测免疫保护效果。
1.4 试验方法
1.4.1 体腔细胞计数 (TCC) 随机挑取仿刺参,解剖得体腔液,体腔液与抗凝剂(0.02 mol/L EGTA,0.48 mol/L NaCl,0.02 mol/L KCl,0.07 mol/L Tris-HCl,pH 7.6)按体积比为1∶1充分混合,通过血球计数板进行体腔细胞计数。然后离心8 min (5000 r/min,4℃),弃上清液,迅速用4℃冰冻的等渗缓冲液(0.001 mol/L EGTA,0.53 mol/L NaCl,0.01 mol/L Tris-HCl,pH 7.6)将体腔细胞沉淀物浓度调整到2×106cells/mL,迅速用液氮保存并贮存于-80℃冰箱中用于分析。
1.4.2 体腔细胞破碎物上清液(CLS)的制备 体腔细胞样品于4℃下解冻并加入PMSF(0.1 m mol/L),用超声波匀浆6 s(输出22 kHz,0℃),离心8 min(10000 r/min,4℃)。所得上清液(CLS)用于免疫指标的测定。
1.4.3 吞噬活性的测定 取100 μL抗凝体腔液加入96孔板中,贴壁 30 min后弃上清液,加入100 μL(0.001 mol/L)中性红溶液,室温吞噬30 min,用生理盐水洗掉未被吞噬的中性红,加入100 μL细胞裂解液 (冰醋酸与无水乙醇按1∶1体积比配制),裂解 20 min,测定其在波长540 nm处的吸光值,以试验条件下每106个体腔细胞对应的吸光值来表示吞噬活性。
1.4.4 呼吸爆发活性测定 准确吸取200 μL体腔细胞悬液,然后加入等体积的2 mg/mL的NBT(溶在含2%NaCl的Tris-HCl中,pH 7.6),室温下避光反应1 h,500 r/min离心5 min,去除上清,用等渗缓冲液洗涤后加入200 μL甲醇,室温固定10 min,800 r/min离心8 min,去除上清,50%的甲醇洗涤3次,去除上清于室温下晾干;干燥后加入120 μL KOH(2 mol/L)和140 μL DMSO,充分溶解后测定其在波长620 nm下的吸光值。
1.4.5 酚氧化酶(PO)活性的测定 取50 μL制备的CLS样品与50 μL胰蛋白酶溶液(0.1 mg/mL)放入96孔板中,充分混匀,室温下温育10 min,然后加入50 μL左旋多巴(L-DOPA)溶液(3 mg/mL),室温下温育10 min,立刻在495 nm下测定吸光值,以试验条件下每毫升样品每分钟吸光度值每增加0.001定义为一个酶活力单位(U/mL)。
1.4.6 超氧化物歧化酶 (SOD)、酸性磷酸酶(ACP)和一氧化氮合成酶(NOS)活性测定 CLS样品中SOD、ACP和T-NOS活性使用南京建成试剂盒测定。SOD酶活性单位定义为每毫升样品在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个酶活性单位,活性表示为U/mL;CLS中ACP酶活性单位定义为每100 mL样品在30 min产生1 mg酚为1个酶活性单位,活性表示为U/100 mL。T-NOS活性定义为在提供充足的底物的条件下一氧化氮合成酶每分钟产生1 nmol NO所需要的酶量,活性表示为U/mL。
1.4.7 肠道内容物样品的获取 随机挑取仿刺参,在冰盘中取出肠道,称取0.5 g,加入10倍体积(v/w)的预冷重蒸水,在冰浴中(0~4℃)组织匀浆5 min,10000 r/min冷冻离心15 min,取上清液测定消化酶活力。
1.4.8 肠道内容物上清液蛋白酶活性的测定 福林酚法:试管中加入0.5%的酪蛋白溶液1.0 mL和pH 7.2的磷酸缓冲液2.0 mL,40℃保温5 min,加入粗酶液0.5 mL,保温20 min,立即加入10%三氯乙酸1.0 mL终止反应。取出常温离心(3000 r/min)10min后得上清液1mL,加入0.4mol/L的碳酸钠溶液2.5 mL,再加入1.0 mol/L的福林试剂1.0 mL,于40℃恒温水浴显色20 min,然后在680 nm波长下比色测定,对照管在加入粗酶液前加入三氯乙酸使酶失活,其他同测定管。蛋白酶活力单位定义:在pH 7.2和 40℃下保温20 min,1 g刺参消化道1 min水解酪蛋白产生1 μg酪氨酸即为1个蛋白酶活力单位。
1.4.9 肠道内容物上清液淀粉酶活性的测定 淀粉—碘显色法:向试管中加入0.5%可溶性淀粉5 mL,于37℃水浴中预热5 min,加入粗酶液1.0 mL,充分混匀后,37℃水浴反应7.5 min,再加入0.01 mol/L碘应用液5.0 mL终止反应,然后稀释到50 mL,立即充分混匀后660 nm处比色。空白不加酶液,其他同测定管。淀粉酶活力定义为:pH 7.0条件下,在 (37±1)℃条件下保温30 min,100 mL酶液中的淀粉酶完全水解淀粉10 mg为1个淀粉酶活力单位。
1.4.10 肠道内容物上清液褐藻酸酶活性的测定3,5-二硝基水杨酸法:用0.2 mol/L的醋酸-醋酸钠缓冲液(pH 5.6)溶解褐藻酸钠,配成0.5%的溶液作为反应底物。取500 μL粗酶液,加入2 mL底物,40℃反应1 h后沸水浴5 min终止反应,将粗酶液置于沸水浴中灭活5min作为对照。在上述条件下以每分钟水解褐藻酸钠释放出相当于1.0 μmol/L葡萄糖含量时所需的酶量为1个酶活力单位U/mL。
1.4.11 攻毒感染试验 攻毒感染试验使用的灿烂弧菌由中国水产科学研究院黄海水产研究所提供,活化后的灿烂弧菌经胰蛋白胨大豆肉汤培养基(TSB)28℃培养24 h,用无菌生理盐水调整浓度为108cfu/mL。试验结束后,随机抽取10头仿刺参进行攻毒试验,每头仿刺参经体壁注射剂量为0.l mL的灿烂弧菌稀释液2次,对照组注射相同量的生理盐水,及时记录仿刺参的日死亡情况,14 d后结束感染试验并统计其累积死亡率。计算公式如下:
累积死亡率/%=仿刺参累积死亡数量/初始数量×100。
1.5 数据处理 试验数据利用软件SPSS 17.0进行单因素方差分析,并进行多重比较,显著性水平为P<0.05。
2 结果
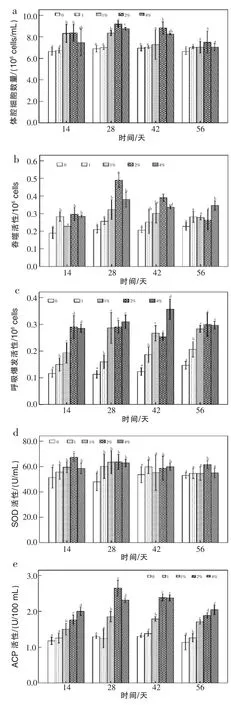
2.1 党参对仿刺参体腔细胞数量、吞噬活性、呼吸爆发活性的影响 从图1a中可以看出,党参可显著影响仿刺参体腔细胞数量(P<0.05)。在投喂第28天,2%试验组仿刺参体腔细胞数量达到最高水平(9.2×106cells/mL),其次是4%试验组(8.7×106cells/mL)。
图1b反映的是党参对仿刺参体腔细胞吞噬活性的影响。在投喂第28天,2%试验组仿刺参体腔细胞吞噬活性达到最高水平,与对照组比较差异性显著(P<0.05);然而,当投喂第56天时,试验组仿刺参体腔细胞吞噬活性与对照组之间无显著差异(P>0.05)。
从图1c中可看出,党参对仿刺参体腔细胞呼吸爆发活性同样产生了影响。投喂第28天,2%试验组和1%试验组仿刺参体腔细胞呼吸爆发活性达到相同水平,并且与对照组比较差异显著(P<0.05)。在投喂第42天时,4%试验组仿刺参体腔细胞呼吸爆发活性较对照组显著增强(P<0.05)。
2.2 党参对仿刺参CLS中SOD、ACP、NOS、PO活性的影响 从图1d中得出,投喂第14天时,2%试验组仿刺参CLS中SOD活性达到最高水平(67.4 U/mL),与对照组差异显著(P<0.05),但其他试验组之间无显著性差异(P>0.05)。
从图1e中得出,投喂第28天时,2%试验组仿刺参CLS中ACP活性达到最高水平 (2.65 U/ 100 mL),与对照组(1.29 U/100 mL)差异显著(P<0.05)。4%试验组仿刺参CLS中ACP活性在投喂第42天达到最高水平,且时间延长,活性降低。
从图1f中得出,投喂第28天时,2%试验组仿刺参CLS中NOS活性水平最高,与对照组及其他试验组之间都存在显著性差异(P<0.05)。投喂第42天时,4%试验组仿刺参CLS中NOS活性水平最高,与对照组及其他试验组之间都存在显性差异(P<0.05)。
从图1g中得出,投喂第42天时,2%试验组仿刺参CLS中PO活性水平最高,与对照组及其他试验组之间都存在显著性差异(P<0.05);投喂第28天时,4%试验组仿刺参CLS中PO活性水平最高;投喂第56天时,PO活性有所下降。
2.3 党参对仿刺参肠道内容物蛋白酶、淀粉酶、褐藻酸酶活性的影响 从图1h中看出,投喂第28天时,2%试验组仿刺参肠道内容物溶液中蛋白酶活力最高,达到62.8 U/g·min,与对照组和其他试验组之间存在显著性差异(P<0.05);然而,在投喂第56天时,试验组仿刺参蛋白酶活性与对照组则无显著性差异(P>0.05),表明随着投喂时间的延长,蛋白酶活性出现下降的趋势。
图1i显示,2%党参投喂组肠道内容物上清液中淀粉酶活力在第28天时,达到最大,与其他试验组及对照组之间差异显著(P<0.05);在第42天、第56天时,淀粉酶活力比第28天有所降低,但仍比对照组要高。
从图1j中得出,2%党参投喂试验组肠道内容物上清液中褐藻酸酶活力在第28天达到最大(0.3 U/g·min),与其他试验组及对照组之间差异显著(P<0.05);而在第42天、56天时,褐藻酸酶活力发生了下降现象。
2.4 攻毒感染试验结果 从表1中可看出,党参可有效提高仿刺参机体免疫力。经灿烂弧菌感染后,2%试验组仿刺参在攻毒14 d内累积死亡率为21.3%,而对照组累积死亡率高达44.6%,且对照组出现死亡的时间较试验组早。
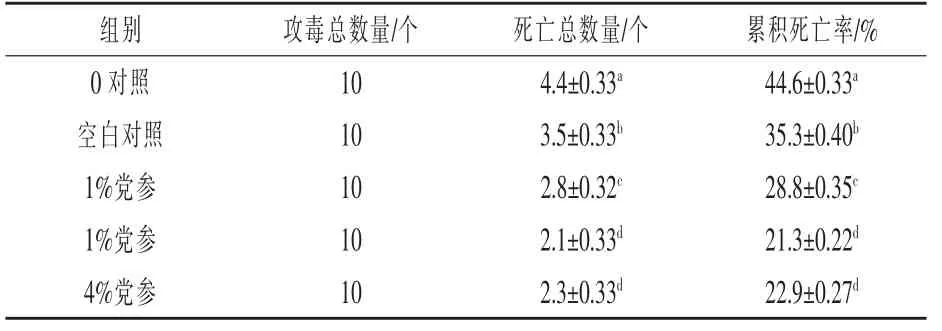
表1 灿烂弧菌攻毒后14 d内仿刺参累积死亡率(平均值±标准误)
3 讨论
3.1 党参对仿刺参机体免疫功能的影响 免疫增强剂是一类通过不同作用方式提高机体免疫功能的物质,可单独或同时与抗原使用增强机体免疫应答。目前,研究使用的免疫增强剂很多(张琴等,2011;王淑娴等,2010;陈效儒等,2010;樊英等,2010;李继业,2008),其对不同动物的作用机理也逐渐被熟悉,主要集中于机体细胞免疫和体液免疫相关的免疫因子变化。研究表明,黄芪多糖、茯苓多糖能够显著增强仿刺参体腔细胞免疫活性,并且不同的给予方式可产生不同程度的效果(王淑娴等,2010;樊英等,2010)。不同的免疫增强剂由于不同的成分结构、作用机理、使用对象及使用方法,产生的作用效果也不同。研究表明,党参对人或小鼠等动物机体免疫存在着显著的促进作用(樊长征和洪巧瑜,2016;宴永新等,2013)。对于无特异性免疫的仿刺参来说,体腔细胞是免疫系统的主要防线之一。本研究结果表明,党参对仿刺参体腔细胞数量、吞噬活性及呼吸爆发活性均产生了显著影响,不同程度地增强了机体抗病力。表明党参可能作为营养物质促进了细胞分裂、增殖,从而提高了体腔细胞的数量;然而,体腔细胞的呼吸爆发活性和吞噬活性也被党参的多种营养成分激活。已有的研究也证实,多糖、维生素、甘草酸等物质也可不同程度地促进体腔细胞生物活性(张琴等,2011;陈效儒等,2010;Wang等,2008)。
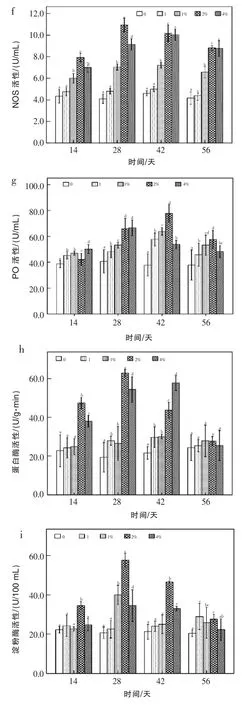
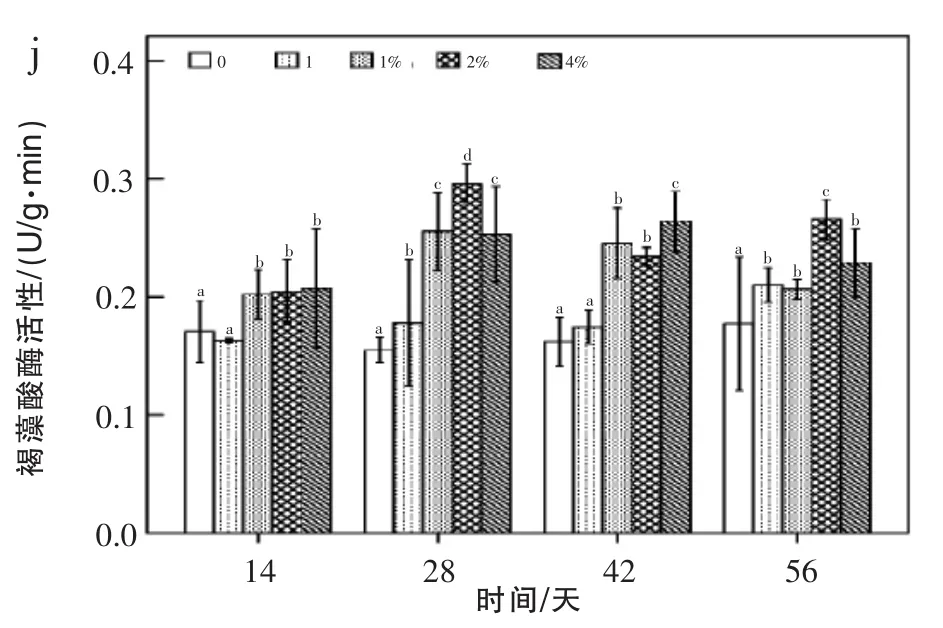
图1 党参对仿刺参免疫和消化功能的影响
体液免疫系统中含有多种免疫酶,也不同程度的影响着机体的免疫功能。SOD是反映抗氧化能力的一个重要指标,可间接反映机体抗病力或抗逆境的能力(樊英等,2010;李继业,2008)。ACP是非特异性软体动物体内溶酶体的重要标志酶。有研究表明,在海参免疫系统中,ACP被证实具有调理素作用,能诱导阿米巴细胞对外来物质进行吞噬和包囊,从而间接反映机体的免疫功能和抵抗外界侵害的能力(孙永欣,2008)。NOS诱导产生的NO能够与活性氧中间体及硫醇等相互作用产生不同类型的活性氮中间体,从而对病原生物起到杀灭作用。PO是仿刺参体内重要的异物识别系统。每当入侵的异物将该系统激活后,其中的酚氧化酶就将酚催化成黑色素,黑色素及其中间产物具有抗微生物活性,即将一些病原体杀死(常杰,2010)。本研究结果表明,党参能够明显促进仿刺参CLS中SOD活性,提高机体抗氧化能力,说明党参中的甙类或胆碱等成分可能与消除氧自由基的作用相关;ACP活性也表现出显著的变化,其中以2%试验组在第28天提高程度最强,且添加量与免疫效果之间呈现不规律的变化趋势,当添加量为4%时ACP活性反而降低;并且在第42天、56天时活性有所降低,但下降趋势缓慢,故党参的添加时间与刺参体腔液ACP活性之间存在一定的相关性,但长时间添加对机体免疫无利。PO值在投喂42 d后显著提高,可能原因是酚氧化物酶原遇到复杂营养生物成分时被细胞内的结合蛋白识别,激活形成大量的PO。PO系统也体现了机体遇到异物时的免疫反应灵敏性和平衡性,机体在充分的反应后及时消除异物并能够恢复常态(常杰,2010)。NOS在党参的作用下加速催化L-精氨酸,在体内合成与多种免疫活性有关的内源性NO,通过阻止DNA、蛋白质或脂质合成而产生抗菌和抗病毒的活性(Howe等,2002;Karu-Piah等,1993)。同时,微胶囊剂型的添加方式很大程度地降低了党参提取物的水溶率,在之后的推广示范应用中更易形成规模化。本试验中不同的添加量表现了不同的作用效果,其中以2%微胶囊试验组效果最好,与对照组差异显著 (P<0.05),但随着时间的延长,免疫酶的活性反而降低,表明党参的作用效果与给予剂量、给予时间之间都存在着明显的相关性,且不成正比例关系,这可能与党参自身的结构、免疫调节机制以及仿刺参机体免疫系统特征有关。
3.2 党参对仿刺参肠道消化功能的影响 党参具有多种营养成分,不仅可提高机体对有害刺激的抵抗能力,增强巨噬细胞的吞噬能力,还具有调整胃肠运动功能,在特异性免疫缺乏的情况下能够有效发挥其调节功能,通过促进消化功能间接提高机体抗病力。仿刺参肠道消化酶种类很多,主要是蛋白酶、淀粉酶、脂肪酶、纤维素酶和褐藻酸酶(任庆印,2012;唐黎等,2010)。本试验结果表明,仿刺参肠道蛋白酶活性极高,这与袁成玉(2006)、任庆印等(2013)的研究结果一致,党参提取物对其表现了明显的增强作用,其次是淀粉酶活性,可能党参的不同活性成分颗粒链接到不同的细胞受体上,因其本身的结构特征改变细胞膜的结构和呈递作用等,促使淀粉酶分泌和表达,提高了其效果;也可能是投喂党参后仿刺参肠道微生态环境发生改变,促进了细菌的繁殖代谢,从而增强酶活性,具体机制尚需进一步研究。仿刺参肠道中褐藻酸酶活性相对较低,任庆印(2012)研究表明,褐藻酸酶大部分存在于仿刺参前肠,能够首先分解细胞壁,保证其他物质的继续消化,有利于营养物质的消化吸收。
[1]常杰.对虾和刺参敏感免疫学指标的筛选和评价:[博士学位论文][D].青岛:中国海洋大学,2010.
[2]陈效儒,张文兵,麦康森,等.饲料中添加甘草酸对刺参生长、免疫及抗病力的影响[J].水生生物学报,2010,34(4):731~738.
[3]樊英,王淑娴,叶海斌,等.黄芪多糖对仿刺参非特异性免疫功能的影响[J].水产科学,2010,29(6):321~324.
[4]樊长征,洪巧瑜.党参对人体各系统作用的现代药理研究进展[J].中国医药导报,2016,10:39~43.
[5]孔伟丽.免疫增强剂及疫苗对刺参(Apostichopus japonicus)免疫酶活性及抗病力影响的初步研究:[硕士学位论文][D].青岛:中国海洋大学,2008.
[6]李继业.养殖刺参免疫学特征与病害研究:[博士学位论文][D].青岛:中国海洋大学,2007.
[7]马悦欣,徐高蓉,张恩鹏,等.仿刺参幼参急性口围肿胀症的细菌性病原[J].水产学报,2006,30(3):377~382.
[8]任庆印.刺参(Apostichopus japonicus)在夏眠过程中生理代谢调控机制的研究:[硕士学位论文][D].青岛:中国海洋大学,2012.
[9]任庆印,潘鲁青.刺参消化酶性质与活性分步的研究[J].海洋湖沼通报,2013,2:51~56.
[10]孙永欣.黄芪多糖促进刺参免疫力和生长性能的研究:[博士学位论文] [D].大连:大连理工大学,2008.
[11]唐黎,王吉桥,许重,等.仿刺参4种消化酶活力的周年变化[J].上海海洋大学学报,2010,19(6):768~771.
[12]王淑娴,李天保,樊英,等.茯苓多糖对刺参体腔液中免疫因子活性的影响[J].饲料研究,2010,1:59~61.
[13]晏永新,张丽,贾海芳,等.党参多糖口服液对小鼠免疫功能的影响[J].中国兽药杂志,2013,47(3):18~20.
[14]张春云,王印庚,荣小军.养殖刺参腐皮综合症病原菌的分离与鉴定[J].水产学报,2006,30(l):118~123.
[15]袁成玉,张洪,吴垠,等.微生态制剂对幼刺参生长及消化酶活性的影响[J].水产科学,2006,25(12):612~615.
[16]张琴,麦康森,张文兵,等.饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J].动物营养学报,2011,23(10):1745~1755.
[17]张琴,麦康森,张文兵,等.饲料中添加硒酵母和维生素E对刺参生长、免疫力及抗病力的影响[J].动物营养学报,2011,23(10):1745~1755.
[18]Howe D,Barrows L,Lindstrom N,et al.Nitric oxide inhibits Coxjella burnetii rePlieation and ParasitoPhorous vacuole maturation[J].Infeet.Immun,2002,70:5140~5147.
[19]KaruPiah G,Xie Q,Buller R,et al.Inhibition of viral replieation by interferon-γ-induced nitric oxide synthase[J].Seienee,1993,261:1445~1448.
[20]Wang K,Liu Z,Xu Y,et al.Effect of L-ascorbic acid asimmunity enhancer for juvenile sea cucumber,Apostichopus japonicu [J].J Biotechnol,2008,136(1):556~557.■
The study was conducted to investigate the effect of Codonopsis pilosula(C.pilosula)microcapsules on the immunity,digestion and resistance against Vibrio splendidus infection of Apostichopus japonicus.The basic feed was supplemented with 1%,2%,4%C.pilosula microcapsules on the rate of Sargassum thunbergii.Immune indices and digestive enzymes were tested on the 14th,28th,42thand 56thdays.The results showed that 2%C.pilosula microcapsules could significantly improve the total coelomocytes counts(TCC),phagocytic activity and outbreak of respiratory activity after 28 days (P<0.05);Moreover,superoxide dismutase(SOD),acid phosphatase(ACP),nitric oxide synthase(T-NOS)activities in coelomocytes lysate supernatants(CLS)were 67.4 U/mL,2.65 U/100 mL,10.9 U/mL,and its activity were the highest on the 28thday.;but phenoloxidase(PO)activity in the CLS was the highest on the 42thday.Again protease,amylase and alginase activities in intestinal content were 62.8 U/g·min,57.8 U/100 mL,0.3 U/g·min on the 28thday,and its activity were the highest. After feeding for 56 days,sea cucumbers from each treatment were challenged with V.splendidus.Cumulative incidence and mortality of sea cucumbers fed with C.pilosula were found to be lower than that of the control,especially 2%treatment,the mortality rate was only 21.3%.The results indicated that quantitative diet supplemented with C.pilosula stimulated the immunity and digestion of A.japonicus,thus enhanced their resistance against V.splendidus.
immunostimulants;Codonopsis pilosula;Apostichopus japonicus;immunity;digestion;resistance
S816.7
A
1004-3314(2017)07-0020-06
10.15906/j.cnki.cn11-2975/s.20170704
海洋公益性行业科研专项经费项目(201305005)
*通讯作者
