基于旋转设计优化胶原蛋白ACE抑制肽制备工艺
2017-04-20于志鹏张霜赵文竹张倩沈俊彤王瑜霍倩倩励建荣刘静波
于志鹏,张霜,赵文竹,*,张倩,沈俊彤,王瑜,霍倩倩,励建荣,*,刘静波
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013;2.吉林大学营养与功能食品研究室,吉林长春130062)
基于旋转设计优化胶原蛋白ACE抑制肽制备工艺
于志鹏1,张霜1,赵文竹1,*,张倩1,沈俊彤1,王瑜1,霍倩倩1,励建荣1,*,刘静波2
(1.渤海大学食品科学与工程学院,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁锦州121013;2.吉林大学营养与功能食品研究室,吉林长春130062)
采用ProtamexR蛋白酶水解鱼胶原蛋白源制备血管紧张素转化酶(ACE)抑制肽,并采用pH-stat法测定水解度,对影响水解效果的pH值、温度、底物浓度和加酶量4个因素进行考察,并进行三元二次通用旋转设计进行优化,对活性肽的ACE抑制活性和结构进行分析。结果表明在底物浓度11.8%,pH 8.7,加酶量5.4%和酶解温度53.6℃条件下,酶解1h所得的鱼皮胶原蛋白水解度为16.6%,经高效液相测定鱼皮ACE抑制活性为45%,经圆二色谱分析鱼胶原蛋白ACE抑制肽主要以无规卷曲形式存在。
鱼胶原蛋白;血管紧张素转化酶;活性肽;二级结构
血管紧张素转化酶(Angiotensin-converting Enzyme,ACE)对血压具有重要的调节作用[1],一方面它催化无活性的血管紧张素Ⅰ(AngⅠ)转化成具有升高血压作用的血管紧张素Ⅱ(AngⅡ);另一方面能够使具有降压作用的舒缓激肽失活[2-3]。来源于食物蛋白的ACE抑制肽通过调节ACE活性从而起到降血压作用,同时可最大限度避免降血压药物产生毒副作用,因此也越来越受到广泛关注。近年来,大量降压肽/ ACE抑制肽陆续在海洋生物中发现[4-5],如金枪鱼、鲣鱼、虾类、藻类等。鱼皮作为加工中的下脚料,其中的胶原蛋白资源被大大浪费。本研究以鱼皮胶原蛋白为原料制备ACE抑制肽,通过单因素试验结合三元二次正交组合设计对鱼皮胶原蛋白制备ACE抑制肽的工艺条件进行优化,旨在拓宽ACE活性肽的原料来源并提高水产加工的附加值。
1 材料与方法
1.1 材料与仪器
鱼胶原蛋白:河北百味生物科技有限公司;血管紧张素转化酶(ACE)、卡托普利、马尿酰组氨酰亮氨酸(HHL)、马尿酸:美国Sigma公司;ProtamexR蛋白酶(活力1.5 AU-N/g):诺维信公司;乙腈、甲醇、三氟乙酸(色谱纯):美国Thermo Fisher科技公司。
高效液相色谱仪:美国安捷伦科技公司;HH-2数显恒温水浴锅:金坛大地自动化仪器厂;ZD-2雷磁电位滴定仪:上海雷磁仪器厂;JJ-1精密增力电动搅拌器:江苏省金坛市自动化仪器厂;AG204型电子天平:瑞士梅特勒-托利多公司;RE 52-86A旋转蒸发器:上海亚荣生化仪器厂;KQ-100DB台式数控超声波清洗器:成都一科仪器设备有限公司;IR Prestige-21傅里叶红外光谱:岛津企业管理(中国)有限公司;Jasco J-810圆二色谱仪:日本分光(JASCO)株式会社。
1.2 方法
1.2.1 鱼胶原蛋白源的酶解工艺
取一定量鱼胶原蛋白加蒸馏水并加热使其溶解制成相应质量浓度的胶原蛋白溶液。利用ProtamexR蛋白酶对鱼胶原蛋白进行水解,水解时置于水浴锅中并用电动搅拌器不断搅拌,到达设定反应时间后,提高温度至90℃终止水解反应。酶解液经冷冻离心取上清液进行后续试验。
1.2.2 单因素试验
以水解度为指标,经单因素试验初步考察酶解温度、加酶量、底物浓度和pH值4个因素对ProtamexR蛋白酶水解鱼胶原蛋白制备ACE抑制活性肽的水解度的影响。
将鱼皮胶原蛋白水溶液调整pH值分别在7、8、9、10和11条件下,并在底物浓度5%、加酶量5%和50℃情况下酶解解1 h,研究pH值对鱼胶原蛋白水解效果的影响。
设定鱼胶原蛋白水解温度分别为40、50、60、70、80℃并在底物浓度5%、加酶量5%和pH10情况下酶解解1 h,研究温度对鱼胶原蛋白水解效果的影响。
将加酶量分别设定为1%、3%、5%、7%、9%,并在pH10、底物浓度5%和50℃情况下酶解1 h,研究pH值对鱼胶原蛋白水解效果的影响。
将鱼胶原蛋白底物浓度分别配置为1%、5%、10%、15%、20%,并在pH 10、加酶量5%和50℃情况下酶解解1 h,研究pH值对鱼胶原蛋白水解效果的影响。
1.2.3 酶解鱼胶原蛋白制备活性肽正交组合设计模型
在单因素试验基础上,进行三元二次通用旋转设计优化,分别考察温度、加酶量和pH值及其两两因素交互作用和因素二次项对水解效果的影响,因素水平见表1。

表1 因素编码表Table1 Experiment factorscoding table
1.2.4 蛋白质水解度(DH)的测定
水解度测定采用pH-stat法[6]。
1.2.5 血管紧张素转化酶抑制活性的测定
采用高效液相色谱法,在Wu等[7]方法基础上进行修改,取30μLHHL底物液,加入10μL抑制剂混合均匀,在(37±0.5)℃恒温水浴中预热3min~5min,然后加入20μLACE(2.0 U/mg蛋白)液充分混合,37℃保温30min后,再加入60μL的1mol/LHCl终止反应,得到反应液,同时用10μL pH为8.3的硼酸缓冲液替代抑制剂溶液作为空白对照组[8]。该反应液用0.45μm滤膜过滤后直接用HPLC系统进行分析。色谱条件:InertsilWP300 C18色谱柱(5μm,125mm× 4.0mm),柱温25℃,流速0.5mL/min,流动相乙腈/水(0.05%TFA)比例为25/75等梯度洗脱,检测波长228 nm。
ACE抑制活性计算公式如下:

式中:M为空白对照组中马尿酸的峰面积;N为添加抑制剂组中马尿酸的峰面积。
配制不同浓度的鱼胶原蛋白源ACE抑制肽的水溶液,按照血管紧张素转化酶抑制活性测定方法测定进而获得不同浓度样品对ACE活性的抑制率,以抑制率对鱼胶原蛋白ACE抑制肽浓度(mg/mL)作图,根据趋势线获得抑制率为50%时对应的鱼胶原蛋白源ACE抑制肽的浓度,即为半抑制浓度(IC50)。
1.2.6 圆二色谱分析
鱼胶原蛋白ACE抑制肽的圆二色谱分析,具体步骤如下:100mmo1/L的硼酸盐缓冲液(pH 8.3)配制鱼胶原蛋白ACE抑制肽溶液,使用厚度为0.2mm的石英样品池,波长范围设置为190nm~250nm,活性肽浓度为20mg/mL,检测温度为25℃,扫描速度100 nm/min,每个样品重复扫描3次,并以硼酸盐缓冲液为空白样品进行对照。
1.2.7 数据统计分析
采用Origin对数据进行处理分析,样品测定结果采用平均值±标准偏差表示。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 pH值对水解效果的影响
pH值对明胶水解度的影响如图1所示。
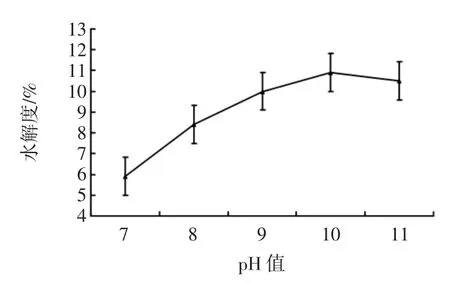
图1 pH值对水解效果的影响Fig.1 Influenceof pH on the degreeofhydrolysis
从图1中可以看出,当pH值小于10时,随着pH值的增大,明胶水解度逐渐增大;当pH值等于10时,酶活力较高,水解度最好;当pH值大于10时,随着pH值的增大,明胶水解度开始下降,因此试验应在pH值等于10时研究后续的单因素试验。
2.1.2 温度对水解效果的影响
温度对明胶水解度的影响如图2所示。

图2 温度对水解效果的影响Fig.2 Influenceof tem peratureon the degreeof hydrolysis
从图2中可以看出,温度在40℃~50℃时,明胶水解液的水解度随温度升高而升高;50℃时水解度最好,随着温度的升高水解度逐渐下降,这是由于一方面当温度升高,酶活性增强、反应速度加快;另一方面当温度持续升高时,酶活性减弱、酶的稳定性降低。因此本试验应该在温度为50℃时进行后续试验。
2.1.3 底物浓度对水解效果的影响
底物浓度对明胶水解度的影响如图3所示。

图3 底物浓度对水解效果的影响Fig.3 Influenceof substrate concentration on thedegreeof hydrolysis
从图中可以看出,当底物浓度大于1%时,随着底物浓度的增加,明胶水解度逐渐降低;当底物浓度由5%增加至15%时,由于底物浓度的增加,胶原蛋白的水解效果有所降低;当底物浓度继续增加至20%时,酶促反应开始明显减慢。综合考虑选择底物浓度在15%进行后续的试验。
2.1.4 加酶量对水解效果的影响
加酶量对明胶水解度的影响如图4所示。

图4 加酶量对水解效果的影响Fig.4 Influenceof enzym eaddition on thedegreeof hydrolysis
从图4中可以看出,当加酶量在小于5%时,随着加酶量的增加,明胶水解度逐渐增大;当加酶量大于5%时,明胶水解度缓慢增加,由于考虑到复合蛋白酶的利用率,减少酶的用量,降低生产成本。综合考虑加酶量应在5%。
2.2 三元二次正交组合设计模型的建立
在单因素基础上进行了正交组合设计,其结果见表2,并进行了回归系数的显著性检验、回归方程检验和失拟检验。

表2 三元二次回归正交试验结果Table2 Resu ltsof quad ratic regression orthogonalcombination designed

F回=(S回/f回)/(SR/fR)=6.83>F0.01(5,11)=5.32,表明方程在0.01水平下显著,且满足
Flf<F0.25(9,2)=3.37,方程不失拟,可见回归方程拟合的很好。
根据西尔维斯特不等式判别方程的极值[9],利用求驻点方法求得当水解度取得极值时,x1=1.82;x2= 0.72;x3=0.72,将因素编码表代入方程中,即在底物浓度为11.8%,酶解pH值为8.7,加酶量5.4%和酶解温度53.6℃条件下,酶解1 h所得的鱼皮胶原蛋白水解度为17%,并经试验验证,此条件下对应的胶原蛋白水解度为16.6%与回归方程优化结果相近。
2.3 鱼胶原蛋白肽ACE抑制活性及圆二色谱分析
利用高效液相色谱法对鱼胶原蛋白ACE抑制肽的体外活性测定,结果表明其抑制率为45%,具有作为ACE抑制肽开发的潜力。通过圆二色谱分析鱼胶原蛋白ACE抑制肽的空间结构,结果表明主要存在无规卷曲结构,而未形成稳定的α螺旋、β转角和β折叠结构。
3 结论
本文以鱼胶原蛋白为原料,选用ProtamexR蛋白酶进行酶解并获得最优酶解参数,即在底物浓度为11.8%,酶解pH值为8.7,加酶量5.4%和酶解温度53.6℃条件下,酶解1 h,利用高效液相色谱法对鱼胶原蛋白肽的ACE抑制活性进行测定结果表明其抑制率达到45%,且圆二色谱结果表明活性肽溶液以无规卷曲空间构型为主。
[1]杨英士,陈伟,杨海燕,等.昆仑雪菊中血管紧张素转化酶活性抑制成分的分离鉴定[J].南京农业大学学报,2015(1):146-151
[2]罗李王,杨最素,张亚茹,等.酶解青蛤制备ACE抑制肽的工艺优化[J].食品工业,2016(6):56-59
[3]肖斌.鲍鱼内脏蛋白质酶解制备降血压多肽的研究[D].福州:福建农林大学,2013
[4]Shan He,Chris Franco,Wei Zhang.Functions,applications and production of protein hydrolysates from fish processingco-products (FPCP)[J].Food Research International,2013,50:289-297
[5]Yesim Akagündüz,Mauricio Mosquera,Begoña Giménez,etal.Sea bream bones and scales as a source of gelatin and ACE inhibitoryPeptides[J].LWT-Food Science and Technology,2014,50:579-585
[6]Liu Lijun,Zhu Chuanhe,Zhao Zheng.Analyzingmolecular weight distribution of whey protein hydrolysates[J].Food and bioproducts processing,2008,86(1):1-6
[7]Wu JP,AlukoRE,Muir AD.Improvedmethod for directhigh-performance liquid chromatography assay ofangiotensin convertingenzyme-catalyzed reactions[J].Journal of Chromatography A,2002, 950:125-130
[8]Yu Z P,Yin Y G,ZhaoWZ,et al.Antihypertensive effect of angiotensin-converting enzyme inhibitory peptide rvpsl on spontaneouslyhypertensive ratsby regulatinggeneexpression of the reninangiotensin system[J].Journal of Agricultural and Food Chemistry, 2014,62:912-917
[9]任露泉.试验优化设计与分析[M].北京:高等教育出版社,2003:440-442
Enzyme Hydrolysis Preparation M odel of Collagen-derived ACE Inhibitory Peptides Based on Quadratic General Rotation Design
YU Zhi-peng1,ZHANGShuang1,ZHAOWen-zhu1,*,ZHANGQian1,SHEN Jun-tong1,WANGYu1,HUOQian-qian1,LIJian-rong1,*,LIU Jing-bo2
(1.Collegeof Food Scienceand Engineering,BohaiUniversity,National&Local JointEngineering Research Centerof Storage Processingand Safety Control Technology for Fresh Agriculturaland Aquatic Products,Jinzhou 121013,Liaoning,China;2.Lab ofNutrition and Functional Food,Jilin University,Changchun 130062,Jilin,China)
Fish-derived collagenwashydrolyzed by protamexRprotease andmeasured by the degree ofhydrolysis.Thehydrolysismodelofpeptides from fish-derived collagen wasestablished through quadratic general rotation design followed single factorexperiment,subsequently ACE inhibitory activity and secondary structure of fish collagen-derived peptideswasmeasured.The resultsshowed that the equation for theoptimal regression equation had amaximal value according to regression coefficient test,regression equation,and the lack of fit test.The optimal details ofenzymatic hydrolysiswas followed:substrate concentration 11.8%,enzymatic hydrolysis pH value 8.7,the amountofenzyme 5.4%and hydrolysis temperature 53.6℃,and hydrolysis degree of fish-derived collagen was 16.6%in one hour.In vitro ACE inhibitory activity of bioactive peptides from fish-derived collagen was performed by high performance liquid chromatography,and the value ofactivity against ACE was 45%.In addition,secondary structure of fish collagen-derived ACE inhibitory peptide was random coil.
fish-derived collagen;angiotensin convertingenzyme(ACE);bioactivepeptide;secondary structure
10.3969/j.issn.1005-6521.2017.07.013
2016-08-03
2016-09-07
国家科技支撑课题(2012BAD00B03);辽宁省科学事业公益研究基金项目(2016004004);渤海大学博士启动项目(0515bs079);辽宁省科技攻关项目(2015103020)
于志鹏(1984—),男(汉),讲师,博士,研究方向:蛋白质及活性肽的功能研究与产品开发。
*通信作者:赵文竹(1986—),女,讲师,博士,研究方向:营养与功能食品;励建荣(1964—),男,教授,博士,研究方向:水产品加工。
