电解质检测在维持性血透患者治疗中的临床意义
2017-04-20陈静
陈静
(扬州市第二人民医院检验科,江苏扬州225000)
电解质检测在维持性血透患者治疗中的临床意义
陈静
(扬州市第二人民医院检验科,江苏扬州225000)
目的调查单个透析中心维持性血液透析(MHD)患者透析前后电解质的水平,探讨电解质检测在维持性血透患者治疗中的临床意义。方法选取2013年4月-2016年7月我院透析中心接受血液透析治疗的患者97例为观察组,另选取我院内科非肾功能减退患者97例为对照组。比较两组电解质指标,检测观察组透析前后电解质指标并相比较。结果对照组与观察组有明显差异(P<0.05),观察组K+、sPHOS、sMg指标水平显著高于对照组,Na+、Cl-、sCa水平显著低于对照组。观察组患者透析后K+、sPHOS、sMg水平均显著低于透析前(P<0.05),Na+、sCa水平均显著高于透析前(P<0.05)。结论维持性血透治疗可以纠正尿毒症患者的电解质紊乱,适时监测有利于其病情的评估和治疗方案的调整。
尿毒症;维持性血液透析;电解质
当前,随着血液净化技术的不断发展,尿毒症患者的治疗和预后有了很大的改善。然而MHD患者最常见并发症慢性肾脏病-矿物质和骨异常的发生和最主要的病死因心血管事件都与终末期肾衰(ESRD)患者出现的多种电解质紊乱息息相关。本研究通过检测MHD患者透析前后电解质的水平,探讨电解质检测在维持性血透患者治疗中的临床意义。
1 资料与方法
1.1 资料
1.1.1 CRF组选择2013年4月-2016年7月我院透析中心收治的97例慢性肾衰竭尿毒症患者,其中男性(53)例,女性(44)例;年龄(25-87)岁,平均(53.8±14.7)岁。全部病例均符合慢性肾衰竭尿毒症期的诊断标准,且病情稳定。
1.1.2 对照组我院内科非肾功能减退患者97例,男50例,女47例,年龄23~73岁,平均年龄(52.9± 12.5)岁,且无电解质紊乱。
1.2 方法
1.2.1 治疗方法CHD使用贝朗血液透析机、尼普洛150G透析器;HFHD使用贝朗血液透析机、东丽TS-1.6SL透析器;HDF使用贝朗血液透析机、东丽TS-1.6UL透析器。透析液碳酸氢盐。
1.2.2 血液标本检测CRF组均于透析开始和透析结束时,分别使用带分离胶的促凝管,采集患者静脉血3ml,对照组清晨空腹静脉血采集,3000r/min离心15min,保留血清待检。采用日立HITACHI7100生化分析仪检测血钙(sCa)、血磷(sPHOS)、血镁(sMg),采用XD-690电解质分析仪检测K+、Na+、Cl-,所有操作均按SOP严格执行。sMg检测与三酰甘油、碱性磷酸酶、肌酸激酶及其同工酶同时检测时,复检避免试剂携带污染。
1.2.3 试剂与检测方法sCa采用偶氮胂Ⅲ法(中山标佳生物科技公司),sPHOS采用磷钼酸紫外法(中山标佳生物科技公司),sMg采用XB-Ⅰ法(日本和光纯药工业株式会社),质控品(朗道质控品)。上机参数均按检测试剂盒提供的使用说明书进行设置并用配套标准液进行定标。K+、Na+、Cl-采用离子选择电极法(上海迅达医疗仪器有限公司)。
1.2.4 统计学处理应用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,两两比较采用t检验,P<0.05为差异有统计学意义。
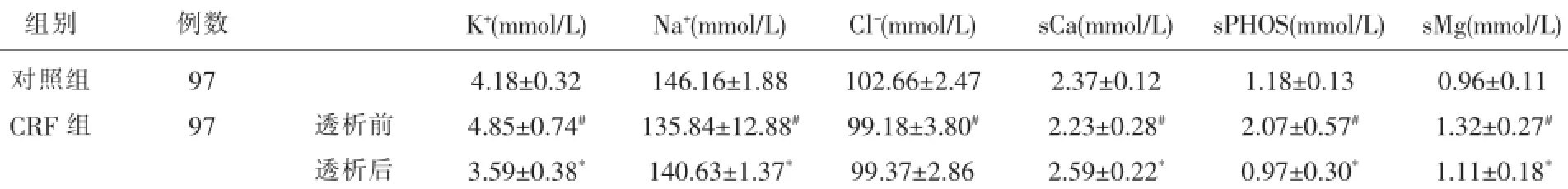
表1 CRF患者透析前与对照组、透析后结果比较
2 结果
2.1 观察组透析前与对照组、透析后电解质结果比较结果见表1。
3 讨论
终末期肾衰(ESRD)是各种慢性肾脏病持续进展的共同结局,出现代谢产物潴留,水、电解质和酸碱平衡失调等内环境紊乱而导致多脏器功能损害的一种临床综合征。维持性血液透析(MHD)是目前治疗ESRD的主要手段。
本研究显示MHD患者透析前与对照组比较,K+、sPHOS、sMg指标水平显著高于对照组,Na+、Cl-、sCa水平显著低于对照组。MHD患者常见高血钾,主要原因有:肾衰时尿K+排出减少引起K+在体内蓄积;组织损伤、感染和热量不足所致的细胞分解代谢增强、代谢性酸中毒和缺氧均可使K+从细胞内外逸;大量输入库存血或高钾饮食;肾衰伴发高血压患者需服用的血管紧张素酶抑制剂、透析使用的肝素等药物可加重高血钾;透析不充分也可使血钾升高。高钾血症对机体的主要危害是引起心跳骤停。所以它是MHD患者除心力衰竭外最常见的额外增加透析的原因[1]。本研究显示MHD患者中,78%存在高磷血症。当肾小球滤过率(GFR)<60ml/(min·1.73m2)时就可以出现尿磷排泄减少,血磷升高。但不产生症状,却诱发低血钙,由于磷从肾脏排泄障碍而使肠道排泄增加,而在肠道中与钙结合成不易被吸收的磷酸盐影响钙吸收;结合钙随尿白蛋白丢失;维生素D二次羟化障碍,导致活性维生素D减少,均可引起低钙血症。低血钙刺激甲状旁腺细胞增殖,促进甲状旁腺功能亢进。除外这种间接反馈调节,高血磷也可直接刺激甲状旁腺功能亢进和细胞增殖[2]。甲状旁腺功能亢进又可进一步加剧骨溶解释放磷。从而导致慢性肾脏病-矿物质和骨异常的发生。有研究发现血磷>2.1mmol/L患者与血磷0.78~2.1mmol/L患者相比,死亡危险性增加27%[3]。血管钙化与钙磷负荷密切相关。MHD患者血磷水平与饮食、透析充分性、磷结合剂、活性维生素D制剂、骨代谢有关。本研究中MHD患者88%有高镁血症。当肾小球滤过率(GFR)<30ml/(min·1.73m2)时,镁排泄分数的增加难以代偿,就会发生高镁血症。MHD患者高血镁与饮食、透析、维生素D制剂因素相关。长期高血镁引起患者骨痛并增加骨折风险[4],但近年越来越多的研究提示适度的血镁升高对MHD患者或许为保护性因素[5]。镁是钙天然的拮抗剂,可以调节血管钙化的发生发展[6]。Tzanakis I等[7]发现血镁<1.23mmol/L的MHD患者与血镁>1.23mmol/L的患者相比,出现二尖瓣钙化的风险要升高2倍。Joao-Matias P等[8]发现血清镁<1.15mmol/L的MHD患者全因死亡率及心血管死亡风险明显增加。因此,MHD患者更应避免低血镁的发生。MHD患者由于水钠调节功能低下,常会出现水钠潴留和体液容量超负荷,临床表现为稀释性低血钠。同时,代谢性酸中毒时,Na+由细胞内与K+置换也可引起低钠血症。赵凤梅[9]等发现低钠血症与尿毒症脑病密切相关。MHD患者钠负荷敏感性高于正常人群,钠摄入稍有增加即可引起血压升高,导致心血管疾病的发生。
血液透析是利用半透膜的原理,将患者的血液与透析液同时引进透析器,两者在透析膜的两侧呈反方向流动,借助膜两侧的溶质梯度、渗透梯度和水压梯度,以达到清除毒素和体内潴留过多的水分,同时补充体内所需的物质,并纠正电解质和酸碱平衡[10]。本研究显示透析后K+、sPHOS、sMg水平均显著低于透析前(P<0.05),Na+、sCa水平均显著高于透析前(P<0.05)。多种电解质紊乱得到了纠正。MHD患者电解质影响因素多,电解质紊乱发生率高,控制难度大,电解质水平的波动不可避免。随着不同浓度碳酸氢盐透析液透析治疗的深入,电解质检测对个体化透析治疗有指导意义。适时监测有利于其病情的评估和治疗方案的调整。
[1]Saccheui A,Stuccio N,Panebianco P,et al.ED hemodialysis for treatment of renal failure emergencies[J].Am J Emer Med,1999,17:305-307.
[2]Zhang Q,Qiu J,Li H,et al.Cyclooxygenase 2 parathyroid pyperlasia in ESRD[J].J Am Soc Nephrol,22(4):664-672.
[3]Block GA,Port FK.Re-evelauation of risks associated with hyperhosphatemia and hyperparathyroidism in dialysis patients:recommendations for a change in management[J].Am J Kidney Dis,2000,35:1226-1237.
[4]Navarro-González JF,Mora-Fernández C,García-Pérez J.Clinical implications of disordered magnesium homeostasis in chronic renal failure and dialysis[J].Semin Dial,2009,22(1):37-44.
[5]吕颖,宓恩娜,周晓云,等.低血镁与维持性血液透析患者心血管死亡危险因素相关[J].中国中西医结合肾病杂志,2016,17(6):538.
[6]Louvet L,Bazin D,Büchel J,et al.Characterisation of calcium phosphate crystals on calcified human aortic vascular smooth muscle cells and potential role of magnesium[J].PLoS One,2015,10:e0115342.
[7]Tzanakis I,Pras A,Kounali D,et al.Mitral annular calcifications in haemodialysis patients:a possible protective role of magnesium[J]. Nephrol Dial Transplant,1997,12:2036-2037.
[8]Joao-Matias P,Azevedo A,Laranjinha I,et al.Lowerserum magnesium is associated with cardiovascular riskfactors and mortality in haemodialysis patients[J].Blood Purif,2014,38(3-4):244-252.
[9]赵凤梅,陈建荣.电解质紊乱在尿毒症脑病发病中的作用[J].内科急危重症杂志,2000,6(4):189-189.
[10]李志坚,郑勋华.血液透析的原理和设备[J].新医学,2001,32 (11):688-689.
R446.11+2,R692.5
A
1674-1129(2017)02-0262-03
10.3969/j.issn.1674-1129.2017.02.042
2016-08-22;
2017-03-08)
