人胚胎干细胞源性间充质干细胞来源的外泌体生物学特性的研究
2017-04-20张国威胡国文牛鑫汪泱邓志锋
张国威,胡国文,牛鑫,汪泱,邓志锋
(1、泰山医学院,山东泰安271000;2、上海交通大学附属第六人民医院神经外科,上海200233;3、南昌大学第二附属医院神经外科,江西南昌330006;4、上海交通大学附属第六人民医院四肢显微外科研究所,上海200233)
人胚胎干细胞源性间充质干细胞来源的外泌体生物学特性的研究
张国威1,2,胡国文3,牛鑫4,汪泱4,邓志锋2
(1、泰山医学院,山东泰安271000;2、上海交通大学附属第六人民医院神经外科,上海200233;3、南昌大学第二附属医院神经外科,江西南昌330006;4、上海交通大学附属第六人民医院四肢显微外科研究所,上海200233)
目的探讨人胚胎干细胞源性间充质干细胞(human embryonic stem cell derived mesenchymal stem cells,hESCMSCs)来源的外泌体的生物学特性。方法将已注册的未分化、人类ESC H9细胞系诱导成间充质干细胞(mesenchymal stem cells,MSCs),通过旋转超滤法从培养基中提取外泌体(exosomes)。流式细胞分析技术鉴定hESC-MSCs表面标志物,对间充质干细胞进行三系分化诱导,利用透射电镜、Izon qNano纳米粒子分析系统观察外泌体的形态和大小,Western blotting鉴定外泌体表面特异性标志物,观察hESC-MSCs-Exo对人微血管内皮细胞(human microvascular endothelial cells,HMEC-1)增殖和迁移的影响。结果成功诱导形成hESC-MSCs,并收集纯化外泌体。诱导后的MSCs CD29、CD73、CD90、CD105、CD146、CD44表达阳性,CD34、CD133、CD45、HLA-DR-PE表达阴性;hESC-MSCs通过诱导完成成骨、成脂和成软骨分化;hESCMSCs-Exo为粒径在40~100nm的囊泡,表达特异性的表面标志物CD9、CD63和CD81;体外促进HMEC-1的增殖和迁移。结论hESC-MSCs-Exo作为一种生物活性囊泡,能够促进血管内皮细胞的增殖和迁移;hESC-MSCs-Exo来源无限,可为临床组织损伤的修复治疗提供丰富的干细胞外泌体来源。
人胚胎干细胞源性间充质干细胞;外泌体;生物学特性
近年来,大量文献报道证实移植成体组织来源的间充质干细胞能够减轻缺血后的组织损伤并促进损伤组织的功能恢复[1-3]。然而,间充质干细胞在体外增殖能力有限,来源受限,且MSCs的生物学特性受供者机体状态影响较大,限制了其临床应用。而人胚胎干细胞(human embryonic stem cells,hESCs)不但可以分化为组织中所有类型的细胞,还具有无限扩增的特性,有望成为MSCs潜在的细胞来源。随着干细胞生物治疗研究的逐渐深入,研究者发现干细胞主要通过旁分泌机制发挥作用,其中外泌体(exosome)作为一种重要的旁分泌因子,近年受到广大研究者的青睐[4,5]。本实验通过将胚胎干细胞诱导成间充质干细胞(hESCMSCs),分析其外泌体(hESC-MSCs-Exo)的生物学特性,为组织损伤性疾病的干细胞生物治疗提供新来源。
1 材料与方法
1.1 材料、主要仪器和试剂实验所用的HMEC-1来源于本实验室冻存。细胞培养超净台:Thermo Fisher,美国;恒温CO2培养箱:Thermo,美国;透射电子显微镜:Hitachi公司,日本;化学发光成像分析仪(Image Quant LAS 4000mini):GE Healthcare,瑞典;Beckman超高速离心机:Beckman Coulter,美国;qNANO纳米粒子分析系统:Izon,新西兰;CD29-PE,CD34-APC,CD44-FITC,CD45-FITC,CD73-PE,CD90-PE,CD105-FITC,CD133-PE,CD146-PE,HLA-DR-PE(小鼠抗人流式抗体)(BD Biosciences,美国);Guava easyCyteTMsystem流式细胞仪(Millipore,美国);牛血清白蛋白(BSA)(Gibco,美国);成骨、成脂、成软骨诱导培养基(Gibco,美国);MSC无血清培养基(stemRD,美国);兔抗人CD9,CD63,CD81单克隆抗体(Abcam,英国);BCA试剂盒(Thermo Fisher,美国)。
1.2 hESC-MSCs的诱导分化以及hESC-MSCs-Exo的富集根据本实验室前期研究的方法,将已注册的未分化人类ESC H9细胞系通过一步法诱导成MSCs[6],并通过旋转超滤法提取外泌体并富集[7]。
1.3 hESC-MSCs表面标志物的鉴定将细胞装于1.5ml EP管中,4℃,2000r/min离心5min,去上清。加入1ml 1%BSA溶液吹散细胞并冰上静置30min封闭非特异性抗原。再次4℃,2000r/min离心5min,去上清,分别按要求加入各种流式抗体:CD29-PE、CD34-APC、CD44-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-FITC、CD133-PE、CD146-PE及HLA-DR-PE,冰上避光孵育45min,1%BSA清洗2遍后,按要求上样并使用Guava easyCyteTMsystem流式细胞仪检测。
1.4 hESC-MSCs三系分化5×104细胞接种于24孔板内,更换成骨诱导培养基,连续培养21d后4%多聚甲醛固定15min,清洗后加入适量茜素红溶液观察成骨分化;常规消化hESC-MSCs后,将细胞悬液转移至15ml离心管中,细胞数约1× 106,1000r/min离心5min,弃上清,加入3ml成软骨诱导培养基,连续培养21d后4%多聚甲醛固定,行OCT包埋制作冰冻切片,1%甲苯胺蓝染色后观察成软骨分化;5×104细胞接种于24孔板内,更换成脂诱导培养基,连续培养21d后4%多聚甲醛固定15min,加入适量油红O溶液,拍照记录。
1.5 透射电子显微镜观察hESC-MSCs-Exo形态吸取30μl的hESC-MSCs-Exo滴在2nm孔径的载样铜网正面,室温,静置3min,用滤纸轻轻从侧边吸干液体,随后滴加3%醋酸双氧铀,室温,2min,经室温下干燥后将铜网放置在样品室内,观察hESC-MSCs-Exo的形态和大小,拍照记录。
1.6 Izon qNano纳米粒子分析系统检测hESCMSCs-Exo参照产品使用说明,调整电压值0.58V,stretch调制46.2mm;加样孔中加入35μl过滤的PBS溶液,调整电流稳定于100~120mA之间;吸去PBS溶液,加入35μl:1000稀释的CPC100标准品,测得标准品中粒子数和粒子浓度;用PBS溶液清洗后,加入35μl 1:100稀释的hESC-MSCs-Exo样品,检测外泌体粒径和粒子浓度,重复测定3次,分析数据,导出分析报告和图片。
1.7 Western blotting检测hESC-MSCs-Exo特征性标志物的表达采用超声裂解法提取hESCMSCs-Exo内的蛋白质,通过BCA法测定蛋白浓度后,按常规电泳、转膜、封闭,加入一抗CD63(1:1000)、CD81(1:1000)、CD9(1:1000),与二抗杂交后,通过化学发光法观察,拍照并记录。
1.8 hESC-MSCs-Exo对HMEC-1的增殖的影响将HMEC-1接种到96孔板,细胞5000个/孔,细胞培养箱中静置培养12h后,加入培养基100μl,再加入1/10体积的CCK8,细胞培养箱内孵育3h后,于酶标仪在450nm波长处测量吸光度值,记做第0d。吸去孔内溶液,分别加入含有2×109/mlhESC-MSCs-Exo的无血清培养基(外泌体组)及无血清培养基(对照组)各100μl,细胞培养箱内继续培养细胞。第1、2、3、4、5d相同时间点分别进行CCK8测量,重复3次,绘制细胞的生长曲线。
1.9 hESC-MSCs-Exo对HMEC-1的迁移功能的影响将HMEC-1接种到12孔板内,密度为2× 105/孔,当细胞完全融合后,使用200μl枪头进行划痕。用PBS反复清洗3遍后,加入含2×109/ml hESC-MSCs-Exo的无血清培养基(外泌体组)及无血清培养基(对照组)。在划痕后0h、12、24h普通光学显微镜下拍照,使用Image J计算迁移率。
1.10统计学分析采用SPSS 17.0统计软件,数据以均值±标准差(x±s)表示;多组间均数比较采用单因素方差分析(one-way ANOVA),两组间均数比较采用两样本t检验。统计结果以P<0.05为差异有统计学意义。
2 结果
2.1 hESC-MSCs成功分化后表面标志物的表达流式细胞术检测细胞表面标志物,结果显示经诱导后的hESC-MSCs表达CD29、CD44、CD73、CD90、CD105、CD146,不表达CD34、CD45、CD133、HLA-DR(图1),这符合MSCs的特征。
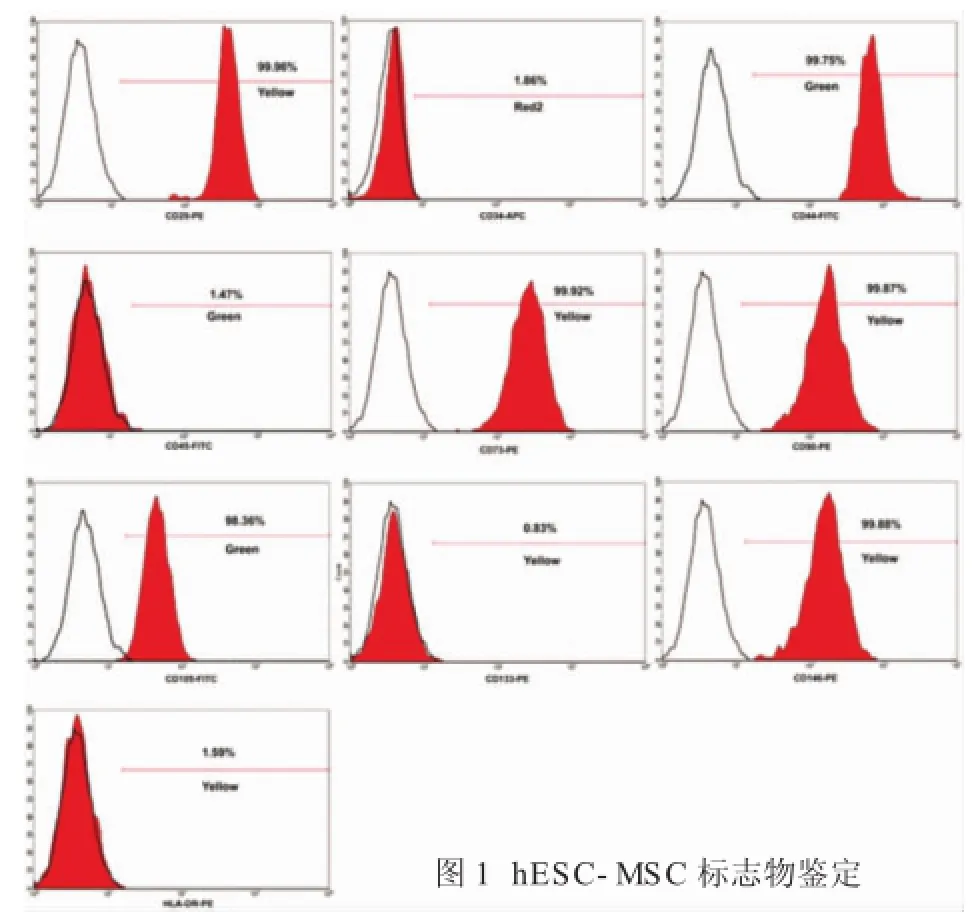
流式分析间充质干细胞表面阳性标志物CD29,CD44,CD73,CD90,CD105和CD146,以及阴性表面标志物CD34,CD45,CD133和HLA-DR;Western blot检测hESC-MSC-Exo标志物CD9,CD63,CD81。
2.2 hESC-MSCs成骨、成脂和成软骨分化成骨分化:hESC-MSCs经成骨诱导培养基诱导12d后可出现钙盐沉积,至成骨诱导20d后细胞周围可见大量钙盐沉积,细胞表面和周围经茜素红染色可见大量红色着色,表明hESC-MSCss可成骨分化(图2A);成软骨分化:hESC-MSCs经成软骨诱导培养基诱导20d后可见细胞聚集成球体状,经1%甲苯胺蓝染色后,形成的软骨基质被染成蓝色,表明hESC-MSCs可成软骨分化(图2C);成脂分化:hESC-MSCs经成脂诱导培养基诱导7d后可见逐渐增大的胞体,14d后胞浆内出现折光性强的脂肪小滴,并逐渐融合成大的脂肪滴,成脂诱导20d后细胞经油红O染色可见细胞内红色脂滴,表明hESC-MSCs可成脂分化,这些符合MSCs的特征(图2B)。

图2 h ESC-MSC三系分化能力鉴定
2.3 hESC-MSCs-Exo的鉴定经过超速离心结合旋转超滤后获得hESC-MSCs-Exo,透射电镜下观察到粒径约100nm的球形囊泡(图3A),qNANO纳米粒子分析系统显示外泌体粒径范围在40-100nm之间(图3B),与电镜结果相一致。同时,Western blotting结果显示,hESC-MSCs-Exo表达CD9、CD63和CD81蛋白标志物(图3C)。
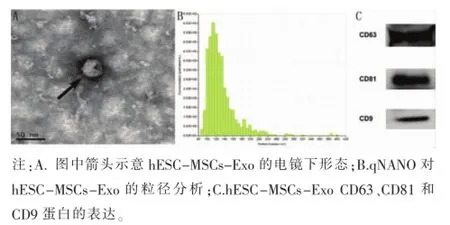
图3 hESC-MSCs-Exo的特征
2.4 hESC-MSCs-Exo对HMCE-1的增殖的影响对照组的HMCE-1增殖曲线较为平坦,表现出增殖缓慢,而hESC-MSCs-Exo组内的HMCE-1增殖曲线较为陡直,表现出增殖加快。在第2d后,各个时间点下hESC-MSCs-Exo组的吸光度值开始较对照组具有统计学意义(P<0.05)。结果表明hESCMSCs-Exo能够促进HMCE-1的增殖(图4)。
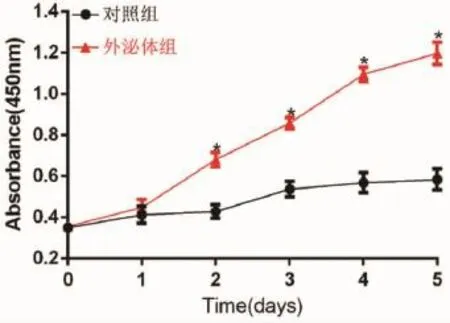
图4 h ESC-MSCs-Exo对HMCE-1的增殖活力的影响
2.5 hESC-MSCs-Exo对HMCE-1的迁移的影响培养12h后,无血清培养基组HMCE-1的迁移指数为0.208±0.029,加入外泌体题组中HMCE-1的迁移指数为0.467±0.039,差异具有统计统计学意义(P<0.05);培养24h后,无血清培养基组HMCE-1的迁移指数为0.413±0.035加入外泌体题组中HMCE-1的迁移指数0.773±0.041,差异具有统计统计学意义(P<0.05)(图5),表明hESC-MSCs-Exo能促进HMCE-1的迁移。
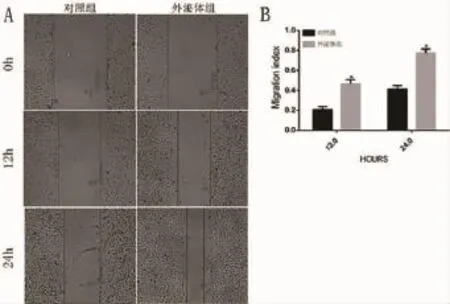
图5 h ESC-MSCs-Exo对HMCE-1迁移能力的影响
3 讨论
间充质干细胞(mesenchymalstem cells,MSCs)存在于多种组织器官当中[8,9],对组织损伤修复和疾病治疗具有良好的作用,无成瘤性[10],成为再生医学理想的种子细胞之一。然而,成体间充质干细胞来源受限,取材具有一定的创伤性,并且易受到机体状态的影响而具有一定的生物学差异,同时体外不能无限增殖,限制了其进一步的临床应用。人们发现,人胚胎干细胞(human embryonic stem cells,hESCs)能够无限扩增,具有向三胚层分化的能力,而成为最有潜力的种子细胞来源,然而成瘤性以及伦理宗教等是其面临的主要问题。研究者将人源ESCs定向诱导分化为间充质干细胞,即为hESC-MSCs,与成体MSCs相比,二者的生物学特性和功能比较相似,并具有很好的均一性,无致瘤性[11,12],来源充足。hESC-MSCs结合了ESCs和成体MSCs的优点,避免了各自的缺陷,为干细胞生物治疗提供了更广阔的前景。本实验将人胚胎干细胞H9细胞系成功诱导成间充质干细胞,并验证了其能够表达表面特性标志物分子以及成骨、成脂、成软骨分化。
然而,在无限传代过程中,有部分ESCs子代细胞可能会发生染色体缺失或突变,影响其来源的hESC-MSCs的核型稳定性;使hESC-MSCs存在核型变异的风险[13]。因此,发挥干细胞优越功能的同时,思考如何避免潜在的移植风险,成为我们新的探究方向。近年来,越来越多的研究发现干细胞主要通过旁分泌一些生长因子、细胞因子、趋化分子和细胞外囊泡,发挥促组织修复作用[14]。Chen L等研究发现,在体外心脏前体细胞来源的外泌体能够阻止缺氧诱导的心肌细胞凋亡,以及在心脏急性缺血再灌注小鼠模型中阻止心肌细胞的凋亡[15]。Bian S等人发现外泌体MSC-Exo具有与MSC相似的效果,在缺血性损伤中,促进血管新生保护心肌组织[16]。外泌体包裹大量的生物活性物质,如miRNA、mRNA、DNA和蛋白质等,广泛存在于各种组织细胞以及所有体液中;外泌体作为干细胞一个重要的旁分泌机制,在缺血性损伤中发挥主要的修复作用[17,18];其效果类似于来源干细胞移植修复损伤作用[17],因此干细胞来源的外泌体,日益受到研究者的重视。
在修复缺血性损伤过程中,恢复血流灌注发挥重要的作用,我们之前的研究发现,干细胞来源的外泌能够促进人微血管内皮细胞的增殖、迁移和成管,以此阐释了干细胞的血管新生作用[19]。本研究通过旋转超滤法,成功提取hESC-MSCs-Exo,检测其表达外泌体特异性CD63、CD81和CD9表面分子;并能够促进人微血管内皮细胞(human microvascular endothelial cells,HMEC-1)增殖和迁移,有望成为修复组织损伤的新型功能活性物质的丰富来源。
[1]Hou B,Ma J,Guo X,et al.Exogenous neural stem cells transplantation as a potential therapy for photothrombotic ischemia stroke in kunming mice model[J].Mol Neurobiol,2017,54(2):1254-1262.
[2]Zhu K,Li J,Wang Y,et al.Nanoparticles-assisted stem cell therapy for ischemic heart disease[J].Stem Cells Int,2016,2016:1384658.
[3]Shin JY,Yoon JK,Noh MK,et al.Enhancing therapeutic efficacy and reducing cell dosage in stem cell transplantation therapy for ischemic limb diseases by modifying the cell injection site[J].Tissue Eng Part A,2016,22(3-4):349-362.
[4]Ratajczak MZ,Jadczyk T,Pedziwiatr D,et al.New advances in stem cell research:practical implications for regenerative medicine [J].Pol Arch Med Wewn,2014,124:417-426.
[5]Thery C,Zitvogel L,Amigorena S.Exosomes:composition,biogenesis and function[J].Nat Rev Immunol,2002 Aug;2(8):569-579.
[6]胡国文,李青,牛鑫,等.人诱导多能干细胞定向分化为间充质干细胞的方法研究[J].上海交通大学学报(医学版),2014,34(10):1428-1434.
[7]胡国文,李青,牛鑫,等.旋转超滤:一种提取细胞外泌体的新方法[J].第二军医大学学报,2014,35(6):598-602.
[8]Wang S,Cheng H,Dai G,et al.Umbilical cord mesenchymal stem cell transplantation significantly improves neurological function in patients with sequelae of traumatic brain injury[J].Brain Res,2013,1532:76-84.
[9]Bao XJ,Liu FY,Lu S,et al.Transplantation of Flk-1+human bone marrow-derived mesenchymal stem cells promotes behavioral recovery and anti-infl ammatory and angiogenesis effects in an intracerebral hemorrhage rat model[J].Int J Mol Med,2013,31(5):1087-1096.
[10]Kita K,Gauglitz GG,Phan TT,et al.Isolation and characterization of mesenchymal stem cells from the sub-amniotic human umbilical cord lining membrane[J].Stem Cells Dev,2010,19(4):491-502.
[11]Kita K,Gauglitz GG,Phan TT,et al.Isolation and characterization of mesenchymal stem cells from the sub-amniotic human umbilical cord lining membrane[J].Stem Cells Dev,2010,19(4):491-502.
[12]Gruenloh W,Kambal A,Sondergaard C,et al.Characterization and in vivo testing of mesenchymal stem cells derived from human embryonic stem cells[J].Tissue Eng Part A,2011,17(11/12):1517-1525.
[13]Karagiannidou A,Varela I,Giannikou K,et al.Mesenchymal derivatives of genetically unstable human embryonic stem cells are maintained unstable but undergo senescence in culture as do bone marrow-derived mesenchymal stem cells[J].Cell Reprogram,2014,16(1):1-8.
[14]Kwon HM,Hur SM,Park KY,et al.Multiple paracrine factors secreted by mesenchymal stem cells contribute to angiogenesis[J]. Vasc Pharmacol,2014,63:19-28.
[15]Chen L,Wang Y,Pan Y,et al.Cardiac progenitor-derived exosomes protect ischemic myocardium from acute ischemia/reperfusion injury[J].Biochem Biophys Res Commun,2013,431(3):566-571.
[16]Bian S,Zhang L,Duan L,et al.Extracellular vesicles derived from human bone marrow mesenchymal stem cells promote angiogenesis in a rat myocardial infarction model[J].J Mol Med(Berl),2014,92 (4):387-397.
[17]Camussi G,Deregibus MC,Cantaluppi V.Role of stem-cell-derived microvesicles in the paracrine action of stem cells[J]. Biochem Soc Trans,2013,41:283-287.
[18]Caplan AI,Dennis JE.Mesenchymal stem cells as trophic mediators[J].Cell.Biochem,2006,98:1076-1084.
[19]Zhang JY,Chen CY,Hu B,et al.Exosomes derived from human endothelial progenitor cells accelerate cutaneous wound healing by promoting angiogenesis through erk1/2 signaling[J].Int J Biol Sci,2016,12:1472-1487.
Study on the biological characteristics of exosomes secreted by human-induced pluripotent stem cell-derived mesenchy-mal stem cells
ZHANG Guowei1,4,HU Guowen2,NIU Xin3,WANG Yang3,DENG Zhifeng4.1.Taishan Medical University,Shandong,271000;2.Department of Neurosurgery,the Sixth People's Hospital of Shanghai,Shanghai Jiaotong University School of Medicine,Shanghai 200233,China;3.Department of Neurosurgery of the Second Affiliated Hospital of Nanchang University,Nanchang 330006,China;4.Institute of Microsurgery on Extremities,Shanghai Jiaotong University Affiliated Sixth People’s Hospital,Shanghai 200233,China.
Objective To investigate the biological characteristics of exosomes secreted by human embryonic stem cell-derived mesenchymal stem cells(hESC-MSCs-Exo).Method The registered undifferentiated human ESC H9 cell line was induced into mesenchymal stem cells(MSCs)in a modified one-step method.Exosomes were collected by ultracentrifugation from the culture medium of hESC-MSCs.The mesenchymal stem cells were identified by flow cytometry.The morphology and size of the exosomes were observed by transmission electron microscopy(TEM)and Izon qNano nanoparticles.Western blotting was used to identify the exosome.The effects of hESC-MSCs-Exo on the proliferation and migration of human microvascular endothelial cells (HMEC-1)were observed.Result hESC H9 cell line was efficiently induced into hESC-MSCs,and hESC-MSCs-Exo were collected and identified.hESC-MSCs were verified by positive markers for CD34,CD40,CD90,CD105,CD146,CD44 antigens,and negative markers for CD34,CD133,CD45 and HLA-DR-PE.And hESC-MSCs own the osteogenesis,chondrogenesis,and adipogenesis multi-differentiation potential.hESC-MSCs-Exo is a vesicle with a diameter of 40-100nm,which expresses specific surface markers CD9,CD63 and CD81,and promotes the proliferation and migration of HMEC-1 in vitro.Conclusion hESC-MSCs-Exo,as a bioactive vesicle,can promote vascular endothelial cells proliferation and migration and has a wide range of sources for the treatment of tissue damage.
Human embryonic stem cell derived mesenchymal stem cells;Exosomes;Biological characteristics
R329.2+8,R446.62
A
1674-1129(2017)02-0143-05
10.3969/j.issn.1674-1129.2017.02.003
2017-03-17;
2017-03-22)
国家自然科学基金资助项目,编号81471243
张国威,男,1989年生,硕士研究生,研究方向:主要从事干细胞与损伤修复研究。E-mail:zgwei1989@qq.com
邓志锋,男,1963年生,博士,教授,博士生导师,研究方向:干细胞与中枢系统再生修复。E-mail:dengzf63@126.com
