标本因素及保存条件对HCV RNA检测的影响
2017-04-20庄养林熊丽红张鹏飞王芳陈丹施桥发
庄养林,熊丽红,张鹏飞,王芳,陈丹,施桥发
(1、南昌大学医学院,江西南昌330006;2、江西省血液中心,江西南昌330077;3、江西省职业病防治研究院,江西南昌330006)
标本因素及保存条件对HCV RNA检测的影响
庄养林1,2,熊丽红2,张鹏飞2,王芳2,陈丹3,施桥发1
(1、南昌大学医学院,江西南昌330006;2、江西省血液中心,江西南昌330077;3、江西省职业病防治研究院,江西南昌330006)
目的探讨溶血、脂肪血、保存温度和保存时间对HCV RNA检测的影响,确认用于核酸检测的标本正确采集、处理及保存的关键控制点。方法应用实时荧光PCR法,采用混样检测+单检的检测模式,对在不同浓度的血红蛋白或甘油三脂下以及在不同温度条件下保存不同时间后的HCV RNA标本进行检测,对检测的Ct值进行分析。结果小于7.93mmol/L的不同浓度甘油三脂对HCV RNA检测没有影响(P>0.05),血红蛋白浓度为97g/L、34g/L、17g/L以及8g/L时,其对HCV RNA检测均有影响(P<0.05),当血红蛋白浓度小于5g/L时,其对HCV RNA检测均无影响(P>0.05);保存温度在-30℃下4周内,其检测Ct值差异均无统计学意义(P>0.05)。在低于37℃条件下,4h内保存的HCV RNA标本检测Ct值差异均无统计学意义(P>0.05)。在4℃的条件下保存72h内,HCV RNA标本检测Ct值差异无统计学意义(P>0.05),25℃的条件下能保存48h(P>0.05)。结论甘油三脂浓度小于7.93mmol/L对HCV RNA的检测没有影响,血红蛋白浓度大于8g/L时会影响HCV RNA的检测,用于HCV RNA检测的标本在4℃保存时最好在72h内完成检测。
核酸检测技术;Ct值;溶血;脂肪血;保存条件
核酸检测(nucleic acidtest,NAT)技术因其灵敏度高,其缩短病毒检测的“窗口期”远大于血清学方法,我国采供血机构已将血液部分或全部进行核酸检测。然而在核酸检测工作中,标本的质量,如标本的溶血、脂肪血等因素及运输、保存条件如何会直接关系到检测结果的准确性。国外较早的研究表明,血红蛋白可通过其卟啉环与Taq酶的不可逆结合而抑制Taq酶活性,从而影响PCR测定[1]。此外,检测标本中的核酸降解同样也是影响核酸检测的重要因素。细胞破碎时,RNA酶释放出来则会降解RNA,影响检测的灵敏度。国外有报道,受标本保存方式的影响,可使病毒核酸检测结果的阳性率偏低,因此,如果标本的采集、处理、保存不当,就会造成病毒核酸的降解,进而影响NAT检测本身的灵敏度,造成检测结果不准确,给血液安全带来潜在的风险。所以确认用于NAT检测的标本正确采集、处理及保存的关键控制点,进而确保本地区高效、高质量地完成NAT检测工作,降低HBV、HCV、HIV经血传播风险显得尤为重要。本文对含HCV RNA的标本模拟采集、运输、处理以及检测、保存的全过程,探讨溶血、脂肪血、保存温度和保存时间对HCV RNA检测的影响。
1 对象与方法
1.1标本的收集与处理收集2016年1月1日-2016年9月30日江西省血液中心献血者经血清学检测HBsAg、抗-HCV、抗-HIV均为阴性以及NAT检测均为阴性的透亮血浆标本。收集上述时间段内的HCV RNA检测阳性的血浆,制备12~30倍检出限(LOD)浓度的HCV RNA标本,分别放置于4℃、25℃、37℃、-30℃环境下进行保存(各5份),4h、1d、2d、3d、1周、4周后对所有标本进行NAT检测(其中37℃组考虑到细菌污染等问题保存4周不纳入研究)。
收集上述时间段内血清学及NAT检测均为阴性的严重乳糜血浆、红细胞悬液。将收集的红细胞悬液放置-80℃制成全溶血样本,经3000g,15min离心,取上层液体,加入血清学及NAT检测均为阴性的透亮血浆标本分别制成倍比稀释的溶血样本(1:1至1:32稀释共6组溶血样本)。将收集的严重乳糜血浆样本,经3000g,15min离心,取上层液体,加入血清学及NAT检测均为阴性的透亮血浆标本分别制成倍比稀释的脂肪血标本(1:1至1:8稀释共4组脂肪血样本)。
1.2主要仪器美国罗氏公司Cobas s 201核酸检测系统,瑞士Hamlton全自动STAR加样仪,迈瑞全自动细胞分析仪BC-3000Plus,贝克曼库尔特全自动生化分析仪AU680,长沙湘麓DL-6M大容量低温离心机。
1.3主要试剂核酸检测试剂盒:COBAS
1.4.2混样标本血红蛋白及甘油三脂浓度的测定由倍比稀释的脂肪血或溶血标本制成混样标本的甘油三脂及血红蛋白浓度的测定分别采用甘油磷酸氧化酶法和氰化高铁血红蛋白(HiCN)测定法在贝克曼库尔特全自动生化分析仪AU680、迈瑞全自动细胞分析仪BC-3000Plus上进行检测。
1.5统计学方法运用SSPS软件对数据进行分析,组间比较采用方差分析,P<0.05差异有统计学意义。两组数据间比较采用t检验,P<0.05差异有统计学意义。TaqScreen MPX V2.0 test核酸检测试剂盒(瑞士Roche公司,批号:210761、215155),甘油三脂试剂盒(上海科华,批号:20160812),血细胞分析用溶血剂(迈瑞南京生物技术有限公司,批号:2016080808)。
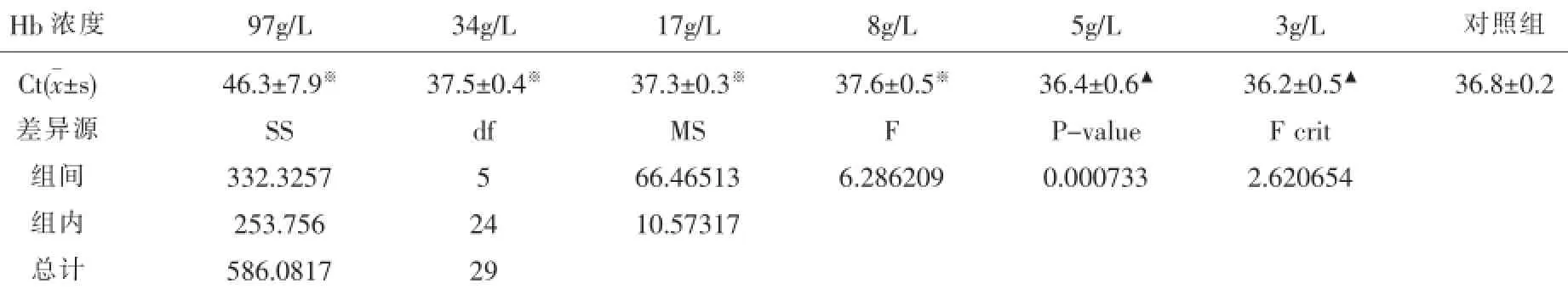
表1 血红蛋白对HCV RNA检测影响结果
1.4实验方法
1.4.1含HCV RNA的不同保存条件、溶血及脂肪血的标本的核酸检测将不同温度下保存的12~30倍LOD HCV RNA的标本保存一定时间后进行核酸检测,检测模式为混样检测+单检。先将5份经核酸检测为合格的透亮血浆标本与上述每组制备的标本(167μl/份)汇集为1份混样标本(1ml),在Cobas s 201全自动核酸提取、扩增检测平台进行混样、提取、扩增和检测:⑴如混样标本结果无Ct值,则该核酸检测结果为阴性,表示该份标本HCV RNA未检出,下一步该标本单独进行核酸检测(取1ml),如单独检测结果无Ct值表示该标本HCV RNA未检出,如单独检测结果检出Ct值表示该标本HCV RNA阳性;⑵如混样标本结果检出Ct值,则表示该标本HCV RNA阳性。
将制备的1份倍比稀释的溶血或脂肪血标本和1份12~30倍LOD HCV RNA与4份经核酸检测合格的透亮血浆标本汇集为1份混样标本(1ml),在Cobas s 201全自动核酸提取、扩增检测平台进行混样、提取、扩增和检测:⑴如混样标本结果无Ct值,则该核酸检测结果为阴性,表示该份标本HCV RNA未检出;⑵如混样标本结果检出Ct值,则表示该标本HCV RNA阳性。

表2 甘油三脂对HCV RNA检测影响结果
2 结果
2.1血红蛋白组NAT检测结果血红蛋白对HCV RNA检测影响见表1。
2.2甘油三脂组NAT检测结果甘油三脂对HCV RNA检测影响见表2。
2.3不同保存条件组NAT检测结果保存时间和保存温度对HCV RNA检测影响见表3。
3 讨论
本文旨在确认用于NAT检测的标本正确采集、处理及保存的关键控制点,进而确保本地区高效、高质量地完成NAT检测工作,降低HBV、HCV、HIV经血传播风险。本结果显示,保存温度在-30℃下4周内,其检测Ct值差异均无统计学意义(P>0.05)。在低于37℃环境下,4h内保存的HCV RNA标本检测Ct值差异均无统计学意义(P>0.05)。国内外有研究报道显示,HCV RNA标本在-20℃保存保存1~7d检测结果无差异[2],甚至能保存1年[3]。我们的研究和上述的研究一致,因此在实际工作中,如不能及时完成HCV RNA的检测工作,将标本血浆短时冻存在-30℃是可行的。
在保存温度为4℃的条件下,我们的研究显示保存72h内,HCV RNA标本检测Ct值差异均无统计学意义,但在保存1~4周后,其检测Ct值明显增大,这与HCV RNA开始出现降解导致HCV RNA浓度下降有关,我们的结果与Gesson G等[4]发现HCV RNA血浆标本放置1周后下降0.467Log以及陆应玉[5]等发现4℃贮存2周后HCV RNA平均阳性率检出下降至35%一致。姚凤兰等[6]的研究也发现9份弱阳性HCV RNA标本在4℃7d内保存,HCV RNA的含量没有显著的变化,但在保存2d后其浓度有下降的趋势。所以,在日常HCV RNA检测工作中,在采血后72h内,应尽早完成检测工作[7],以免HCV RNA在4℃冰箱长时间保存过程中出现降解的风险。另外我们还发现,在常温25℃环境下,HCV RNA标本在保存48h后即出现降解的情况,在保存4周后甚至出现完全检测不出HCV RNA,这与国外的Trabaud MA等[8]发现室温放置3d,HCV RNA下降0.5Log以及国内刘长利[9]等研究发现的25℃保存48h病毒含量下降至原滴度的72.5%的研究一致。这也提醒我们工作人员,在采集检测标本后应及时将标本放置4℃冰箱保存,减少HCV RNA降解的风险。
在溶血实验的研究中,我们发现血红蛋白浓度在5g/L以下时,HCV RNA检测的情况没有受到影响,但在血红蛋白浓度在高于8g/L时,会出现HCV RNA检测受影响的情况,李金明[10]的研究也发现了血红蛋白影响核酸检测的情况。这是因为尽管目前核酸检测试剂中加入有蛋白酶,但是对高浓度血红蛋白去除有限,血红蛋白仍然可通过卟啉环与Taq酶不可逆结合而抑制Taq酶活性,最终影响核酸检测。通过本次研究,我们确认了用于HCV RNA检测的标本接收标准,即标本出现溶血现象时,其血浆血红蛋白高于8g/L应拒收此份标本,要求送检人员重新留取检测样本,拒收时可通过将8g/L的血红蛋白标准样本拍照作为比对标准。
脂血标本浑浊主要是血液中的低密度脂肪(乳糜微粒等)增多引起的,而人体血浆中乳糜微粒84%~88%是TG,有研究[11]认为血脂中的乳糜微粒能同光散射而导致的荧光淬灭作用使荧光信号强度降低,降低了扩增效率,然而,在本结果中,高浓度的TG并没有影响HCV RNA的检测,因此我们认为高血脂的标本原则可以接收,因为本实验室HCV RNA检测的模式为6混样模式,即使是高浓度的血脂标本,在最终进入提取扩增阶段,TG浓度已经被稀释了6倍,影响HCV RNA检测的可能性很小,但要注意的是,在进行混样时,此份高浓度的标本最好与5份透亮的血浆标本进行混样。
综上所述,我们确认了用于本实验室核酸检测的标本正确采集、处理以及保存的关键控制点:高血脂标本可以接收,但在检测时,此份标本应与无脂血标本进行混样。溶血标本在高于8g/L时应通知送检人员重新留取样本。在采血后72h内应尽早完成检测工作,若在采血后不能及时送检标本,应将标本分离出血浆-30℃保存,再进行送检。标本解冻后也应在72h内完成检查工作。由于本次的标本浓度比较低,而且样本数较少,因此可能会有个别实验数据有一定的偏差。
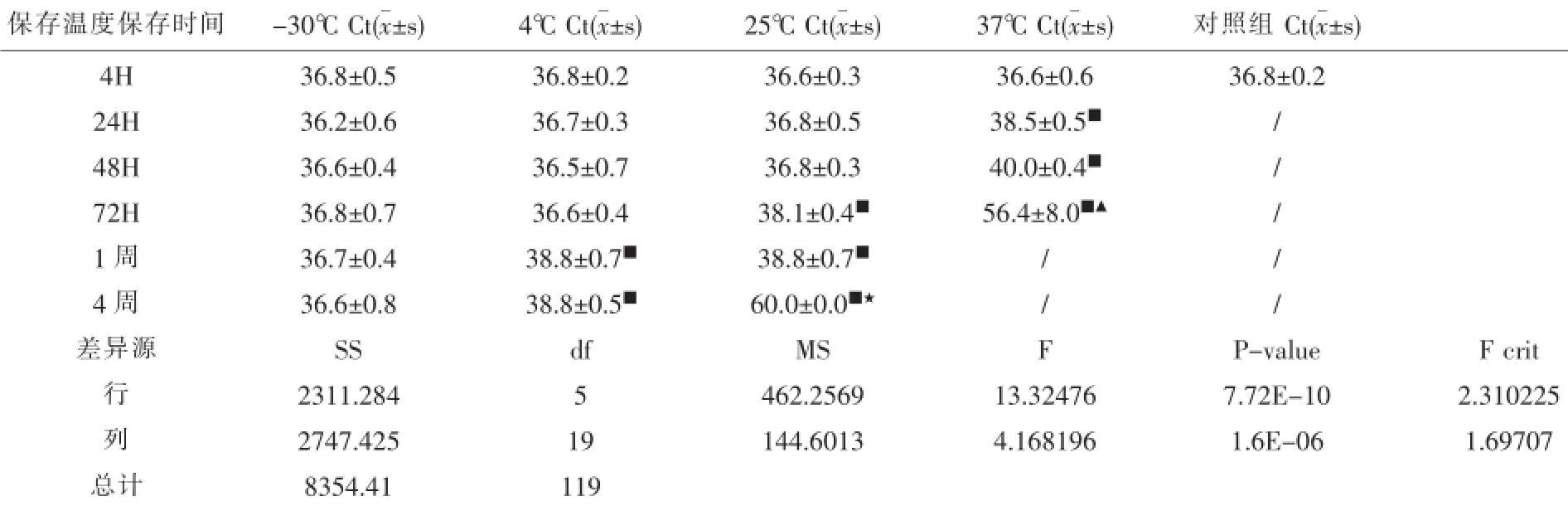
表3 保存时间和保存温度对HCV RNA检测影响
[1]MM3-A.Moleular diagnostic metholds for infectious diseases:approced guildline[S].NCCLS,1995,15(22):32-33.[2]陈勇,周华蓉.不同保存条件对血清荧光定量HCV RNA检测的影响[J].分子诊断与治疗杂志,2009,1(4):245-247.
[3]Baleriola C,Johal H,Jacka B,et al.Stability of hepatitis C virus,HIV,and hepatitis B virus nucleic acids in plasma samples after long-term storage at-20°C and-70°C[J].J Clin Microbiol,2011,49(9):3163-3167.
[4]Gessoni G,Barin P,Frigato A,et al.The stability of hepatitis C virus RNA after storage at+4 degrees C[J].J Viral Hepat,2000,7 (4):283-286.
[5]陆应玉,李京培.逆转录聚合酶链反应检测HCV RNA血标本保存条件分析[J].安徽医科大学学报,2000,35(3):202-204.
[6]姚凤兰,陈瑜,汪德海,等.标本保存温度、时间和不同采血管对核酸检测结果的影响[J].中国输血杂志,2012,25(6):530-533.
[7]卫生部.血站技术操作规程[M].2015:23.
[8]Trabaud MA,Bailly F,Colucci G,et al.Stability of hepatitis C virus RNA in serum from samples collected in a closed-tube system for serum separation and transport,as measured by a quantitative competitive PCR assay[J].J Viral Hepat,1996,3(4):207-209.
[9]刘长利,任芙蓉,吕秋霜,等.不同处理和保存条件下体外HCV RNA稳定性研究[J].中国实验血液学杂志,2006,14(6):1238-1243.
[10]李金明,王露楠.标本处理对聚合酶链反应测定乙肝病毒核酸的影响[J].中华检验医学杂志,2000,23(6):337-339.
[11]尹琦,徐玉婵.影响HBV DNA测定的标本因素[J].临床检验杂志,2008,26(2):133-134.
Q522,R512.91
A
1674-1129(2017)02-0228-03
10.3969/j.issn.1674-1129.2017.02.028
2016-12-21;
2017-03-21)
江西省卫生计生委科技计划项目,编号:20165521
