一种制作骨髓染色体G带的改良方法
2017-04-20唐永华程建兵
唐永华,程建兵
(1、深圳市光明新区人民医院,广东深圳518106;2、杭州艾迪康医学检验中心有限公司,浙江杭州310023)
一种制作骨髓染色体G带的改良方法
唐永华1,程建兵2
(1、深圳市光明新区人民医院,广东深圳518106;2、杭州艾迪康医学检验中心有限公司,浙江杭州310023)
目的建立一种具有分裂相多、分散度好、带纹清晰、长度适中等特征的骨髓染色体G带制作方法。方法在含9. 6%胎牛血清的RPMI1640培养基中加入一定量的人淋巴瘤细胞系培养物,接种骨髓细胞后培养24h,然后加入终浓度为30μg/ml的溴化乙锭和0.06μg/ml的秋水仙胺作用1h。结果通过方法改良,骨髓标本培养成功率约为传统方法的1.59倍,异常染色体检出率比传统方法提高了51%。结论改良后的方法可以制作出个数更多、分散度更加良好、带纹更加清晰、染色体更长的中期分裂相,因而异常染色体检出率更高,诊断结果更加可靠。
骨髓染色体;G带;溴化乙锭
近年来,随着分子生物学与细胞遗传学的发展,骨髓染色体核型分析在血液系统疾病的诊断、治疗和预后中发挥了越来越重要的作用。由于骨髓中含有大量的脂肪颗粒,且各种细胞系的细胞周期不固定,不统一,因而传统培养骨髓的方法(在含一定量胎牛血清的RPMI1640中接种骨髓细胞培养24h,终止培养前加入一定量的秋水仙素)制备出的染色体G带往往出现染色体分裂指数低,染色体短粗,分散度差等缺点,从而导致可分析的分裂相少,异常检出率低,诊断结果不可靠。因此,建立一种具有分裂相多、分散度好、带纹清晰、长度适中等特征的骨髓G带制作方法尤为重要。
1 材料与方法
1.1 材料
1.1.1 标本来源随机选取2000例来自全国各地多加医院(温州医科大学附属第一医院400例、台州医学院300例、德阳市人民医院300例、三明市第一医院200例、武汉市第一医院400例、安徽省第二人民医院400例)的骨髓标本进行实验。骨髓标本要求使用专用肝素钠抗凝管,无溶血、无凝血、未经过高温和冷冻且无污染的合格标本。
1.1.2 主要试剂RPMI1640培养基、溴化乙锭、秋水仙胺、胰酶、Giemsa染液均购自Sigma公司,胎牛血清(FBS)购自Gibco公司,青霉素和链霉素的混合物购自Hyclone公司。
1.2 方法
1.2.1 改良骨髓培养基配制
1.2.1.1 人淋巴瘤细胞培养物的制取利用含9.6% FBS的RPMI1640培养基,37℃,5%CO2培养人淋巴瘤细胞。当细胞密度达到大约50%融合率时,更换培养基,至终浓度40ml左右。当培养基颜色变为黄色时准备收集。用血清移液管将培养好的细胞转入50ml圆底聚丙乙烯离心管中,2000r/min离心10min。收集上清液,并经0.22μm无菌滤器过滤,即为人淋巴瘤细胞培养物[1]。
1.2.1.2 骨髓培养基配方见表1。

表1 骨髓培养基配方
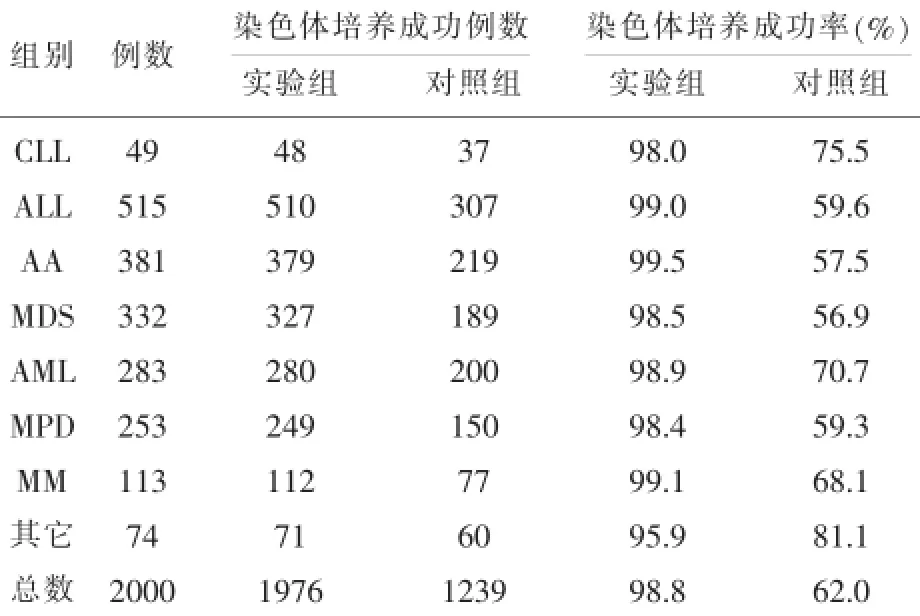
表2 超过20个良好分裂相的病例数比较结果
1.2.2 培养、收获及染色标本接种后37℃,5%CO2培养24h,终止培养前1h加入50μl浓度为3mg/ml的溴化乙锭和25μl浓度为12μg/ml的秋水仙胺。离心后收集细胞,加入8ml 0.075M KCl 37℃水浴箱低渗15min。预固定后,吸取上清液,将沉淀涡旋混匀后加入8ml新鲜固定液(甲醇:冰醋酸=3:1),室温静置30min。重复固定3次后将悬液调整为适宜浓度,滴片后放入80℃烤箱1h,室温放置一段时间后进行常规Giemsa染色[2~6]。
1.2.3 统计学方法采用SPSS 17.0软件进行数据处理,用t检验对计量资料进行统计学分析。P<0.05为差异有统计学意义。
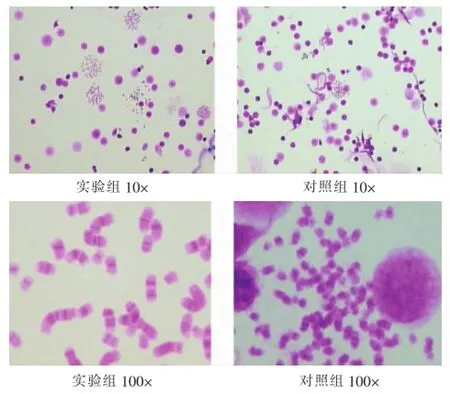
图1 实验组与对照组在染色体分裂相个数和分散度方面的比较
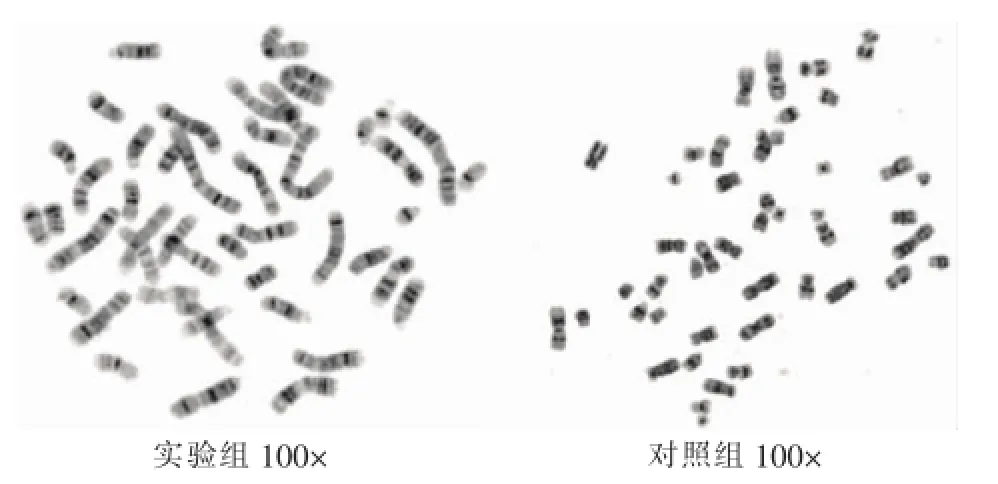
图2 实验组与对照组在染色体长度方面的比较
2 结果
2.1 骨髓培养成功率对比实验实验组与对照组各做两张G带片,同一样本由同一人观察计数良好分裂相个数(即带纹清晰可辨、染色体个数齐全且比较分散而不影响诊断)。良好分裂相个数≥20个,认为此骨髓标本培养成功[7,8]。如表2和图1所示结果:实验组镜下(采用OLYMPUS显微镜,型号BX43,JVC彩色摄像机型号TK-C9201EC)观察能达到20个以上良好分裂相的样本数均高于对照组,约为对照组的1.59倍,且无论在何种疾病检测中骨髓培养成功率均好于对照组。采用SPSS 17.0软件进行数据处理,用t检验对计量资料进行统计学分析。P=0.026,差异有统计学意义。
2.2 带纹及染色体长度对比实验由于8号染色体变异较小,长度适中,因而利用Leica自动扫描显微镜和图像分析系统分别对同一标本两种不同方法所得的8号染色体进行相对长度的测量。常规方法8号染色体平均长度为34.12mm,改良方法8号染色体平均长度为46.33mm,两者存在明显差异[9]。如图2所示镜检结果:实验组中染色体带纹更加清晰可辨,且染色体更长,更有利于异常染色体的检出。
2.3 异常染色体检出对比实验应用G显带技术进行常规细胞遗传学(CC)核型分析,核型异常按《人类细胞遗传学国际命名体制(ISCN2009)》进行描述。至少2个细胞有同样的染色体增加或结构重排,或者3个细胞有同样的染色体丢失,方可确认为一个异常克隆[10-16]。将以上病人的染色体核型分析结果进行统计,实验组异常染色体例数为1741,对照组异常染色体例数为1154例,如表3所示结果,实验组异常核型检出率约为对照组的1.51倍,且无论在何种疾病的检测中,均高于对照组。采用SPSS 17.0软件进行数据处理,用t检验对计量资料进行统计学分析。P=0.004,差异有统计学意义。
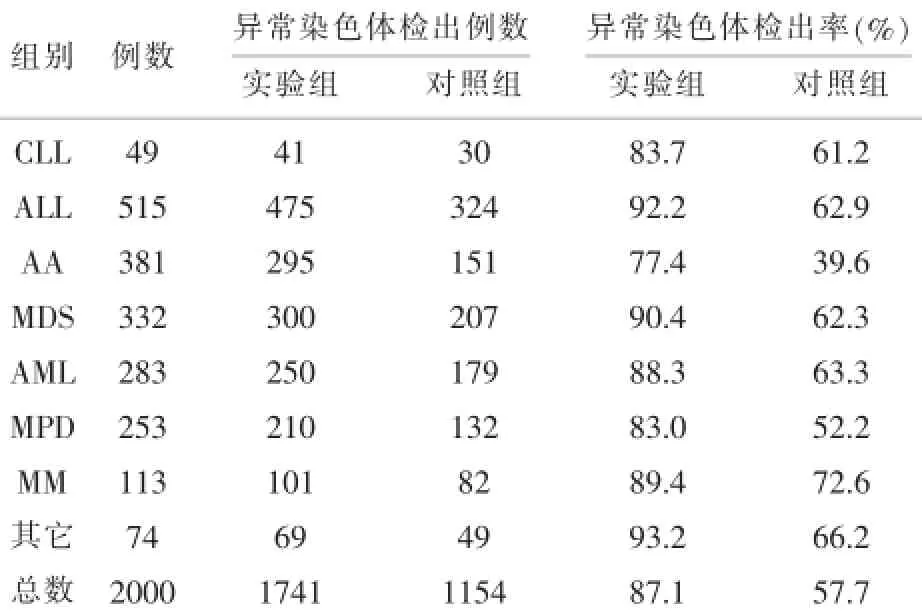
表3 染色体异常检出率的比较
3 讨论
骨髓染色体核型分析在恶性血液病的诊断、治疗及预后方面发挥着重要的作用。据统计,约有80%~85%的白血病患者存在染色体核型异常。染色体异常的检出不仅靠检验技术人员的丰富经验,而且与骨髓染色体标本制备技术有着直接的关系。标本制备得好可以获得数量多和质量好的染色体中期分裂相,有利于技术人员分析并提高染色体异常检出率。
传统的骨髓染色体培养无非是在含一定量胎牛血清的RPMI1640中接入一定量的骨髓细胞培养24h,然后通过秋水仙素浓度、作用时间、低渗时间等因素的优化以达到获得较多良好分裂相的目的。而本实验室在长期实验的基础上,为了获得良好的中期分裂相,主要做了以下改进:⑴在常规骨髓培养基中加入了人淋巴瘤细胞培养物。由于人淋巴瘤细胞培养物能分泌促增殖作用的生长因子并提供了其它营养物质,因而骨髓细胞培养后分裂相形态更加良好,数量也有所增加[1]。⑵终止培养时使用了溴化乙锭和秋水仙胺。溴化乙锭是一种菲锭类染料,可以无选择地嵌入DNA和RNA中,使染色体带纹更为清淅。另一方面,它是一种染色体收缩抑制剂,可阻止染色体的完全螺旋化和收缩变短而使染色体伸长。此外,秋水仙胺是秋水仙素的衍生物,毒性比秋水仙素更小,减少了对骨髓细胞的损害。因而,获得的中期分裂相更多、分散度更好、长度更长且带纹更加清晰。由于制取的G带稳定性更好,因而使用不同的显微镜均能观查到良好的分裂相,异常染色体检出率更高,诊断结果更加可靠。对各种不同的疾病患者的骨髓染色体进行染色,效果均优于现有方法。利于预后危险程度划分,在白血病诊断、治疗及预后判断中具有重要的临床意义。与此同时,实验过程中我们也发现改进后的方法在培养淋巴瘤疾病的骨髓细胞方面效果并不明显,培养成功率及染色体异常检出率仍然较低。在后续检测过程中,需要进一步的研究总结。
[1]Ohno H,Fukuhara S,Arita Y,et al.Establishment of a peripheral T-cell lymphoma cell line showing amplification of the c-myc oncogene[J].Cancer Res,1988,48:4959-4963.
[2]王冬梅,徐卫,董华洁,等.CpG寡脱氧核苷酸联合IL-2刺激慢性淋巴细胞白血病细胞的细胞遗传学研究[J].中国实验血液学杂志,2010,18(5):1114-1118.
[3]潘梅,张小琼,胡正,等.白血病患儿的骨髓染色体核型分析[J].江苏医药,2013,39(18):2140-2142.
[4]毛建平,赵利东,汪海清.恶性血液病患者313例染色体核型分析及临床意义[J].现代医药卫生,2014,30(24):3697-3699.
[5]韩乐乐,吴春梅.骨髓增生异常综合征142例染色体核型分析[J].青岛大学医学院学报,2014,50(3):227-229.
[6]张秀秀.基于骨髓细胞染色体核型分析在恶性血液病中的应用研究[J].中外医学研究,2015,13(11):79-80.
[7]Bi W,Borgan C,Pursley AN,et al.Comparison of chromosome analysis and chromosomal microarray analysis:what is the value of chromosome analysis in today’s genomic array era[J].Genet Med,2013,15(6):450-457.
[8]Shekhar S,Sahoo AK,Dalai N,et al.Chromosome analysis of arsenic affected cattle[J].Veterinary World,2014,7(10):859-862.
[9]林俊生,涂向东,张宝珍.用溴化乙锭改良脐带血染色体制备方法[J].中国优生与遗传杂志,2006,14(8):46-47.
[10]郭晓红,翟晓文,钱晓文,等.163例儿童急性淋巴细胞白血病细胞遗传学特征[J].中国实验血液学杂志,2015,23(2):312-317.
[11]Beheshti B,Braude I,Marrano P,et al.Chromosomal Localization of DNA Amplifications in Neuroblastoma Tumors Using cDNA Microarray Comparative Genomic Hybridization[J].Neoplasia,2003,5 (1):53-62.
[12]Rondón-Lagos M,Rangel N,Di Cantogno LV,et al.Effect of low doses of estradiol and tamoxifen on breast cancer cell karyotypes [J].Endocrine-Related Cancer,2016,23,635-650.
[13]Niederwieser C,Nicolet D,Carroll AJ,et al.Chromosome abnormalities at onset of complete remission are associated with worse outcome in patients with acute myeloid leukemia and an abnormal karyotype at diagnosis:CALGB 8461(Alliance r)[J].Haematologica,2016,101:1-20.
[14]张鹏宇,张龙进,罗静,等.染色体短期培养法的改良及在白血病患者染色体核型分析中的应用[J].西安交通大学学报(医学版),2016,37(6):288-291.
[15]吴敏华,容伯芬,陈妙婵.慢性粒细胞白血病骨髓染色体核型异常的结果分析[J].实验与检验医学,2011,29(1):87.
[16]刘小宁,李元媛,甘宜敏,等.急性早幼粒细胞白血病PML/ RARA融合基因检测的临床意义[J].实验与检验医学,2016,34(2):140-142.
The improved technique of bone marrow chromosome G-banding
TANG Yonghua1,CHENG Jianbing2.1.Shenzhen Guangming New District People’s Hospital,Shenzhen Guangdong 518106,China;Hangzhou Adicon Clinical Laboratories,INC,Hangzhou Zhejiang 310023,China.
Objective To build a method for bone marrow chromosome G-banding with more and better metaphase chromosomes.Methods Some culture from human lymphocyte carcinoma cell line was added into the traditional bone marrow medium,then the marrow cells were cultured about 24h.At the second day,30μg/ml ethidium bromide and 0.06μg/ml colcemid at the final concentration were added into the above medium and incubated about 1h prior to cell harvest.Results The rate of successful chromosome preparation were about 1.59 times the rate of control and the detection rate of chromosome aberrations were improved 51%.Conclusion By the improved methods,better metaphase chromosomes could be obtained to be analyzed easily,so the diagnosis would be more exactly.
Bone marrow chromosome;G-banding;Ethidium bromide
R446.8
A
1674-1129(2017)02-0193-03
10.3969/j.issn.1674-1129.2017.02.017
2016-07-05;
2017-02-15)
唐永华,男,1977年生,主管检验师,主要从事医学基础研究,Email:tyh1024@sina.com
程建兵,男,1982年生,硕士学位,检验技师,主要从事恶性血液病的研究,Email:chengjianbing2979@163.com
