合并COPD心衰患者比索洛尔的应用*
2017-04-20李艳刘宇
李 艳 刘 宇
(阳谷县人民医院老年医学科,山东 阳谷 252300)
合并COPD心衰患者比索洛尔的应用*
李 艳 刘 宇
(阳谷县人民医院老年医学科,山东 阳谷 252300)
目的 观察合并COPD心衰患者应用比索洛尔对COPD急性发作、肺功能的影响。方法 两组患者分别给予比索洛尔和对照组,并逐渐加量达最大耐受量或目标剂量。测量其肺功能及心电图和BNP。观察组间差异。结果 共纳入100例患者,随机分为比索洛尔组和对照组,观察3个月,比索洛尔组达目标剂量的是32例,6例在随访期间出现不良反应。第一秒用力呼气量在比索洛尔组明显增加(1561±414 ml vs1698±519 ml,P=0.046),但在对照组差异无统计学意义(1532±421 ml vs 1508±417 ml,P=0.346)。比索洛尔明显的降低了心率(75±14 vs 68±10,P=0.007)。两组BNP差异无统计学意义。随访2年,两组急性发作的次数比索洛尔组少于对照组 (2.14±0.58 vs 2.67±0.571,P<0.05)。结论 合并COPD的心衰患者可以耐受比索洛尔,且比索洛尔可改善肺功能,在COPD稳定期应用是安全的。
心衰;COPD;比索洛尔;肺功能
近年来,共患病受到了更多的关注和研究,特别是心衰患者合并症更多[1-2]。Landmark的随机试验奠定了β受体阻滞剂在心衰治疗中的主导地位[3]。但在临床实践中,多种合并症限制了β受体阻滞剂的应用。在心衰患者中大约有1/3的患者合并COPD,在COPD急性期β受体阻滞剂是禁用的[4]。主要是β受体阻滞剂加重了气管的痉挛,从而有可能加重呼吸困难,从而使病情难以控制。但不同制剂的β受体阻滞剂作用的受体不同,而对气管的影响也不同[4]。为了研究的安全性,大多数关于心衰治疗的研究把COPD患者排除在外[6]。也有少量的临床试验是关于β受体阻滞剂在COPD患者的安全性和有效性[7],目前很少有关于β受体阻滞剂对COPD患者肺功能和急性发作影响的研究,且结论不一致[8-9]。针对合并COPD的心衰患者β受体阻滞剂的应用没有前瞻性的研究,在我们的随机研究中观察了比索洛尔对COPD急性发作和肺功能的影响。
1 资料与方法
1.1 研究对象
病例来源于自2013年1月至2015年1月在我院住院的患者,纳入标准:①心功能Ⅱ~Ⅲ级(纽约心功能分级)的患者;②合并慢性阻塞性肺疾病患者;③初始β受体阻滞剂治疗。排除标准:①慢性阻塞性肺疾病急性发作患者;②Ⅱ度及以上的房室传导阻滞,心率小于60次/分,收缩压小于100 mmHg的低血压;③休息状态下有症状的外周血管疾病;④急性心衰;⑤有哮喘史的患者。共纳入100例患者,随机等分为比索洛尔组和对照组。研究方法经医学伦理委员会的批准,所有患者签属知情同意书。
1.2 方法
所有患者采集病史,进行体格检查、心电图、实验室检查;应用6 min步行试验、NT-proBNP和心脏超声;并进行肺功能检查,其内容包括:第一秒用力呼吸量、肺活量、呼气峰值流速。所有患者均给予规范的原发病治疗、COPD治疗和心衰的治疗。比索洛尔组在对照组治疗基础上加用比索洛尔,β受体阻滞剂每2~4周上调1次,到目标剂量或最大耐受剂量,然后4~6周的维持期,并随访1年观察肺功能、心功能和COPD急性发作情况。
1.3 统计学处理
2 结 果
2.1 患者的基线资料及随访结果
共纳入了100位患者,平均年龄73±7.4岁,男性占69%,主要合并症为中(76%)到重度(24%)COPD,FEV1为1531±452 ml,在基线水平二组差异无统计学意义,见表1。表2反映了基线及随访过程的肺功能参数。FEV1在比索洛尔组明显增高(1577±410至1678±419 ml,P=0.046),但在对照组无明显差异(1524±424 ml至1534±448 ml,P=0.44),在比索洛尔组33例(66%)患者FEV1增加,在对照组24例(48%)患者增加,比索洛尔组有17例患者下降,对照组26例;峰值呼气流速均无明显改善;比索洛尔明显的降低心率(75±14 vs 68±10次/分P=0.007),对照组则无明显改变(78±14 vs 78±12次/分,P=0.76),两组有明显差异(68±10次/分 vs 78±12次/分,P=0.014);对收缩压及舒张压的影响二组在基线水平及随访期间均无明显差异,BNP在42%的比索洛尔患者及65%的对照组患者增加,但是差异无统计学意义(1310±256 vs 1359±463 pg/ml,P=0.86;1340±1296 pg/mlVS1531±1507 pg/ml,P=0.24)。见表2。
2.2 药物达标率及不良反应
平均剂量比索洛尔是4 mg,可耐受目标剂量的患者占48%。在随访期间一共12件不良反应发生在9例患者,占18%。大多数是轻度的和暂时的,不需要干预措施。在3例患者中被迫停药,1例因为低血压,2例因为心动过缓;减量的占6例,临时停药的有2例。
2.3 随访期间COPD急性发作
在比索洛尔组随访最短45周,最长68周,平均368 d。比索洛尔组COPD急性发作114例次,平均2.14±0.58例次,对照组COPD急性发作127例次,平均2.67±0.57例次,两组比较P<0.05。

表1 患者的基本资料
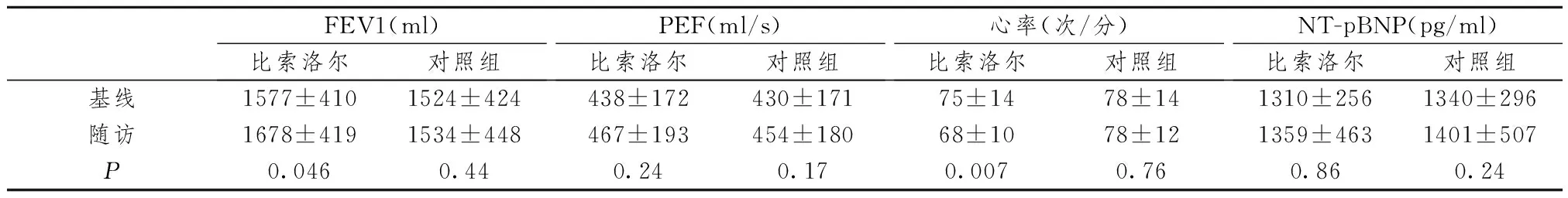
表2 呼吸功能的影响
3 讨 论
通过本研究可以得出以下结论,合并COPD的心功能不全患者可以使用比萦洛尔,患者耐受性好累,近一半患者可达到目标剂量。未加重COPD患者的急性发作,不加重COPD症状,且改善肺功能。在本研究中比索洛尔的平均用量达4 mg/d,达目标剂量者占48%。经为期1年的随访,心率平均下降了8次/min,BNP在42%的比索洛尔患者中增加,但总体水平差异无统计学意义,总体达到了控制心率,减缓心功能下降的目的。与其它β受体阻滞剂不同,在应用比索洛尔后,不仅无FEV1的下降,反而较对照组及用药前出现增高,说明对肺功能有一定的改善作用,其机制不明,也可能是心功能改善所致。且患者可以耐受。本研究的结果与以往的研究一致[8]。在AGOSTONI的研究中[11]也发现比索洛尔与其它β受体阻滞剂相增加FEV1水平。在我们的研究中,比索洛尔增加FEV1,但仍有17例患者出现FEV1的下降,说明比索洛尔对FEV1的影响还存在个体化因素,不可一概而论;针对某个体患者还应用具体分析,即不能全部应用,也不可因潜在的不良反应而把比索洛尔排除在所有合并COPD的心衰患者之外。有的研究就认为即使在存在支气管激发试验阳性的患者中,也可以使用β受体阻滞剂[12]。甚至在部分哮喘患者也可以选用β受体阻滞剂[13]。
有18%的患者出现不良反应,大多数是轻度的和暂时的,不需要干预措施。仅有3例因低血压或心动过缓而停药,停药后血压及心率均恢复。在随后1年的随访中,比索洛尔组COPD急性发作次数明显少于对照组,并不象人们想象中的那样促进COPD的急性发作。其可能原因是长期应用β受体阻滞剂后患者的心功能改善,而心功能改善是降低肺部感染的重要因素,且心功能改善后肺部充血改善,从而增加了肺的交换功能,从总体上降低了急性发作的可能性。在临床实践中,受传统认识的影响,有很多临床医师把COPD作为β受体阻滞剂治疗的禁忌症,不仅COPD患者β受体阻滞剂用药率低,而且遇到应用β受体阻滞剂者随意停用,不能客观分析其作用,虽然β受体阻滞剂可引起气管痉挛加重病情,但这种副作用多是暂时的,在我们的研究中有3例患者停药,均不是因为呼吸道症状,而是因为血流动力学的改变,随意停药是不适当的,可导致患者不能受益。BNP可反应COPD患者的心功能状况[14],在本研究的随访过程中也观察到BNP的暂时升高,但是这种差异没有统计学意义。针对心功能很差,COPD急性发作期的患者应从小剂量开始,缓慢增加剂量,不一定要把调整的间期定为2周[15],密切观察症状变化。一旦开始了β受体阻滞剂的治疗,就不要轻易停用,应用药物时间越长患者受益越大。一项大型的研究中,给3721名患者应用卡维地洛,6个月后,平均剂量为31±11 mg,达50 mg的占26%,25 mg的占35%,11%的患者出现不良反应或减量,而停药的仅为1.4%。
本研究局限性在于,这是一个单中心的研究,样本量也偏小。也不能排除由于心功能不全导致的肺功能下降。
总之,合并COPD的心衰患者不能放弃β受体阻滞剂。我们的研究与以前的结果相似,也显示患者可以耐受β受体阻滞剂。在临床实践中,减慢剂量增加速度、密切观察随访、注意制剂的选择可以保证患者的安全,以改善患者的管理。
[1] Von Haehling S, Lainscak M, Doehner W, et al. Diabetes mellitus, cachexia and obesity in heart failure: rationale and design of the Studies Investigating Co-morbidities Aggravating Heart Failure (SICA-HF)[J]. J Cachexia Sarcopenia Muscle,2010,1:187-194.
[2] Von Haehling S, Anker SD. Cachexia as a major underestimated and unmet medical need: facts and numbers[J].J Cachexia Sarcopenia Muscle,2010,1:1-5.
[3] Dickstein K, Cohen-Solal A, Filippatos G, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008: the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM)[J]. Eur J Heart Fail,2008,10:933-989.
[4] Flu W-J, van Gestel YRBM, van Kuijk J-P, et al. Co-existence of COPD and left ventricular dysfunction in vascular surgery patients[J]. Respir Med,2010,104: 690-696.
[5] Matera MG, Martuscelli E, Cazzola M. Pharmacological modulation of b-adrenoceptor function in patients with coexisting chronic obstructive pulmonary disease and chronic heart failure[J]. Pulm Pharm Ther,2010,23:1-8.
[6] Hawkins NM, Petrie MC, MacDonald MR, et al. Heart failure and chronic obstructive pulmonary disease: the quadrany of beta-blockers and betaagonists[J]. J Am Coll Cardiol,2011,57:2127-2138.
[7] 罗巍,陈云辉,方长庚,等.β受体阻滞剂应用于COPD并慢性心功能不全的临床观察[J].临床肺科杂志,2006,11(3):324-325.
[8] Jabbour A, Macdonald PS, Keogh AM, et al. Differences between beta-blockers in patients with chronic heart failure and chronic obstructive pulmonary disease[J]. J Am Coll Cardiol,2010,55:1780-1787.
[9] Dngen HD, Apostolovic S, Inkrot S, et al.On behalf of the CIBIS-ELD investigators and Project Multicentre Trials in the Competence Network Heart Failure. Titration to target dose of bisoprolol vs. carvedilol in elderly patients with heart failure: the CIBIS-ELD trial[J]. Eur J Heart Fail,2011,13:670-680.
[10] Hawkins NM, MacDonald MR, Petrie MC, et al. Bisoprolol in patients with heart failure and moderate to sever chronic obstructive pulmonary disease: a randomized controlled trial[J]. Eur J Heart Fail,2009, 11:684-690.
[11] Agostoni P, Contini M, Cattadori G, et al. Lung function with carvedilol and bisoprolol in chronic heart failure: is beta selectivity relevant Eur[J]. J Heart Fail,2007,9:827-833.
[12] Salpeter S, Ormiston T, Salpeter E. Cardioselective betablockers for chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev,2005:CD003566.
[13] Kotlyar E, Keogh AM, Macdonald PS, et al. Tolerability of carvedilol in patients with heart failure and concomitant chronic obstructive pulmonary disease or asthma[J]. J Heart Lung Transplant,2002,21:1290-1295.
[14] 侯士云.血B型尿钠肽前体在急诊老年COPD合并心衰患者中的临床意义探讨[J].临床肺科杂志,2014,19(4):630-631.
[15] McDonagh TA, Blue L, Clark AL, et al.On behalf of Heart Failure Association Committee on Patient Care. European Society of Cardiology Heart Failure Association Standards for delivering heart failure care[J]. Eur J Heart Fail,2011,13:235-241.
The application of bisoprolol in heart failure patients with chronic obstructive pulmonary disease
LI Yan LIU Yu
(Yanggu Xian Pepple's Hospital, Yanggu 252300,China)
Objective: To observe the effects of bisoprolol to acute exacerbation and pulmonary function of chronic obstructive pulmonary disease(COPD) in heart failure patients.Methods: 100 patients were divided into two groups, one received bisoprolol and another group received placebo, increase the dosage gradually to the maximum tolerated dose or target dose over 3 months. To observe the difference of pulmonary function, electrocardiograph(ECG) and brain natriuretic peptide(BNP) between two groups.Results: We randomized 100 patients to receive bisoprolol or placebo, titrated to maximum tolerated dose or target dose over 3 months. In bisoprolol group 32 patients got the target dose, 6 had adverse reaction. The forced expiratory volume in 1 s (FEV1) increased significantly (1561±414 ml vs1698±519 ml,P=0.046), but the deference in placebo group had not statistical significance(1532±421 ml vs1508±417 ml,P=0.346). bisoprolol lowed the heart rate significantly(75±14 vs 68±10,P=0.007). BNP was similar in the bisoprolol and placebo groups. The number of COPD exacerbations was deference significantly in the bisoprolol and placebo groups, the bisoprolol group was less (2.14±0.58 vs 2.67±0.571,P<0.05).Conclusion: The heart failure patients concomitant COPD could receive bisoprolol, and tisoprolol could improve the pulmonary function, it is safety in stable stage.
heart failure; chronic obstructive pulmonary disease; bisoprolol; pulmonary function
李艳(1973—),女,山东阳谷人,副主任医师,本科,主要从事临床心内科工作。
R541
A
1004-7115(2017)02-160-03
10.3969/j.issn.1004-7115.2017.02.014
2016-11-23)
